c-Ha-ras在转基因小鼠模型C57-ras各组织中的表达谱分析
刘甦苏 ,周舒雅 ,高正琴 ,左琴 ,岳秉飞 ,贺争鸣 ,刘佐民 ,张冰 ,范昌发
1.中国农业大学 动物医学院,北京 100083;2.中国食品药品检定研究院 国家啮齿类实验动物种子中心,北京 100050
随着20世纪70年代转基因技术的出现,转基因动物模型越来越多地被用于人类疾病的相关研究。传统的建立转基因模型的方法,是将人工分离或修饰过的基因通过显微注射系统等导入受体基因组,由于导入基因(即转基因)的表达,可引起生物体遗传性状的修饰。由于转基因为随机插入受体基因组,转基因的整合和表达效率,及其在世代传递中能否稳定遗传是研究者关注的问题[1]。位置效应[2]、外源基因的表观遗传学修饰[3-5]和遗传效率[6-7]是研究外源基因沉默机制的三个主要方面。但是,完全弄清楚上述机制是非常费时费力的工作,通常可以通过监测转基因的表达水平、组织分布及遗传稳定性来间接证实,并由此判断转基因模型是否可用。
C57-ras癌症动物模型是本单位通过原核注射方法,将人源原癌基因c-Ha-ras导入C57BL/6小鼠基因组中自主建立的,旨在根据人用药品注册技术国际协调会议(ICH)指导原则S1B[8]的要求,用于新药临床前致癌性安全评价,在我国建立基于转基因动物模型的致癌性安全评价替代方法[9-10]。
我们拟通过半定量和荧光定量PCR方法,分析转基因c-Ha-ras在小鼠各组织中的表达,并比较其表达量,以期为首建鼠系的遴选、检测转基因是否稳定遗传等提供数据支持。
1 材料和方法
1.1 材料
C57-ras模型为通过原核注射方法将人源原癌基因c-Ha-ras导入C57BL/6小鼠基因组的方法自主建立,模型小鼠饲养于国家啮齿类实验动物种子中心[SCXK(京)2009-0017],繁育环境为SPF级,饲养和实验在清洁级环境中进行。首建鼠系为No.2、No.3和No.5,系按照获得首建鼠的时间顺序编号确立。多数情形下,每次实验取3只小鼠,数据为3只小鼠的平均值,或将3只小鼠的RNA样品等量混合,在相同条件下进行半定量或定量PCR分析。本实验在中国食品药品检定研究院实验动物伦理委员会监督下进行。
TRIzol试 剂 、RT-PCR 试 剂 盒 、SYBR Premix Ex TaqⅡ荧光定量PCR试剂盒购自大连宝生物公司;Fast Reaction八连管及盖购自ABI公司;TE缓冲液、TAE缓冲液参照《分子克隆实验指南》自行配置;其他常见生化试剂如乙醇、异戊醇、苯、氯仿等购自北京化学工业集团有限公司;检测仪器为ABI 7500荧光定量PCR仪、Thermo nanodrop 2000微量紫外分光光度计;引物由诺赛基因公司合成(表1)。
1.2 总RNA的提取及逆转录反应
TRIzol法提取总RNA,取等量各组织总RNA,除去基因组DNA进行逆转录反应。逆转录采用宝生物公司的Prime Script RT reagent Kit,逆转录反应体系 20 μL,其中总RNA 1 μL,具体操作参照说明书。逆转录得到c-Ha-ras基因cDNA后,以cDNA为模板进行PCR扩增。
1.3 半定量RT-PCR检测不同组织中的转基因表达水平
根据c-Ha-ras基因cDNA序列设计引物,上游引物为RT-PFEX1,下游引物为RT-PREX4,目的片段长580 bp,选择GAPDH基因为内参基因。取等量RNA逆转录为cDNA,以等量cDNA为模板分别扩增相应基因,产物用1.5%琼脂糖凝胶电泳鉴定。如果GAPDH基因扩增成功,表明反应体系正常,无论c-Ha-ras基因是否获得扩增,结果均可信;反之,如果GAPDH基因扩增不成功,无论c-Ha-ras基因是否获得扩增,本次结果不可取,须重复。内对照和实验组在相同条件下同时进行。
1.4 荧光定量RT-PCR(qRT-PCR)检测不同组织中的转基因表达水平
同样选用GAPDH为内参基因,设计qRT-PCR引物,c-Ha-ras基因特异上游引物为RQ-RAS-F,下游引物为RQ-RAS-R,目的片段长177 bp。测定cDNA浓度并稀释至50 ng/μL。qRT-PCR反应体系:SYBR Premix Ex TaqⅡ(Tli RNase H Plus)(2×)10.0 μL,上下游引物(10 μmol/L)各 0.3 μL,cDNA 模板 2 μL,ROX Reference DyeⅡ(50×)0.4 μL,加ddH2O至20 μL。反应条件:95℃ 30 s预变性,随后95℃ 5 s、62℃ 30 s,40个循环。
荧光素设定为SYBR GreenⅠ,反应结束后进行熔解曲线分析。检测采用real-time PCR相对定量法(ΔΔCt法)[11],qRT-PCR 结果用 2-ΔΔCt进行分析,计算转基因c-Ha-ras在C57-ras癌症小鼠各组织中的相对表达量。
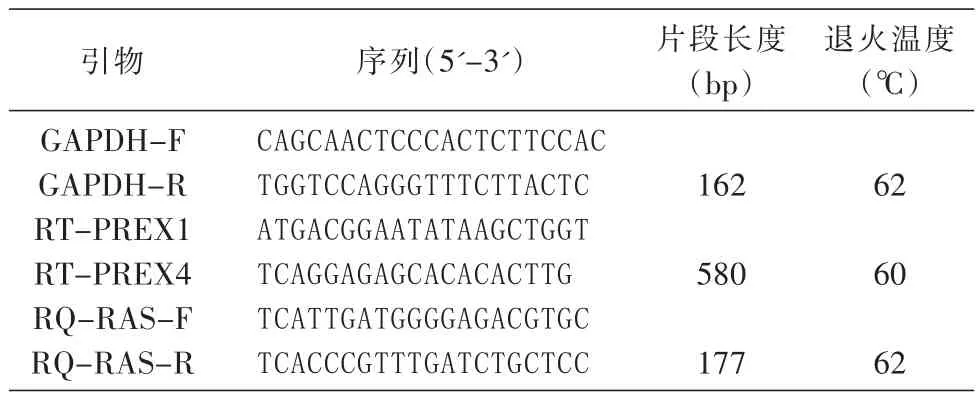
表1 半定量RT-PCR及qRT-PCR引物序列及退火温度
2 结果
2.1 半定量PCR和qRT-PCR方法的建立
根据转基因c-Ha-ras的外显子区域和内参基因GAPDH序列设计引物,并通过梯度PCR优化退火温度,以扩增出单一条带为最佳退火温度。将同一样品同时扩增转基因和内参基因,当内参基因能顺利扩增出来,阴性对照无扩增情况,记录扩增结果。
用SYBR GreenⅠ荧光嵌合法检测,建立qRTPCR方法。首先分析了内参基因和转基因的溶解曲线,以检测本反应体系的特异性[12]。图1显示,2个基因的溶解曲线主峰单一,表明特异性较好,扩增条件可靠。
2.2 半定量RT-PCR检测不同组织中的转基因表达水平
本实验所建立的C57-ras癌症小鼠模型将用于临床前新药的致癌性安全评价[13-14],所以我们期望转基因c-Ha-ras能全身表达。
选取No.2系8周龄C57-ras小鼠,提取其心、肝、脾、肺、肾、睾丸、胸腺、胃、肌肉、皮肤、淋巴结、小肠、血液等13个样本的总RNA,同时检测GAPDH和转基因c-Ha-ras的表达。结果如图2,内参基因在不同组织中均能稳定扩增,包括来自野生型的肝组织。转基因c-Ha-ras在各组织中均有表达,能大体区分出在心、肝、脾脏和血液组织中的表达量较低,而在皮肤、小肠和肺组织中的表达较强。这表明转基因c-Ha-ras为全身表达,与文献报道一致[15-16]。其他2个首建鼠系转基因的组织表达与No.2类似。
2.3 不同首建鼠系转基因c-Ha-ras的组织表达
继上述半定量RT-PCR分析转基因的组织表达分布之后,选取No.2、No.3和No.5共3个系的8周龄小鼠,用荧光定量RT-PCR分析心、肝、脾、肺、肾、睾丸等6个组织中的转基因表达,结果见图3。该基因在所建立不同系小鼠的6个组织中均有表达,但不同组织中的表达量不同,均表现为在肝脏中表达相对较低,而在肺脏中表达最强。每次实验均单独选取同一个系动物,测定转基因在其6种组织中的表达量。分别以心脏组织中的表达量为参照,计算各组织中c-Ha-ras基因的相对表达量(表2),No.3和No.5系小鼠的肺脏表达量是心脏的6~7倍,最低的No.2系为3倍,表明该转基因在肺脏中高表达。ΔΔCT=(CTc-Ha-ras-CTGAPDH)样本组-(CTc-Ha-ras-CTGAPDH)对照组,计算改变倍数(2-ΔΔCT)得出数据。2-ΔΔCT表示目的基因的表达相对于内参基因的变化倍数,用这一方法可直接得到目的基因相对于内参基因的含量[9]。
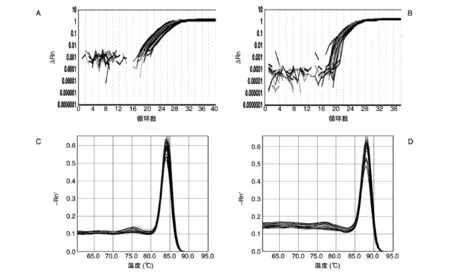
图1 GAPDH和c-Ha-ras基因的扩增曲线和熔解曲线

图2 GAPDH内参基因和人源c-Ha-ras基因半定量RT-PCR反应
2.4 不同首建鼠系间转基因c-Ha-ras的表达
在转基因研究中往往会得到多只首建鼠,而由于传统的制作转基因小鼠的方式决定了转基因在小鼠基因组中为随机插入,插入位点会影响转基因的表型,故须对获得的首建鼠进行筛选,以选择更加符合要求的首建鼠用于繁殖建系。本次转基因共获得6只首建鼠,其中3只成功建系。鉴于本模型的用途,我们希望选择转基因高表达的首建鼠系。通过上述分析,我们观察到在3个首建鼠系中,转基因c-Ha-ras在各组织中的表达差异呈相似特征,即在肺组织中最高,而在肝脏中表达较低。为了比较不同首建鼠系间转基因的表达差异,以筛选出表达最高的首建鼠系,选取3个首建鼠系中8周龄的C57-ras表达量最高的肺组织为代表,在相同条件下比较转基因的相对表达量,结果见图4,No.5系表达量最高,No.2次之,No.3系最低。
2.5 不同时期肺组织中转基因c-Ha-ras的表达

图3 不同首建鼠系中转基因c-Ha-ras在各组织中的表达量

表2 不同首建鼠系各组织中c-Ha-ras基因的表达
为了考察转基因在不同时间的表达水平差异,选取No.3系中8、12和24周龄转基因小鼠的肺脏组织,采用同样方法分析转基因的表达,结果见图5,同一首建鼠系中该基因在组织中的表达呈现时间差异,12周龄时表达量最高,8和24周龄时表达较低。本转基因模型用于新药临床前安全评价时,一般在6~8周开始给药,24周结束,12周左右为肿瘤发生发展时期[17-18]。故本实验中重点选择了上述3个时间点,以期为后续实际运用提供参考。
3 讨论
转基因沉默,即不能正常表达或表达量过低,是建立转基因动物模型过程中常见的现象,也是转基因动物模型建立失败的重要原因[3,19]。
为了较系统地分析C57-ras癌症小鼠模型中转基因c-Ha-ras的表达谱,我们首先用半定量RTPCR分析了心、肝等13种组织样品,结果表明该基因能在小鼠模型中广谱表达,符合建立模型的初衷。进而采用定量RT-PCR方法,分析了心、肝、脾、肺、肾及睾丸等组织中转基因的表达量,发现肺脏中表达最强,肝脏中最弱,在保留的3个首建鼠系中呈现相似规律。3个首建鼠系间的比较表明在No.5中表达较强。以上结果表明转基因能够高表达。鉴于No.5首建鼠系表达最强,可优先考虑保留该系,用于大规模繁殖和建系。由于本实验所用模型已传12代,同样检测到转基因能高表达,间接表明转基因能稳定遗传。

图4 不同首建鼠系间肺组织中转基因c-Ha-ras的表达差异

图5 转基因c-Ha-ras在No.3系首建鼠肺组织中不同时间的表达
转基因癌症小鼠模型是对临床前药物致癌性评价很有价值的研究模型[14]。对于新药致癌性的临床前安全性,传统的评价方法是通过2年期大、小鼠致癌性实验完成的,而转基因动物用于致癌性评价具有时间短(6个月)、费用省、结果可靠、动物使用量少(≤50%/组)等特点[8,17]。这也是目前ICH推荐的快速评价新药致癌性的替代方法之一。目前使用较为广泛的模型有基因敲除模型p53+/-、转基因模型Tg rasH2和XPA+/-等4种[18,20]。虽然国外已建立这些模型,但由于商业价值和知识产权限制,国内很难将其用于商业服务和法定检验中。因此,我们不得不自主从头建立这一模型。
总之,我们通过半定量和荧光定量RT-PCR方法,发现癌症动物模型C57-ras中转基因能稳定地高表达,这为该模型用于新药临床前致癌性安全性评价提供了理论依据。
[1]Houdebine L M.The methods to generate transgenic animals and to control transgene expression[J].Biotechnology,2002,98(2-3):145-160.
[2]Eszterhas S K,Bouhassira E E,Martin D I K,et al.Tran⁃scriptional interference by independently regulated genes oc⁃curs in any relative arrange arrangement of the genes and is influenced by chromosomalintegration position[J].MolCell Bio,2002,22(2):469-479.
[3]Houdebine L M.Transgenic animal bioreactors[J].Transgenic Res,2000,9(4):305-320.
[4]Kouzarides T.Chromatin modifications and their function[J].Cell,2007,128(4):693-705.
[5]Whitelaw E,Sutherland H,Kearns M,et al.Epigenetic ef⁃fects on transgene expression[J].Methods Mol Biol,2001,158:351-368.
[6]Houdebine L M.The methods to generate transgenic animals and tocontroltransgeneexpression.Biotechnology,2002,98(2-3):145-160.
[7]Wang Y,Song Y T,Liu Q,et al.Quantitative analysis of len⁃tiviral transgene expression in mice over seven generations.Transgenic Res,2010,19(5):775-784.
[8]International conference on harmonization.Guidance for indus⁃try S1B testing for carcinogenicity of pharmaceuticals(1997)[EB/OL].http:///www.fda.gov/cder/guidance/index.htm.
[9]范昌发,岳秉飞,王军志,等.含有人源原癌基因c-Ha-ras的转基因小鼠的制作方法及其用途[P],中国专利,200810101666.0,2009-09-16.
[10]周舒雅,左琴,刘甦苏,等.C57-ras转基因小鼠模型的建立[J].药物分析杂志(已接收).
[11]Livak K J,Schmittgen T D.Analysis of relative gene expres⁃sion data using real-time quantitative pcr and the 2-ΔΔCtmeth⁃od[J].Method,2001,25(4):402-408.
[12]Ririe K M,Rasmussen R P,Wittwer C T.Product differentia⁃tion by analysisofDNA meltingcurvesduring thepoly⁃merase chain reaction[J].Anal Biochem,1997,245(2):154-160.
[13]Nielsen L L, Gurnani M, Tyler R D. Evaluation of the wap-ras transgenic mouse as a model system for testing anti⁃cancer drugs[J].Cancer Res,1992,52:733-3738.
[14]范昌发,李波,王军治,等.遗传修饰致癌性动物模型与药物临床前安全性评价[C]∥北方实验动物科技年会,2009:66-68.
[15]Yamamoto S,Mitsumori K,Kodama Y,et al.Rapid induction of more malignant tumors by various genotoxic carcinogens in transgenic mice harboring a human prototype c-Ha-ras gene than in control non-transgenic mice[J].Carcinogenesis,1996,17:2455-2461.
[16]奚涛,王玲玲,成国祥.c-Ha-ras转基因小鼠的构建与鉴定[J].药物生物技术,2001,8(6):301-305.
[17]Note for ICH steering committee.Harmonized tripartite guide⁃line S1B:testing for carcinogenicity of pharmaceuticals[EB/OL].http:∥www.ich.org.1995-09-29.
[18]宋征,徐景宏,马璟.转基因小鼠在药物致癌性评价中的应用[J].中国药理学与毒理学杂志,2010,12(24):557-561.
[19]Ebert A,Lein S,Schotta G,et al.Histone modification and the control of heterochromatic gene silencing in Drosophila[J].Chromosome Res,2006,14(4):377-392.
[20]Macdonald J,French J E,Gerson R J,et a1.The utility of genetically modified mouse assays for identifying human car⁃cinogens a basic understanding and path forward[J].Toxicol Sci,2004,77:188-194.

