酞菁功能化纤维素纳米纤维的制备与表征
陈世良,胡文昱,吴金彪,林玉光,杨峰富
(杭州师范大学钱江学院,浙江 杭州 310036)
酞菁功能化纤维素纳米纤维的制备与表征
陈世良,胡文昱,吴金彪,林玉光,杨峰富
(杭州师范大学钱江学院,浙江 杭州 310036)
通过静电纺丝技术制备乙酸纤维素纳米纤维,经水解、氧化处理后将四氨基钴酞菁共价固定于纳米纤维表面,制备得到酞菁功能化纤维素纳米纤维. 通过场发射扫描电子显微镜和紫外-可见漫反射光谱对纳米纤维进行表征. 利用单因素法研究酞菁的最佳固定量,结果表明:氧化温度30 ℃,高碘酸钠浓度25 mmol/L,氧化时间7 h,四氨基钴酞菁溶液浓度20 mmol/L时,纳米纤维表面酞菁固定量达到365 μmol/g.
静电纺丝;纤维素;纳米纤维;酞菁;功能化
静电纺丝是一种简便有效的制备一维纳米材料的方法,所得纳米纤维直径在数纳米至数微米之间,具有超高比表面积和高孔隙率,纤维之间的堆积状态可根据需要进行调控,因此过去几十年该技术在研究领域和商业领域均受到广泛的关注[1-4]. 在众多可用于静电纺丝的聚合物中,纤维素及其衍生物以其来源广泛、价格低廉、可生物降解、机械性能优异、无毒副作用和稳定性高等优异的性能脱颖而出. 更为重要的是,纤维素分子上含有大量的羟基官能基团,可方便地调控其结构,也可根据不同的需要使各种反应在其上进行[5-9],有机或无机功能性物质可方便地固定于纤维素纳米纤维表面,以此制备基于纤维素纳米纤维的功能化纳米材料[10-12].
金属酞菁化合物是一类性能优异的功能性小分子,可作为催化剂应用于各类催化氧化还原反应[11, 13-16]. 然而,小分子金属酞菁在溶液中极易形成二聚体等低活性物种[17],同时在使用后很难被回收,并进入环境造成二次污染. 将酞菁分子固定到固相基体材料上可有效解决以上问题[18-22]. 纤维素纳米纤维综合了纤维素与纳米纤维两者的优点,可作为酞菁催化剂的理想载体材料.
本研究中,笔者通过静电纺丝制备乙酸纤维素纳米纤维,经水解、氧化处理后将金属酞菁共价固定于其表面,制备得到酞菁功能化纤维素纳米纤维(CoPc-NF),反应过程如图1所示.并考察了氧化温度、氧化时间、氧化剂浓度和酞菁溶液浓度等因素对酞菁固定量的影响.
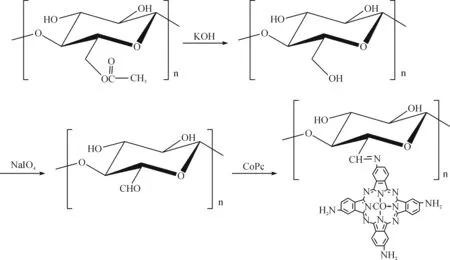
图1 酞菁功能化纤维素纳米纤维(CoPc-NF)的制备Fig. 1 Preparation of CoPc functionalized cellulolse nanofiber CoPc-NF
1 实验部分
1.1 试剂与仪器
乙酸纤维素,中国医药集团化学试剂有限公司;高碘酸钠,分析纯,中国医药集团化学试剂有限公司;N,N-二甲基乙酰胺(DMAc),分析纯,中国医药集团化学试剂有限公司;丙酮,分析纯,中国医药集团化学试剂有限公司;氢氧化钾,分析纯,杭州化学试剂厂.
高压直流电源,GDW-a,天津东文高压电源厂;微量注射泵,WZ-50C2,浙江大学医学仪器有限公司;场发射扫描电子显微镜(FESEM),SIRION-100,荷兰FEI公司;紫外-可见分光光度仪,UV-2450,配有蓝菲光学(Labsphere)漫反射附件,日本SHIMADZU公司.
1.2 CoPc-NF的制备
1.2.1 静电纺丝制备乙酸纤维素纳米纤维(CA-NF)
称取1.261 g乙酸纤维素,加入到由3.60 mL DMAc与6.40 mL丙酮组成的混合溶剂中,室温下磁力搅拌12 h,得到质量分数为13%的乙酸纤维素纺丝液. 静置12 h使纺丝液中的气泡完全脱除. 将纺丝液注入微量进样器中. 典型的纺丝条件如下:纺丝电压17 kV,流速0.3 mL/h,金属针头与收集器之间的距离15 cm,相对湿度60%,静电纺丝时间8 h.
1.2.2 金属酞菁在纳米纤维表面的共价固定化
称取80 mg CA-NF,置于浓度为0.5 mol/L的氢氧化钾乙醇溶液中,25 ℃水浴中振荡反应3 h. 将所得产物浸入到一定浓度的NaIO4溶液中,一定温度下反应数小时后浸入一定浓度的四氨基钴酞菁溶液(溶剂为DMF)中,一定温度下反应数小时. 待反应结束后取出纳米纤维,用DMF清洗至洗液无明显颜色,再用超纯水清洗3次,60 ℃下干燥24 h.
1.3 纳米纤维的表征
1.3.1 场发射扫描电子显微镜测试
剪取适当大小的纳米纤维,用导电双面胶将样品粘在样品台上. 经喷金处理后进行扫描电镜观察,选取合适的观察点,电脑成像.
1.3.2 紫外-可见漫反射光谱(DRS)测试
剪取适当大小的纳米纤维,以BaSO4为参比物质,在配备有蓝菲光学漫反射附件的紫外-可见分光光度计(UV-2450)上进行测试.
1.3.3 CoPc-NF表面酞菁含量的测定
准确称取一定量的CoPc-NF,将其分解于一定量的HNO3中,待完全溶解后由原子吸收光谱测定所得溶液中金属Co的浓度,并换算成CoPc的含量,最终计算CoPc-NF的表面CoPc含量.
2 结果与讨论
2.1 CoPc-NF的制备与表征

图2 酞菁固定化前后纳米纤维的FESEM图Fig. 2 FESEM of OC-NF and CoPc-NF
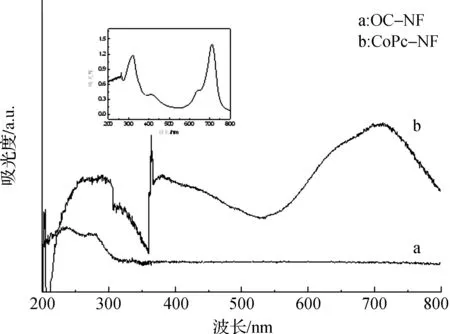
嵌图:CoPc溶液的UV-vis谱图图3 酞菁固定化前后纳米纤维的DRS谱图Fig. 3 UV-vis diffuse reflectance spectra of OC-NF and CoPc-NF
图2(a)为氧化纤维素纳米纤维(OC-NF)的场发射扫描电子显微镜照片. 纳米纤维表面较光滑,纤维粗细均匀,直径约为200 nm. 与之相比,经酞菁溶液处理后的纳米纤维表面变得粗糙(图2(b)),显示酞菁分子的成功固定化. 共价固定酞菁前后纳米纤维的紫外-可见光谱变化如图3所示. OC-NF在整个可见光区域均无吸收. 与酞菁发生化学反应后的纳米纤维则在约710 nm处出现一个明显的特征吸收峰,其形状与四氨基钴酞菁溶液的Q带特征吸收峰形状一致(图3嵌图),进一步证实了纳米纤维表面酞菁分子的存在.
2.2 反应条件对金属酞菁负载量的影响
金属酞菁在纤维素纳米纤维表面的固定化通过两步反应实现:首先用NaIO4氧化纤维素纳米纤维,使其表面形成醛基;然后利用酞菁外环的氨基活性基团与纳米纤维表面的醛基官能团发生化学反应,达到酞菁表面固定化的目的. 结合本课题组前期的工作[23],笔者讨论了氧化温度、氧化时间、氧化剂浓度和酞菁溶液浓度等因素对固定量的影响.
2.2.1 氧化温度对金属酞菁固定量的影响

反应条件:NaIO4浓度25 mmol/L,氧化时间7 h,CoPc浓度20 mmol/L,固定温度30 ℃,固定时间3 h. 图4 氧化温度对纳米纤维表面酞菁固定量的影响 Fig. 4 Effect of oxidation temperature on the immobilization content of phthalocyanine
图4显示氧化温度对于纳米纤维表面酞菁固定量的影响. 在较低温度下,随着氧化温度的升高,制备得到的功能化纳米纤维表面的酞菁含量逐步增加. 氧化温度为10 ℃时,最终CoPc-NF上酞菁固定量约为125 μmol/g;当氧化温度升至30 ℃时,酞菁固定量可达340 μmol/g.
低氧化温度时纳米纤维表面较低的酞菁固定量是由以下因素引起的:NaIO4在低温时的氧化能力不高,且纤维素表面的羟基与NaIO4的作用属于异相反应,要在纳米纤维表面产生足够的醛基,就必须适当提高反应温度,使羟基与NaIO4的反应活性提高. 但进一步提高氧化温度反而导致最终酞菁固定量下降,氧化温度为50 ℃时的最终酞菁固定量不到300 μmol/g. 其中原因可能有二: 首先,酞菁在纳米纤维表面的固定化是通过氨基与醛基发生化学反应实现的. 较高温度下,NaIO4可能将氧化生成的醛基进一步氧化为羧基[24],无法与酞菁分子上的氨基反应,使得酞菁固定量下降. 其次,较高温度氧化可能导致高分子链断裂,使纤维素分子降解[25]. 由于纳米纤维的高比表面积,这个问题显得尤为严重. 基于以上原因,最终确定30 ℃为最佳氧化温度.
2.2.2 氧化剂浓度对金属酞菁固定量的影响

反应条件:氧化温度30 ℃,氧化时间7 h,CoPc浓度20mmol/L,固定温度30 ℃,固定时间3 h. 图5 氧化剂浓度对纳米纤维表面酞菁固定量的影响 Fig. 5 Effect of oxidant concentration on the immobilization content of phthalocyanine
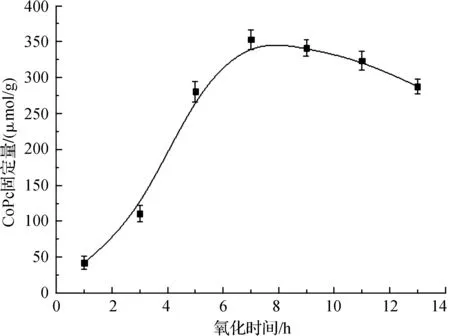
反应条件:氧化温度30 ℃,NaIO4浓度25 mmol/L,CoPc浓度20 mmol/L,固定温度30 ℃,固定时间3 h. 图6 氧化时间对纳米纤维表面酞菁固定量的影响 Fig. 6 Effect of oxidation time on the immobilization content of phthalocyanine

反应条件:氧化温度30 ℃,NaIO4浓度25 mmol/L,氧化时间7 h,固定温度30 ℃,固定时间3 h. 图7 CoPc浓度对纳米纤维表面酞菁固定量的影响Fig. 7 Effect of CoPc concentration on the immobilization content of phthalocyanine
在30 ℃氧化温度下,研究氧化剂浓度对酞菁固定量的影响,结果见图5. 随着氧化剂浓度的提高,制备得到的CoPc-NF表面酞菁含量逐步增加. NaIO4初始浓度为10 mmol/L时,最终酞菁固定量低于100 μmol/g;当氧化剂浓度提高至25 mmol/L时,酞菁固定量增加至约340 μmol/g. 与氧化温度的影响类似,继续提高氧化剂浓度将导致酞菁固定量下降,NaIO4浓度提高至40 mmol/L时,酞菁固定量下降至约280 μmol/g.
纳米纤维表面酞菁固定量随氧化剂浓度变化先增加后减少的原因如下:充足的氧化剂用量有利于纳米纤维表面形成更多的醛基,使得进一步表面酞菁功能化反应能更好地进行. 但氧化剂浓度过高会导致醛基的进一步氧化和纤维素链的降解,导致酞菁固定量下降. 因此,最终确定最佳氧化剂浓度为25 mmol/L.
2.2.3 氧化时间对金属酞菁固定量的影响
固定氧化温度为30 ℃,NaIO4浓度为25 mmol/L,研究氧化时间对酞菁固定量的影响,结果如图6所示. 经1 h NaIO4氧化的纳米纤维表面仅可负载约40 μmol/g的酞菁. 随着氧化时间的延长,纳米纤维表面酞菁负载量迅速增加. 氧化时间为7 h时,纳米纤维表面可负载约350 μmol/g的酞菁. 但进一步延长氧化时间,酞菁固定量有所下降. 氧化时间延长至13 h,CoPc-NF表面酞菁下降至约285 μmol/g. 与氧化温度和氧化剂用量的影响类似,充足的氧化时间可使纳米纤维表面产生更多的醛基活性点. 但氧化时间过长,可能使醛基被进一步氧化为羧基,甚至使纳米纤维发生降解. 因此,最终确定最佳氧化时间为7 h.
2.2.4 酞菁溶液浓度对金属酞菁固定量的影响
在确定以上最优氧化条件的基础上,笔者研究了酞菁溶液浓度对固定化结果的影响,如图7所示. 功能化纳米纤维表面酞菁的固定量随着初始酞菁溶液浓度增加而增加. 酞菁溶液浓度为5 mmol/L时,最终酞菁固定量约为145 μmol/g;当所用酞菁溶液浓度达到20 mmol/L时,最终纳米纤维表面酞菁固定量可达325 μmol/g以上. 进一步提高酞菁溶液的浓度,酞菁固定量增加并不明显.
由于纳米纤维表面醛基的含量是有限的,当这些醛基与酞菁上的氨基共价结合后,溶液中过量的酞菁分子不能继续与纳米纤维发生化学反应,因此无法进一步提高酞菁的固定量. 需要指出的是,仅有不到10%的酞菁分子能成功由溶液中固定到纳米纤维表面. 这是由于酞菁分子仅能与纳米纤维表面的醛基反应,包裹于纤维内部的醛基则很难参与反应. 而且,已固定于纳米纤维表面的酞菁分子会产生排斥作用,阻碍邻近醛基与其他酞菁分子的共价结合. 同时,大分子具有反应不完全性的特点,纤维表面的醛基无法完全参与反应. 综合考虑酞菁的固定量与使用效率,最终确定固定化时使用的酞菁溶液浓度为20 mmol/L.
3 结 论
采用静电纺丝技术制备得到乙酸纤维素纳米纤维,再经过KOH水解和NaIO4氧化两步反应对纳米纤维表面进行了改性,将四氨基钴酞菁以共价键的形式固定于改性后的纤维素纳米纤维表面,得到酞菁表面功能化纤维素纳米纤维材料CoPc-NF. 研究了各反应条件对纳米纤维表面金属酞菁固定量的影响,确定最佳固定条件为:高碘酸钠氧化温度30 ℃,氧化剂浓度25 mmol/L,氧化时间7 h,四氨基钴酞菁溶液浓度20 mmol/L.
[1] Li dan, Xia Younan. Electrospinning of nanofibers: reinventing the wheel?[J]. Advd Mater,2004,16(14):1151-1170.
[2] Bhardwaj N, Kundu S C. Electrospinning: a fascinating fiber fabrication technique[J]. Biotechnol Adv,2010,28(3):325-347.
[3] Reneker D H, Yarin A L. Electrospinning jets and polymer nanofibers[J]. Polymer,2008,49(10):2387-2425.
[4] Haghi A K, Asli K H, Sabermaash E. A review on electrospun polymeric nanosized fibres[J]. J Balk Tribol Assoc,2010,16(4):570-584.
[5] Jonoobi M, Harun J, Mathew A P,etal. Preparation of cellulose nanofibers with hydrophobic surface characteristics[J]. Cellulose,2010,17(2):299-307.
[6] Heinze T, Liebert T. Unconventional methods in cellulose functionalization[J]. Prog Polym Sci,2001,26(9):1689-1762.
[7] O’Sullivan A C. Cellulose: the structure slowly unravels[J]. Cellulose,1997,4(3):173-207.
[8] Sundarrajan S, Ramakrishna S. Fabrication of functionalized nanofiber membranes containing nanoparticles[J]. J Nanosci Nanotechnol,2010,10(2):1139-1147.
[9] Shanmuganathan K, Capadona J R, Rowan S J,etal. Biomimetic mechanically adaptive nanocomposites[J]. Prog Polym Sci,2010,35(1/2):212-222.
[10] Mao Xue, Ding Bin, Wang Moran,etal. Self-assembly of phthalocyanine and polyacrylic acid composite multilayers on cellulose nanofibers[J]. Carbohydr Polym,2010,80(3):839-844.
[11] Boufi S, Vilar M R, Parra V,etal. Grafting of porphyrins on cellulose nanometric films[J]. Langmuir,2008,24(14):7309-7315.
[12] Son W K, Youk J H, Park W H. Antimicrobial cellulose acetate nanofibers containing silver nanoparticles[J]. Carbohydr Polym,2006,65(4):430-434.
[13] Sorokin A B, Kudrik E V. Phthalocyanine metal complexes: versatile catalysts for selective oxidation and bleaching[J]. Catal Today,2011,159(1):37-46.
[14] Tao Xia, Ma Wanhong, Zhang Tianyong,etal. A novel approach for the oxidative degradation of organic pollutants in aqueous solutions mediated by iron tetrasulfophthalocyanine under visible light radiation[J]. Chem-Eur J,2002,8(6):1321-1326.
[15] Tao Xia, Ma Wanhong, Zhang Tianyong,etal. Efficient photooxidative degradation of organic compounds in the presence of iron tetrasulfophthalocyanine under visible light irradiation[J]. Angew Chem Int Edit,2001,40(16):3014-3016.
[16] Sorokin A, Meunier B ,Séris J L. Efficient oxidative dechlorination and aromatic ring-cleavage of chlorinated phenols catalyzed by iron sulfophthalocyanine[J]. Science,1995,268(5214):1163-1166.
[17] Iliev V, Alexiev V, Bilyarska L. Effect of metal phthalocyanine complex aggregation on the catalytic and photocatalytic oxidation of sulfur containing compounds[J]. J Mol Catal A:Chem,1999,137:15-22.
[18] Zanjanchi M A, Ebrahimian A, Arvand M. Sulphonated cobalt phthalocyanine-MCM-41: an active photocatalyst for degradation of 2,4-dichlorophenol[J]. J Hazard Mater,2010,175:992-1000.
[19] Ratnasamy P, Srinivas D. Selective oxidations over zeolite- and mesoporous silica-based catalysts: selected examples[J]. Catal Today,2009,141(1/2):3-11.
[20] Lu Wangyang, Li Nan, Chen Wenxing,etal. The role of multiwalled carbon nanotubes in enhancing the catalytic activity of cobalt tetraaminophthalocyanine for oxidation of conjugated dyes[J]. Carbon,2009,47(14):3337-3345.
[21] Chen Wenxing, Chen Shiliang, Lü Shenshui,etal. Photocatalytic oxidation of phenol in aqueous solutions with oxygen catalyzed by supported metallophthalocyanine catalyst[J]. Sci China Ser B:Chem,2007,50(3):379-384.
[22] Sorokin A B, Tuel A. Heterogeneous oxidation of aromatic compounds catalyzed by metallophthalocyanine functionalized silicas[J]. New J Chem,1999,23(5):473-476.
[23] 黄赋.纳米纤维膜固定化酶及其酶-膜反应器的构建与性能研究[D].杭州:浙江大学,2010.
[24] Bilkova Z, Slovakova M, Lycka A,etal. Oriented immobilization of galactose oxidase to bead and magnetic bead cellulose and poly(HEMA-co-EDMA) and magnetic poly(HEMA-co-EDMA) microspheres[J]. J Chromatogr B,2002,770(1/2):25-34.
[25] Ma Zuwei, Ramakrishna S. Electrospun regenerated cellulose nanofiber affinity membrane functionalized with protein A/G for IgG purification[J]. J Membr Sci,2008,319(1/2):23-28.
PreparationandCharacterizationofPhthalocyanineFunctionalizedCelluloseNanofiber
CHEN Shiliang, HU Wenyu, WU Jinbiao, LIN Yuguang, YANG Fengfu
(Qianjiang College, Hangzhou Normal University, Hangzhou 310036, China)
Cellulose acetate nanofiber was prepared through electrospinning technique, cobalt tetraaminophthalocyanine (CoPc) was covalently immobilized onto the surface of nanofiber after hydrolyzation and oxidation steps. The resulted CoPc functionalized cellulose nanofiber (CoPc-NF) was characterized by FESEM and DRS. The optimum immobilization condition was determined by single factor experimental method. The results show that the amount of immobilized CoPc reaches 365 μmol/g when oxidation temperature is 30 ℃, NaIO4concentration is 25 mmol/L, oxidation time is 7 h, and CoPc solution concentration is 20 mmol/L.
electrospinning; cellulose; nanofiber; phthalocyanine; functionalization
2013-05-20
杭州师范大学钱江学院科研重点项目(2012QJJL06);钱江学院学生科研基金项目(2013QJXS20;2013QJXS15).
陈世良(1983—),男,讲师,博士,主要从事功能化高分子材料研究.E-mail:bruceblue@zju.edu.cn
10.3969/j.issn.1674-232X.2013.06.012
O631.3
A
1674-232X(2013)06-0539-05

