榴莲壳吸附水中十六烷基三甲基溴化铵的研究
黄晓东,娄本勇
榴莲壳吸附水中十六烷基三甲基溴化铵的研究
*黄晓东,娄本勇
(闽江学院化学与化学工程系,福建,福州 350108)
榴莲壳经甲醛/硫酸混合溶液处理后制备成吸附剂。研究了吸附剂对十六烷基三甲基溴化铵(CTAB)的吸附性能,考察了溶液pH值、吸附剂用量、起始浓度、吸附时间、浓度和温度的影响。结果表明,吸附容量在pH值7~11范围内达到最大值,CTAB的去除率随着吸附剂用量增加而增大,当吸附剂用量为0.5 g时,CTAB的去除率达97.5%。吸附容量也随着起始浓度的增加而增大,并在120 min达到吸附平衡。运用3种动力学模型对吸附过程进行拟合,结果表明吸附过程可以很好地用准二级动力学方程描述。吸附等温线用Langmuir方程的拟合效果优于Freundlich或Tempkin方程。在热力学研究中,ΔGo< 0,ΔHo> 0,ΔSo> 0,表明此吸附过程是自发、吸热和熵增加的过程。
榴莲壳;十六烷基三甲基溴化铵;吸附
十六烷基三甲基溴化铵(CTAB)是一种常用的阳离子表面活性剂。它具有良好的杀菌性和水溶性,既耐酸又耐碱,而且易与其它类型表面活性剂相容,因此被广泛应用于洗涤剂、制革、纺织、化工等行业和日常生活中。由于表面活性剂同时具有亲水、亲油基团,难以从水溶液中分离除去,往往随工业以及生活废水排入环境中,给水体中水生动物的正常生理功能带来影响[1-3]。目前CTAB废水处理的主要方法有泡沫分离法[4]、化学法[5-7]、光催化氧化法[8]和吸附法。在这些处理方法中,吸附法由于效率高、操作容易和吸附剂成本低而被广泛的应用的。处理CTAB废水常用的吸附剂有活性炭[9-10]、土壤[11-13]及矿物粉[14-18]等。近年来,一些低成本的农林废弃物材料已作为吸附剂,而被广泛应用于重金属、染料、酚类和磷废水处理,然而用于去除废水中的CTAB的研究却未见报道。
榴莲是一种来自热带的水果,榴莲壳约占果实的二分之一重,榴莲壳主要成分是纤维素、半纤维素、木质素和果胶等,具备有生物质吸附剂的良好材质。但人们在食用榴莲后,往往将榴莲壳当作垃圾丢弃掉,造成资源极大的浪费。将榴莲壳制成吸附剂处理环境废水,不但成本低,而且能变废为宝,保护环境。然而榴莲壳中含有大量的色素物质和可溶性有机物,未经处理直接将榴莲壳制成吸附剂,在使用时会引起溶液中化学耗氧量增加而产生二次污染。因而将榴莲壳进行固色处理,可使吸附剂的化学稳定性提高,消除二次污染。生物质吸附剂常用的固色处理方法通常有环氧氯丙烷法和甲醛法,环氧氯丙烷法是利用生物质材料中的羟基与环氧氯丙烷的交联反应而起到固色作用,而甲醛法则利用甲醛与生物质材料中的羟基发生缩合反应而生成半缩醛或缩醛而起到固色作用[19]。前者由于环氧氯丙烷价格较贵,使用量大而受到限制。本研究采用甲醛处理榴莲壳制备吸附剂,用于吸附去除水中CTAB,并研究了多种因素对CTAB吸附效果的影响,为低浓度含CTAB废水的处理提供一定的科学依据。
1 实验部分
1.1 仪器、试剂与材料
仪器: UV-2550紫外分光光度计(日本岛津公司);pH测试仪828型(美国奥立龙公司);SHA-C水浴恒温振荡器(江苏省金坛市环宇科学仪器厂);JS94H型微电泳仪 (上海中晨数字技术设备有限公司);场发射扫描电子显微镜(美国 FEI公司)。
试剂:十六烷基三甲基溴化铵、甲醛、硫酸、HCl 和 NaOH等均为分析纯;甲醛/硫酸混合溶液(甲醛:硫酸质量比为1:5,硫酸为0.1 mol/L ,甲醛为37 %)。
材料:榴莲壳取自福州永辉超市。用去离子水洗去榴莲壳上黏着的灰尘和杂质,切成小片,然后在75℃烘干,最后粉碎成50目粉末,装入广口瓶中备用。
1.2 吸附剂的制备
称取10 g干燥的榴莲粉置于250 mL 圆底烧瓶中,加入120 g 甲醛/硫酸混合溶液,置水浴中于50 ℃加热回流2 h,抽滤去除溶剂,滤渣用去离子水清洗至中性,然后在50 ℃下烘干,即得改性榴莲粉吸附剂,置干燥器中备用。
1.3 吸附实验
在100 mL具塞锥形瓶中加入一定量吸附剂及不同起始浓度的CTAB溶液25 mL,用0.1 mol/LHCl或0.1 mol/L NaOH调节溶液pH,紧塞瓶塞。将其放入水浴恒温振荡器中,在不同温度条件下以150 r/min速度振荡一定时间后用0.45 µm滤膜过滤,采用甲酚红褪色光度法[20]测定滤液中CTAB平衡浓度,并根据下式计算吸附量q(mg/g)和去除率(%)。
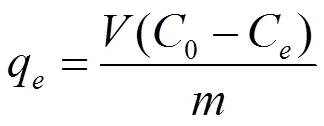
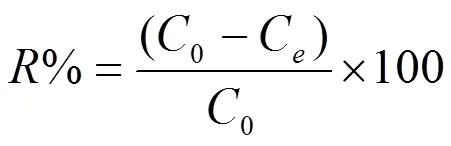
式中,表示溶液体积(L) ,0和e分别表示的CTAB初始浓度和平衡浓度(mg/L),表示所用吸附剂的质量(g)。
2 结果与讨论
2.1 形貌分析
通过扫描电镜考察了榴莲壳改性前后的表面形貌变化(图1),从图1可以看出,改性后的榴莲表面变得更粗糙、有更深凹槽和坑洞,这种表面结构更有利于吸附过程的进行。

(a)未改性榴莲壳 (b)改性榴莲壳
2.2 pH的影响
在pH 1~11范围内,选取CTAB的初始浓度1000 mg/L,用0.1 mol/L HCl或0.1 mol/L NaOH调节溶液pH值,按吸附实验方法,室温下振荡2小时,考察溶液初始pH值对CTAB吸附的影响,结果见图2。由图2可见,pH值在1~4范围内,随pH值的增大,吸附量急剧增大,当pH > 4时,随pH值的增大,吸附量缓慢增大,并在pH值7~11范围内达到最大值。这是因为在溶液中,CTAB解离出十六烷基三甲基铵根 (R-N(CH3)3+)。而在酸性条件下,溶液中大量的H+占据吸附剂表面上吸附点位,形成了带正电荷的吸附点位,由于静电斥力作用,不利于吸附剂对CTAB的吸附。但随着pH升高,吸附量却逐渐增大,这是因为吸附剂表面上正电荷逐渐减少,负电荷增加,对CTAB静电吸附能力逐渐增大,因而吸附容量也随着增大。由图2中吸附剂表面上的zeta电位也可以看出,随pH值的增大,吸附剂表面上的zeta电位由正值变成负值,在pH ≥7后,zeta电位稳定在负的50~60之间,吸附剂表面带上最多的负电荷,这时吸附容量达到最大值且趋于饱和,因此,吸附实验的最佳pH值选为7。
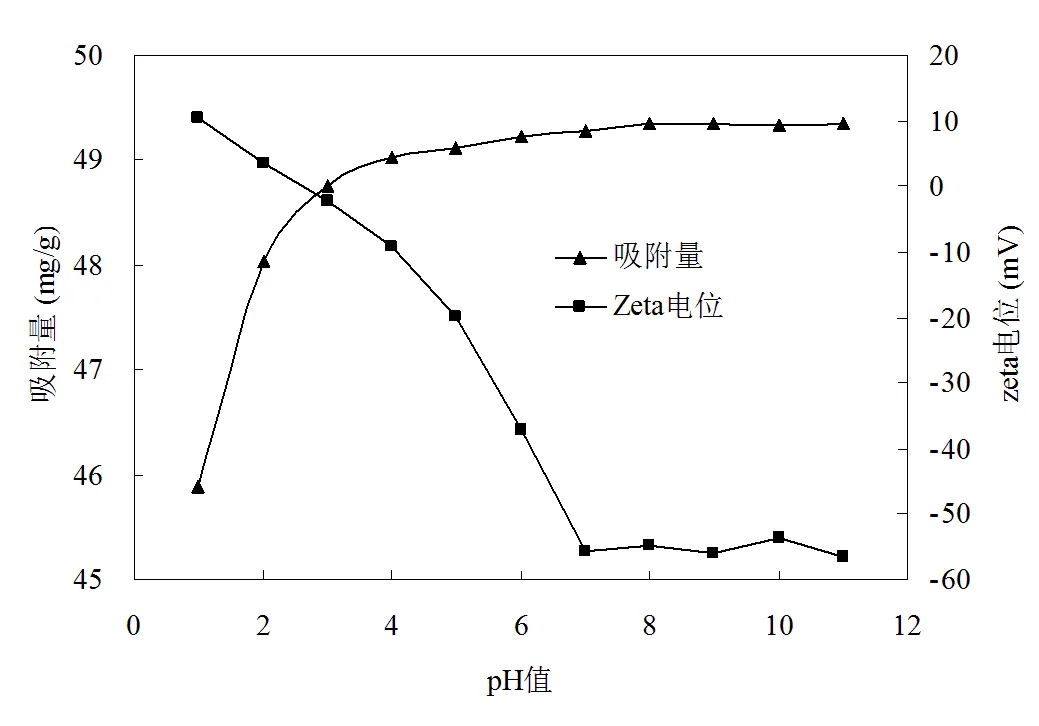
图2 pH对吸附容量和Zeta电位的影响
2.3 吸附剂用量的影响
在100 mL具塞锥形瓶中分别加入不同量吸附剂及25 mL 1000 mg/L CTAB溶液,调节pH值为7,在室温下振荡2 h,按照吸附实验方法测定滤液中CTAB平衡浓度,实验结果见图3。由图3可知,当吸附剂用量从0.1 g增加到0.5 g时,CTAB的去除率由57.7 %增加到97.5 %,进一步增加吸附剂用量,CTAB的去除率基本不变,而吸附容量则趋于稳定,说明吸附接近达到饱和。因此,0.5 g为最佳的吸附剂用量。
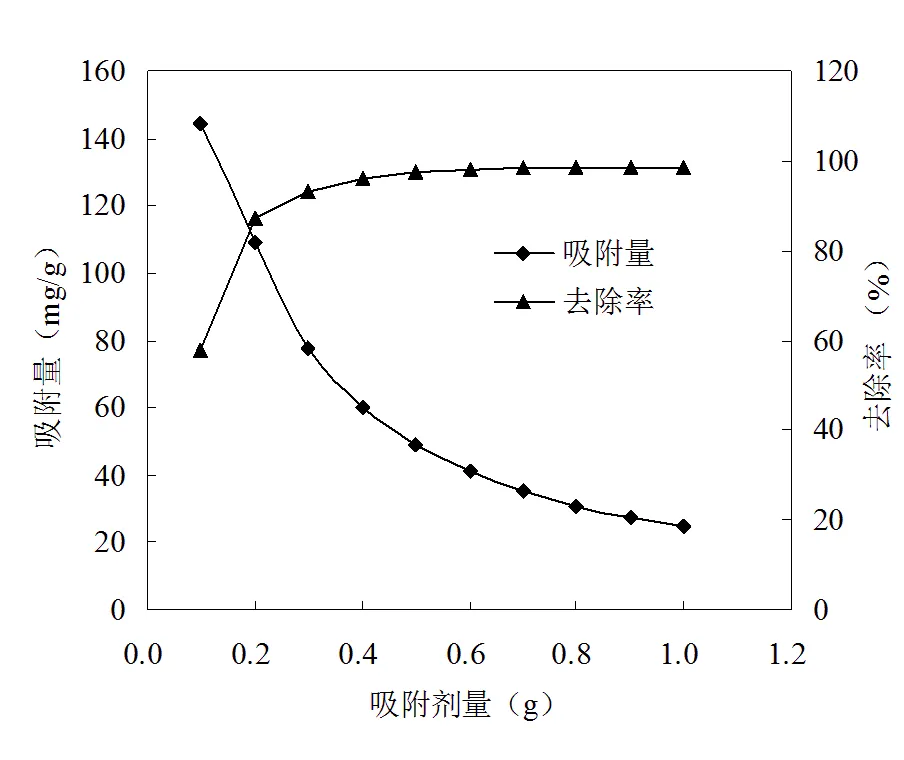
图3 吸附剂用量对去除CTAB的影响
2.4 起始浓度及吸附时间的影响
图4显示不同起始浓度及吸附时间对CTAB吸附的影响,从图4中可以看出,吸附容量随着起始浓度的增加而增大,这可能由于在高浓度时固液界面有较大的浓度梯度,存在着较大驱动力克服了CTAB在溶液和吸附剂固体表面的传质阻抗力,因而起始浓度越大,吸附容量也越大。图4也显示,初始吸附速率很快, 在0~60 min内吸附容量随着时间增加迅速增大,而后缓慢增大,在120 min时吸附基本达到平衡,这主要是由于在吸附初期, 溶液中吸附剂表面的吸附点位较多,CTAB可以容易的与这些点位结合,因此有较高的吸附速率,而后吸附逐渐趋于饱和,因而后续实验选定吸附平衡时间为120 min。
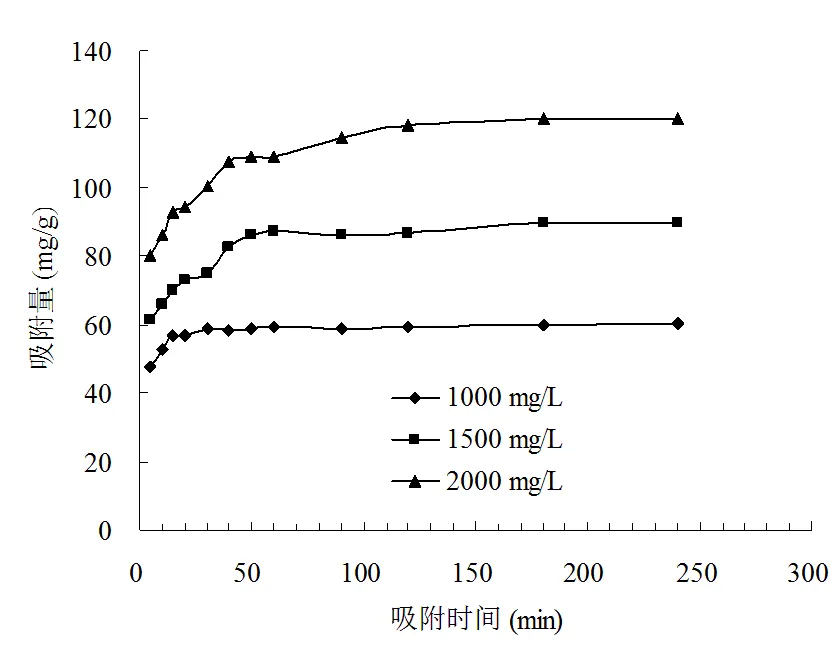
图4 不同起始浓度的动力学曲线
2.5 吸附动力学
吸附过程的动力学研究是描述吸附剂吸附溶质速率快慢的规律。通过对吸附过程中的动力学实验数据进行动力学方程的拟合,从而可以揭示吸附过程的吸附机理。吸附动力学数据可分别用准一级动力学方程(3)、准二级动力学方程(4)和粒子内扩散方程(5)拟合。
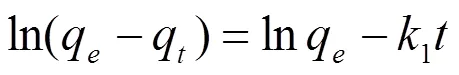
式中,1为准一级速率常数(min-1),q和e分别为时间和平衡时的吸附量(mg/g)。
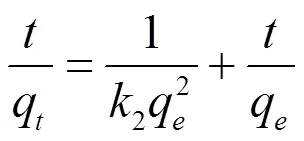
式中,2为准二级速率常数( g/(mg·min) ),q和e分别为时间和平衡时的吸附量(mg/g)。
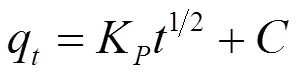
式中,p为粒子内扩散常数(mg/(g·min0.5) ),C 为常数(mg/g)。

表1 CTAB吸附的准一级和准二级动力学方程的参数
表1中列出了准一级和准二级动力学方程的参数。从表1可以看出,准二级方程的相关系数高于准一级方程的相关系数,且准二级方程e的实验值与理论值相差很小。这表明CTAB在改性榴莲壳上吸附过程遵循准二级反应机理。
从粒子内扩散图5可以看出,q对1/2曲线有两个线性阶段,第一阶段是外表面吸附;第二阶段是平衡吸附,在进行较快的外表面吸附阶段后,外表面吸附达到饱和后,CTAB通过粒子间扩散进入吸附剂颗粒内部进行内表面吸附[21]。从表2可以看出,内扩散方程的相关系数低于准二级方程的相关系数,第一阶段的外表面吸附速率常数要比第二阶段通过粒子间扩散到吸附剂内部进行的内表面速率常数大,这与前面分析的初始阶段吸附速率较快,而后吸附速率降低的结果相一致。两个阶段粒子内扩散参数C均不为零,即粒子内扩散动力学方程的拟合曲线不通过原点,说明CTAB在改性榴莲壳内部扩散过程不是吸附速率的唯一控制步骤。
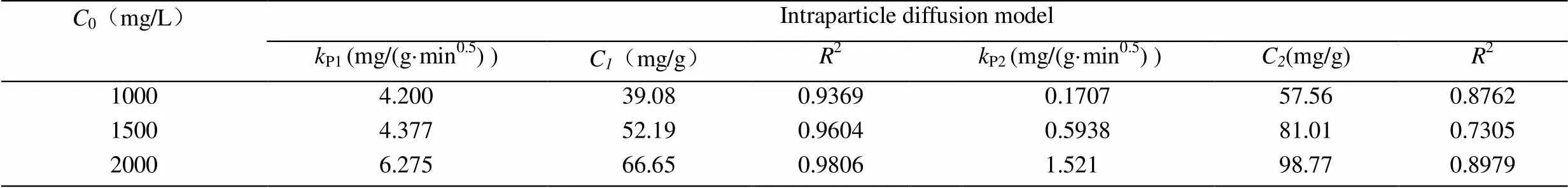
表2 CTAB的粒子内扩散动力学方程的参数
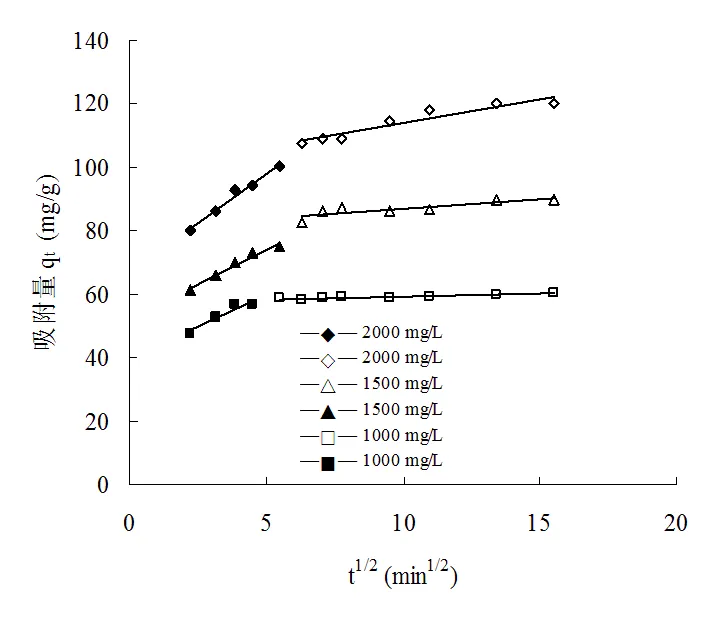
图5 CTAB吸附的粒子内扩散
2.6 吸附等温线
图6为CTAB在改性榴莲壳上不同温度吸附等温线。对平衡数据可分别用Langmuir (6)、Freundlich (7)和Tempkin (8)方程描述吸附等温线模型。
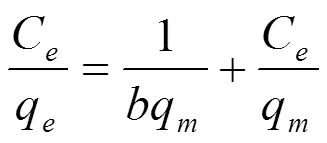
式中,m为吸附剂最大吸附量(mg/g),为吸附常数(L/mg)。
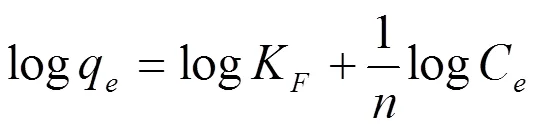
式中,F和是Freundlich等温方程的特征参数,与吸附剂、吸附质种类及温度有关。在固液吸附体系,F可表示吸附量的相对大小[(mg/g)( L/mg)1/n],可表示吸附强度的相对大小,值越大,吸附性能越好。
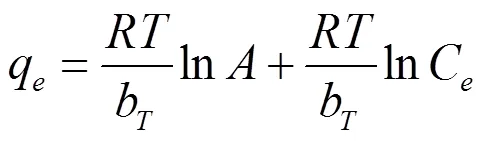
式中:=/T, A为平衡键合常数(L/mg),和最大键合能有关;B为和吸附热有关的常数。
在Langmuir等温方程定义了一个无量纲的分离因子L:
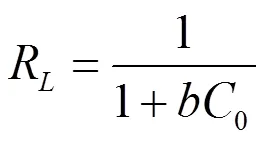
L可用于表示吸附过程的性质,0
表3中列出的是吸附等温线的吸附常数。从表3可以看出,Langmuir方程拟合结果相关系数大于Freundlich方程和Tempkin方程,说明吸附等温线的更符合Langmuir 方程,也说明CTAB在改性榴莲壳上的吸附是优惠单分子层吸附。Langmuir方程中的m和均随温度的升高而增大,说明该吸附过程是吸热过程。图7为不同温度下的Langmuir方程的特征分离因子L,从图中可看出,所有温度的L为0
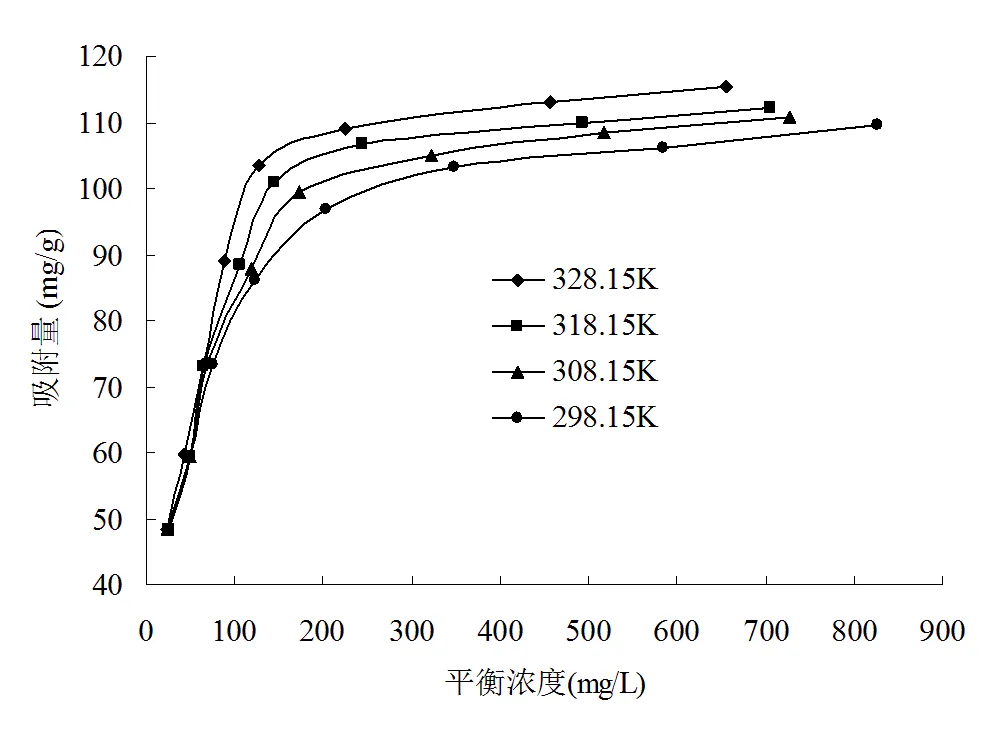
图6 CTAB的吸附等温线

表3 榴莲壳吸附CTAB的等温线常数和相关系数
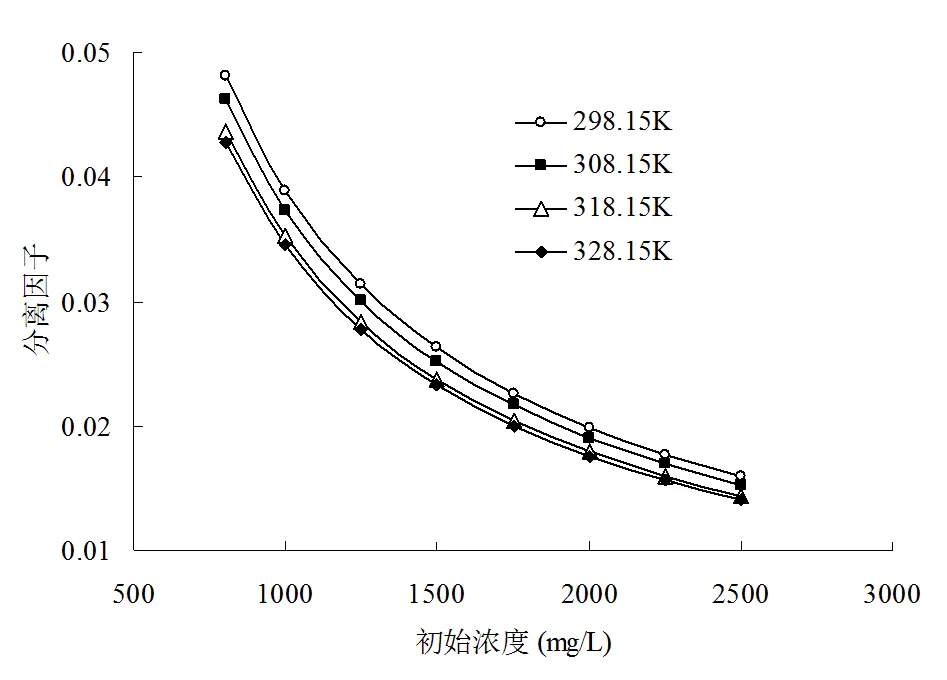
图7 CTAB在榴莲壳上吸附的分离因子
2.6 吸附热力学
吸附过程的热力学参数可以通过方程(10),以ln对 1/作图(图8)的斜率可计算出ΔH,截距可计算出ΔS,并根据(11)计算Δo,其结果列于表4中。
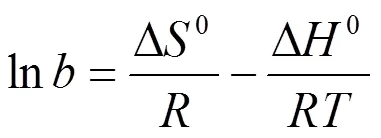
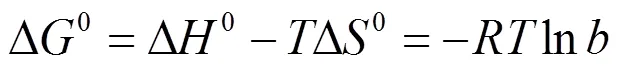
式中:为Langmuir平衡常数(L/mol);为气体常数8.314(J/(mol·K) );为绝对温度(K),ΔS为平衡吸附熵(J/(mol·K)),ΔH为标准吸附焓变(J/mol),ΔG为标准吸附自由能变(J/mol)。
从表4得出:Δo< 0,表明吸附过程是自发的过程, ΔH> 0表明吸附过程是吸热反应过程,高温对吸附有利,这与等温吸附曲线得出的结论相一致。 ΔS> 0表明CTAB在改性榴莲壳上的吸附是熵推动过程。

表4 榴莲壳吸附CTAB的热力学参数
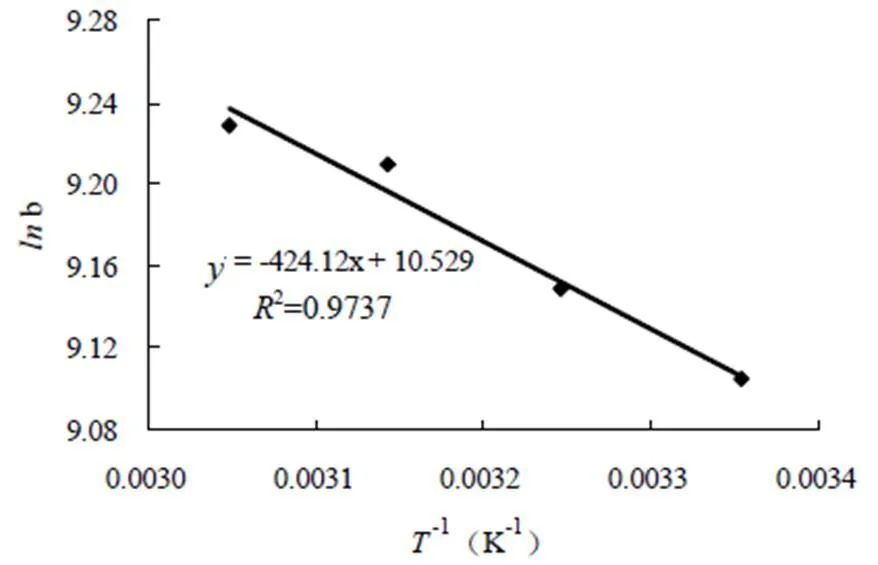
图8 lnb对T-1曲线
3 结论
(1)形貌分析结果表明,改性后榴莲壳表面变得更粗糙、分布着更多的凹槽和坑洞。
(2)吸附过程的pH值在7~11范围内,吸附量最大,最适宜pH值为7.0;吸附剂投放量20 g/L对1000 mg/L CTAB去除率可达97.5%。
(3)吸附动力学研究表明,吸附剂对CTAB吸附约120 min时可达到吸附平衡,吸附动力学可以用准二级动力学方程很好的描述,CTAB在改性榴莲壳内部扩散过程不是吸附速率的唯一控制步骤。
(4)吸附等温线结果表明,用Langmuir方程拟合效果优于用Freundlich 和Tempkin方程拟合效果。0
(5)热力学研究显示,ΔG< 0,表明吸附过程是自发的过程;ΔH> 0表明吸附过程是吸热反应过程;ΔS> 0表明CTAB在改性榴莲壳上的吸附是熵推动过程。
[1] Britton L N. Surfactants and the Environment[J]. Journal of surfactants and detergents, 1998,1(1):109–117.
[2] García M T, Ribosa I., Guindulain T.,. Fate and effect of monoalkyl quaternary ammonium surfactants in the aquatic environment[J]. Environmental Pollution, 2001,111(1):169–175.
[3] Singh R P, Gupta N, Singh S, et al. Toxicity of ionic and nonionic surfactants to six macrobes found in Agra, India[J]. Bulletin of Environmental contamination and toxicology, 2002,69(2):265-270.
[4] Boonyasuwat S, Chavadej S, Malakul P, et al. Anionic and cationic surfactant recovery from water using a multistage foam fractionation[J]. Chemical Engineering Journal, 2003, 93(1): 241–252.
[5] 黄焕标, 尹平河,赵玲.废水中十六烷基三甲基溴化铵的Fenton氧化降解[J].暨南大学学报,2009,30(3):288- 291.
[6] 于晓彩,邵红,王武名. 改性粉煤灰处理含阳离子表面活性剂废水的研究[J]. 环境工程, 2003,21(5): 78-80.
[7] 杨卫华,王鸿辉,曾晓旭. 高铁酸钾处理水中十六烷基三甲基溴化铵[J]. 环境科学, 2009, 30(8):2277- 2281.
[8] 黄焕标, 尹平河, 赵玲. 废水中十六烷基三甲基溴化铵的光降解动力学研究[J]. 生态环境学报,2009,18(1): 88-92.
[9] Gurses A, Yalcin M, Sozbilir M, et al. The investigation of adsorption thermodynamics and mechanism of a cationic surfactant, CTAB, onto powdered active carbon[J].Fuel Processing Technology,2003,81(1):57- 66.
[10] Basar C A, Karagunduz A, Cakici A, et al. Removal of surfactants by powdered activated carbon and microfiltration[J].Water Research,2004,38(8):2117- 2124.
[11] 杨亚提, 孟昭福, 赵敏.土娄土对十六烷基三甲基溴化铵的吸附研究[J]. 西北农林科技大学学报:自然科学版, 2007,35 (2) :149-152, 159.
[12] 张景环,曾溅辉. 表面活性剂在北京碱性土壤中的吸附行为研究[J].环境污染与防治,2007,29(8):571-574, 582.
[13] 李克斌, 刘惠君, 马云.不同类型表面活性剂在土壤上的吸附特征比较研究[J]. 应用生态学报, 2004, 15(11): 2067-2071.
[14] Mishra S K, Panda D. Studies on the adsorption of Brij-35 and CTAB at the coal–water interface[J]. Journal of Colloid and Interface Science, 2005,283(2):294-299.
[15] Gürses A, Karaca S, Aksakal F, et al. Monomer and micellar adsorptions of CTAB onto the clay/water interface[J]. Desalination, 2010,264(1–2) :165-172.
[16] Alkan M, Karadas M, Dogan M,et al. Adsorption of CTAB onto perlite samples from aqueous solutions[J]. Journal of Colloid and Interface Science, 2005,291(2): 309-318.
[17] Biswas S C, Chattoraj D K. Kinetics of adsorption of cationic surfactants at silica-water interface[J]. Journal of Colloid and Interface Science, 1998,205(1):12-20.
[18] 李俊,杨鸿淋. 十六烷基三甲基溴化铵在矿物上的吸附性能研究[J]. 石油化工应用,2010,29(5):25-26,58.
[19] 王格慧,宋湛谦,王连生.树皮的化学改性及其吸附特性研究[J].林产化学与工业,2002, 22(2):12-16.
[20] 余仁军,韩志忠,张学艳. 甲酚红光度法测定痕量阳离子表面活性剂[J].内江师范学院学报,2008,23(4):43-45.
[21] Sun Q Y, Yang L Z. The adsorption of basic dyes from aqueous solution on modified peat-resin particle[J]. Water Research, 2003,37(7):1535-1544.
STUDY ON THE ADSORPTION OF CETYLTRIMETHYL AMMONIUM BROMIDE FROM AQUEOUS SOLUTIONS WITH DURIAN SHELL
*HUANG Xiao-dong, LOU Ben-yong
(Department of Chemistry and Chemical Eengineering, Minjiang University, Fuzhou, Fujian 350108, China)
The durian shells(DS) were modified as adsorbents by treating with a mixed solution of formaldehyde/sulphuric acidand the adsorption behavior for cetyltrimethyl ammonium bromide (CTAB) was investigated. The affecting factors such as solution pH, adsorbent dosage, initial concentration, adsorption time, concentration and temperature were disscussed. The results showed that the adsorption capacity reached a maximum value at pH 7~11 and removal rate of CTAB would increase with the increasement of adsorbent dosage. When the adsorbent dosage was up to 0.5 g, removal rate would reach 97.5%. The adsorption capacity also increases with the increasement of initial concentration, and adsorption equilibrium was achieved after 120 min. Three kinds of dynamic models were used to simulate adsorption kinetics. The result showed that the adsorption process well followed a pseudo-second order equation. The adsorption isotherm could be described very well by Langmuir model rather than Freundlich or Tempkin models. In thermodynamic studies, the parameters of ΔG< 0, ΔH> 0 and ΔS> 0 indicated that the adsorption process was spontaneous and endothermic with a increase of entropy.
durian shell; cetyltrimethyl ammonium bromide; adsorption
X703.1
A
10.3969/j.issn.1674-8085.2013.03.006
1674-8085(2013)03-0022-06
2013-01-12;
2013-03-06
福建省教育厅科技基金项目(2011JB11143);闽江学院科技启动项目(YKQ1005)
*黄晓东(1966-),男,福建福州人,副教授,主要从事水污染防治及分析研究(E-mail: xiaodong701@163.com);
娄本勇(1977-),男,河南延津人,副教授,博士,主要从事物理化学教学与研究(E-mail: lby@mju.edu.cn).

