R-2-氯丙酸脱卤酶的定向进化
秦迎春,刘 鹏,杨立荣,徐 刚,吴坚平
(浙江大学 化学工程与生物工程学系,杭州 310027)
光学纯的S-2-氯丙酸(S-2-CPA)在芳氧丙酸类除草剂合成中具有重要用途。该类除草剂中都有1个手性碳原子,具有2种光学异构体。其中由S-2-CPA合成的D-(-)异构体为高效体,药效比L-(+)异构体高6~12倍[1]。鉴于S-2-CPA重要的工业应用价值,开发高效低成本酶法制备高光学纯度S-2-CPA的方法就很有意义。R-2-CPA脱卤酶可以选择性脱除R-2-CPA中的Cl,当将其用于消旋2-CPA的动力学拆分时,在反应体系中剩余未反应的底物即为S-2-CPA。目前,R-2-CPA脱卤酶的品种少,活性稳定性等性质也不尽如人意,因此仍需要寻找新的R-2-CPA脱卤酶,或者改造原有的R-2-CPA脱卤酶,以适应工业需要。
笔者所在实验室在农药厂附近的含氯污泥中分离到了1株有R-2-CPA脱卤酶活性的菌株[2],林春娇等[3]从该菌株中克隆了 R -2 - CPA脱卤酶DehDIV-R的基因。目前,DehDIV-R野生型基因通过载体pET30a(+)在大肠杆菌BL21构建的工程菌,经诱导条件优化,发现酶的比酶活可达10.43 U/mg,催化能力较强,有很好的工业应用潜力。但是仍有希望通过酶的分子改造获得酶活更高、热稳定性更强的突变体,以适应工业应用要求。
笔者采用定向进化[4-7]的手段建立高通量筛选突变文库,再经过高通量筛选得到酶活提高的突变子,以期研究突变子中突变位点的改变前后对酶催化活力影响的机制。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
大肠杆菌BL21(DE3),DehDIV-R菌株由笔者所在实验室保藏,电转化感受态细胞BL21(DE3)[8]由笔者所在实验室自行制备。表达质粒pET30a(+)购于美国Novagen(WI)公司。
1.1.2 工具酶与试剂
限制性内切酶Eco RI和Hind III以及T4 DNA连接酶、Pfu DNA聚合酶、Taq DNA聚合酶、PCR反应所需试剂均购买于TaKaRa公司。卡那霉素购自Sigma公司,PCR引物由上海生物工程有限公司合成,DNA试剂回收盒购自上海生物工程有限公司。
1.2 方法
1.2.1 高通量筛选方案
根据文献[9]的Cl检测方法,建立了一种基于Cl+浓度的显色反应的高通量筛选方法,用于快速、有效地检测水解R-2-氯丙酸的速率,从而能够对脱卤酶的活性进行初步筛选。对于构建好的DehII-S突变文库,采用96孔板进行表达。操作流程:将40 μL的发酵上清移至96酶标板中,逐步添加60 μL 的饱和 Hg(SCN)2乙醇溶液,150 μL 60 g/L的FeNH4(SO4)2·12H2O(含1%硝酸)水溶液和50 μL试样,室温下放置10 min后,在酶标仪中检测450 nm下的吸光值OD450。
1.2.2 蛋白纯化
先将破胞获得的上清粗酶液用0.22 μm的滤膜过滤,准备上样。使用上样缓冲液A(binding buffer)冲以流速1.0 ml/min平衡 Ni2+亲和层析柱。将过滤后的粗酶液上样,用缓冲液A洗10个柱体积,再用洗脱缓冲液B(20 mmol/L Na3PO4缓冲液(pH 7.4),500 mmol/L NaCl,250 mmol/L 咪唑)洗脱,收集酶液。使用AKTA蛋白质纯化系统用脱盐柱(HiTrap Desalting,GE Healthcare)对纯化后的酶液进行脱盐。为了有较好的脱盐收率和效果,对每次上样量进行调整,确定每次上样量为1.5 mL。脱盐液用 SDS - PAGE[10]分析纯度,并用于后续测定。
1.2.3 蛋白含量测定
蛋白含量采用 Bradford[11]法测定。
1.2.4 酶比活力测定
酶活定义为每分钟催化降解1 μmol 2-氯丙酸生成1 μmol Cl-所需的酶量为1 U。以(S)-2-CPA作为反应底物,采用Gly-NaOH缓冲液(pH 9.5)作为缓冲体系。反应体系为1 mL,底物终浓度是30 mmol/L,在37 ℃下反应0、3、6和10 min。添加1%硝酸终止反应,离心去除酶。酶活通过有机酸柱液相色谱检测底物消耗量方法来计算。
采用高效液相色谱Agilent 1100系统和有机酸柱Bio-Rad HPX-87H(30 cm×7.8 mm)对R-2-氯丙酸和脱卤产物乳酸以及底物谱中的2-氯丙酸、乳酸进行分析测定。测定条件:室温下,流动相为5 mmol/L H2SO4,流速为0.6 mL/min,紫外检测波长为210 nm,进样量为5 μL。2-氯丙酸和乳酸的保留时间分别为20.86和12.289 min,外标法得到的标准曲线分别为:
Y=40.08x,R2=0.9991(x为2-氯丙酸浓度(mmol/L),斜率为40.08);
Y=29.71x,R2=0.9997(x为乳酸浓度(mmol/L),斜率为29.71);
纯酶的比酶活按式(1)计算:

式中:比酶活EA1的单位为U/mg,ΔA为反应时间内紫外吸收峰面积的变化值,V1为反应体系的体积(1 mL),k为标准曲线的斜率,p为酶质量浓度(mg/mL),t为反应时间(min),V2为酶的体积(mL)。
发酵液体积酶活按式(2)计算
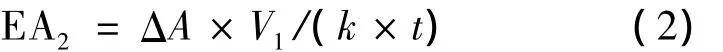
式中:比酶活EA2的单位为U/mL,ΔA为反应时间内紫外吸收峰面积的变化值,V1反应体系的体积(1 mL),k为标准曲线的斜率,t为反应时间(min)。
2 结果与讨论
2.1 突变文库的构建与高通量筛选
以DehDIV-R为模板,在Mg2+浓度为7 mmol/L、Mn2+浓度为0.4 mmol/L的条件下进行易错PCR建库,随机挑取10~20个菌落送去上海生工测序,测得突变率为0.15%。发现满足易错PCR建库要求,保证大部分的突变含1~2个突变位点。通过电转化得到2000多个突变子,构成易错PCR突变文库。经过4次筛选得到的突变子库如表1所示。
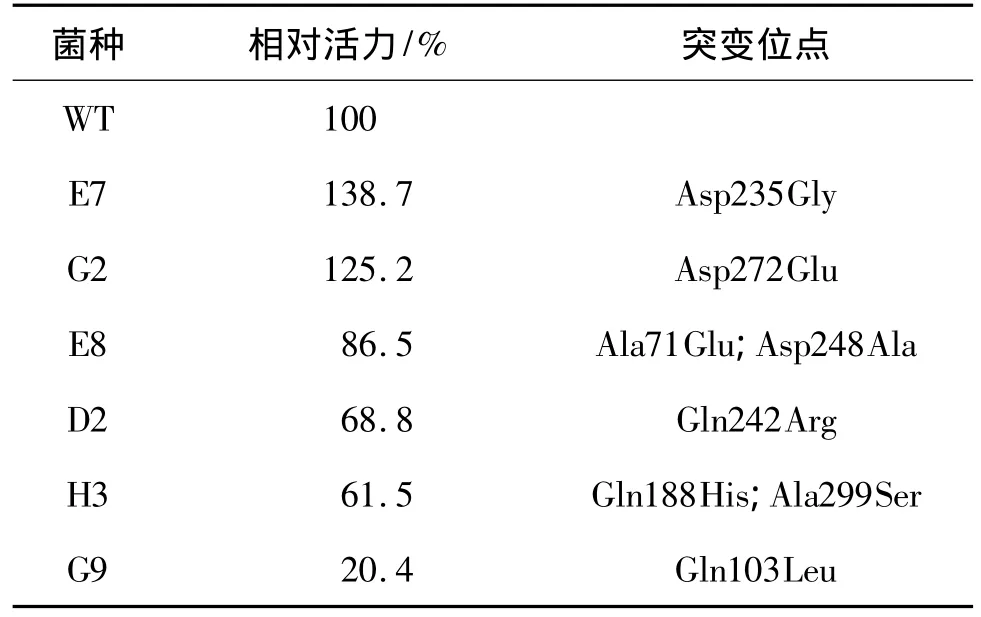
表1 dehDIV-R的突变子库Table 1 Mutant library of dehDIV-R
2.2 突变子的纯化
控制接种量与诱导条件,尽量使突变子表达情况同步,结果如图1所示。由于DehDIV-R的表达载体仍为pET30,所以重组蛋白带有组氨酸标记,采用纯化策略,纯化各个突变子,纯化情况如图2所示。

图1 DehDIV-R不同突变子的SDS-PAGE凝胶电泳Fig.1 SDS-PAGE gel electrophoresis of different DehDIV-R mutants
2.3 同源建模与分子对接
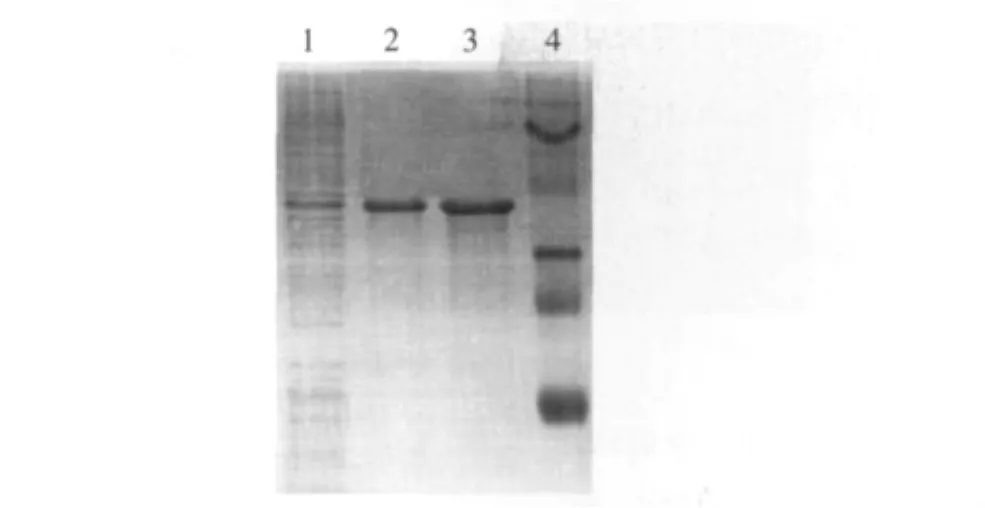
图2 DehDIV-R突变子E7的蛋白纯化Fig.2 Protein purification gel of DehDIV-R mutant E7
为了进一步研究所得突变体的结构与功能变化,并且验证和发展之前对Asn203位点与手性选择性关系的推测,首先使用 Sybyl中的 advanced protein modeling(APM)模块对DehDIV-R进行同源建模分析。选取与DehDIV-R相似性最高(序列相似性23.71%)的来自 Pseudomonas putida PP3的 DehI(PDB:3BJX)酶作为模板,模拟得DehDIV-R的三级结构如图3所示。由图3可知:其Z-score为21.57,可信度为可信(certain)。来自P.putida PP3的DehI(PDB:3BJX)的预测催化机制是酸性氨基酸活化水分子,从Cl-的相反方向进攻底物分子的α-碳原子,从而催化脱卤。出发酶DehDIV-R、突变体DehDIVG2、DehDIV-E7与R-2-氯丙酸的对接结果分别见图4。由图4可知:对接打分与活化能的对应关系,计算得到DehDIV-G2的活化能比DehDIV-R相应的下降0.964 kJ/mol,从而使得DehDIV-G2的比酶活提高了25.2%;DehDIV-E7的活化能比DehDIV-R相应的下降2.5498 kJ/mol,从而使得DehDIV-E7比酶活提高了38.7%。

图3 DehDIV-R的三维结构活性位点与底物结合口袋部分用原子堆积模型标出Fig.3 Three-dimensional structure of DehDIV-R active sites combined with substrate pocket part marked by atomic accumulation model

图4 脱卤酶与R-2-氯丙酸的分子对接模型Fig.4 Molecular docking model of dehalogenation enzyme and R-2-CPA
2.4 双点突变子的酶比活力预测
根据对突变子库中酶比活力提高的突变位点进行的综合分析,发现单点突变未能获得酶比活力大幅提高的进化酶。因此,进一步考察突变双位点对酶比活力的影响。根据突变子DehDIV-E7和DehDIVG2与R-2-氯丙酸的对接结果可知,虽然突变位点都与催化残基位点距离较远,但是对酶催化R-2-CPA有促进作用,使得酶与底物的结合能降低。因此,预测2个突变位点的综合作用,应该可以更大幅度的降低结合能,提高酶催化活力。通过SYBYL模建了4种进化酶,分别为 Asp272Ser,Asp235Ser;Asp272Val,Asp235Ser;Asp272Ser,Asp235Val 和 Asp272Val,Asp235Val,分别命名为 DehDIV - SS,DehDIV - VS,DehDIV-SV和 DehDIV-VV。在同样的入口值(Threshold)和膨胀值(Bloat)下,选择最佳的反应口袋,并以此与R-2-氯丙酸对接,选择最佳的对接构象,打分结果如表2所示。上述4个进化酶与R-2-CPA的分子对接(图4)。由图4可和表2可知:活化能比原始酶降低了6.2282、5.7266、5.6848和5.0578 kJ/mol。因此,预测上述4个进化酶的酶比活力也会获得大幅提高。
易错PCR是在采用DNA聚合酶进行目的基因扩增时,通过调整反应条件来改变扩增过程中的突变频率,从而以一定的频率向目的基因中随机引入突变,获得随机突变体[12]。此方法在许多酶的改造上取得了不少的成果[13-14]。而它最关键在于对何时突变频率的选择,突变频率太低则会导致文库中野生型群体过多;突变频率太高则导致绝大多数突变为有害突变,无法筛到有益突变。
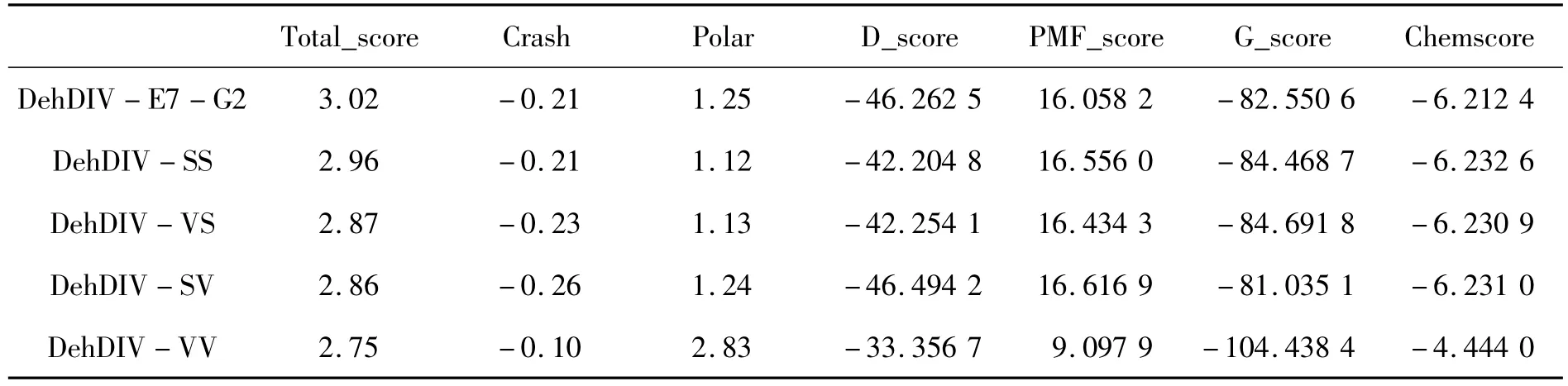
表2 不同突变子的分子对接打分Table 2 Molecular docking marking of different mutants
3 结论
通过调节易错PCR体系中Mn2+浓度,调整突变率,使氨基酸突变维持在1~3个的最佳范围内。基于溶液 Cl-增加,并通过与 Hg(SCN)2和Fe(NH4)SO4反应会发生颜色变化的高通量筛选方法,快速、有效地用于对水解R-2-CPA具有明显活力提高的酶突变体的初筛。使用此方法筛选得到有酶比活变化的突变子库,并有突变子DehDIVG2和DehDIV-E7的比酶活分别提高25.2%和38.7%,突变后E7比酶活为14.47 U/mg。并通过SYBYL对酶与底物进行分子对接,对接打分显示,DehDIV-G2的活化能下降 0.9614 kJ/mol,DehDIV-E7的活化能下降2.5498 kJ/mol。由于酶和底物R-2-氯丙酸的活化能下降,亲和能力提高,从而提高酶比活力。后续研究通过实验得到上述模拟的进化酶,测定其具体活力,并结合计算机辅助模拟软件获得酶学性质更优的突变子。
[1]Ager D J.Handbook of chiral chemicals[M].New York:Marcel Dekker Inc,1999.
[2]项炯华,吴坚平,王能强,等.2-氯丙酸脱卤酶产酶菌种的筛选及酶学性质研究[J].中国生物学文摘,2005,21(6):537-541.
[3]林春娇.C2/C3卤代酸脱卤酶的筛选及克隆表达[D].杭州:浙江大学,2011.
[4]Chen K,Arnold F H.Tuning the activity of an enzyme for unusual environments:sequential random mutagenesis of subtilisin E for catalysis in dimethylformamide[J].PNAS,1993,90:5618-5622.
[5]Tracewell C A,Arnold F H.Directed enzyme evolution:climbing fitness peaks one amino acid at a time[J].Curr Opin Chem Biol,2009,13:3-9.
[6]Hiroki K,Kentaro M,Akira A.Directed evolution of the Actinomycete cytochrome P450 MoxA(CYP105)for enhanced activity[J].Biosci Biotechnol Biochem,2009,73(9):1922-1927.
[7]Reetz M T,Torre C,EipperA,etal.Enhancing the enantioselectivity of an epoxide hydrolase by directed evolution[J].Org Lett,2004,6(2):177-180.
[8]萨姆布鲁克·J,拉塞尔·D W.分子克隆实验指南[M].3版.黄培堂,译.北京:科学出版社,2005.
[9]Kourist R,Hohne M,Bornscheuer U T.Directed evolution and rationales design[J].Chem Unserer Zeit,2009,43:132-142.
[10]郭尧君.蛋白质电泳实验技术[M].北京:科学出版社,1999.
[11]Yang A G,Mao J F,Yao L B.Biochemistry and molecular biology protocol[M].Beijing:High Education Press,2011.
[12]Caldwell R C,Joyee G F.Randomization of genes by PCR mutagenesis[J].PCR Methods Appl,1992,2(1):28-33.
[13]You L,Arnold F H.Directed evolution of subtilisin E in Bacillus subtilis to enhance total activity in aqueous dimethylformamide[J].Protein Eng,1996,9(1):77-83.
[14]Giver L,Gershenson A,Freskgard P O,et al.Directed evolution of a thermostable esterase[J].PNAS,1998,95(22):12809-12813.

