RAD001通过诱导自噬提高人子宫内膜癌细胞对紫杉醇的敏感性*
王 焕, 李小毛, 刘穗玲, 李 田, 丁 杰
(中山大学附属第三医院妇产科,广东 广州 510630)
RAD001通过诱导自噬提高人子宫内膜癌细胞对紫杉醇的敏感性*
王 焕, 李小毛△, 刘穗玲, 李 田, 丁 杰
(中山大学附属第三医院妇产科,广东 广州 510630)
目的探讨哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂RAD001通过诱导细胞自噬增强紫杉醇杀伤子宫内膜癌细胞作用的机制。方法用MTT法检测RAD001对人子宫内膜癌Ishikawa和HEC-1A细胞的生长抑制作用,用激光共聚焦显微镜观察GFP-LC3蛋白的聚集;用流式细胞术检测细胞死亡;用Western blotting方法检测LC3-I、LC3-II、mTOR及ULK1蛋白的表达;用靶向ULK1的siRNA特异性地抑制Ishikawa细胞中ULK1的表达,再检测相关指标。结果RAD001可抑制Ishikawa和HEC-1A细胞的增殖,提高它们对紫杉醇的敏感性。RAD001诱导Ishikawa和HEC-1A细胞发生自噬及自噬性细胞死亡。RAD001通过抑制mTOR/p70S6K通路、上调ULK1诱导自噬,从而产生紫杉醇增敏作用。结论RAD001可以通过抑制mTOR信号通路,上调ULK1的表达,诱导自噬性细胞死亡的发生,从而提高子宫内膜癌细胞对紫杉醇的敏感性。
RAD001; Ishikawa细胞; HEC-1A细胞; 自噬; 紫杉醇
近年来,子宫内膜癌的发病率不断上升,在西方国家已经占据女性生殖系统肿瘤发病率第1位[1]。 尽管早期的子宫内膜癌能够被放疗或手术等方法治愈,但进展期及转移性子宫内膜癌的治疗仍存在较大困难。因此,寻找新的有效的治疗方案成为子宫内膜癌的研究热点。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是PI3K/Akt 通路的下游分子,以mTOR 为靶点可抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡和逆转肿瘤细胞对细胞毒药物的耐药性。细胞自噬(autophagy)是细胞在能量缺乏、饥饿等代谢压力下的一种生理过程[2],自噬与肿瘤发生发展密切相关。自噬一方面可以促进肿瘤细胞生存,另一方面,细胞自噬能抑制肿瘤发生[3]。自噬对肿瘤的作用依赖于肿瘤类型和不同的刺激处理,具体的机制尚未完全清楚。目前,mTOR与自噬关系的研究已取得较大进展。研究表明,通过抑制mTOR表达调控自噬对肿瘤治疗可能有重要的意义[4-6]。
RAD001(everolimus)即40-O-(2-羟乙基)-雷帕霉素, 是一种新型的口服mTOR抑制剂。临床前研究表明,对于一些耐药细胞株,RAD001 与细胞毒药物或其它靶点药物联用有抑制肿瘤细胞生长和促使其死亡的作用[7]。在PTEN基因缺失的前列腺癌细胞中,RAD001 可以诱导肿瘤细胞自噬和增强细胞对放疗的敏感性[8]。RAD001 与细胞毒药物联用的一系列临床试验初步结果均提示RAD001 与化疗药联用有相加或协同作用,且毒副反应并未明显增加[9-10]。因此,本研究对RAD001促进人子宫内膜癌细胞自噬及Akt/mTOR通路在其中的作用机制进行了探讨,旨在探索通过抑制 mTOR诱发自噬从而增敏化疗、逆转紫杉醇耐药的可行性,希望为化疗耐药的患者寻找新的希望。
材 料 和 方 法
1材料
人子宫内膜癌细胞株Ishikawa及HEC-1A购自中国科学院上海细胞生物研究所。细胞在含10% FBS、5×104U/L青霉素、50 mg/L链霉素和2 mmol/L谷氨酰胺的DMEM培养液中37 ℃、5% CO2培养。所有实验均在细胞处于对数生长期时进行。
RAD001 (07741)、氯喹(chloroquine,CQ)及MTT购于Sigma-Aldrich;RAD001 用DMSO 配制成1 mmol/L贮备液。mTOR、p-mTOR、p70S6K和p-p70S6K抗体购自Cell Singnaling;LC3和ULK1抗体购自Novus Biological;辣根过氧化物酶标记的Ⅱ抗购自Santa Cruz; GAPDH 购自上海康成技术有限公司。
2方法
2.1MTT法 取对数生长期的细胞加入96孔板中,每孔7 000~8 000个细胞(195 μL/well)。加入药物,每组设4个平行孔,置37 ℃培养72 h,实验中止前4 h加入10 μL MTT液(5 g/L),再培养4 h,弃去培养液,加入0.1 mL DMSO,待结晶溶解后在酶联检测仪上检测570 nm波长下每孔的A值。按下列公式求出生长抑制率:生长抑制率(%)=(1-用药组平均A值/对照组平均A值)×100%。用BLISS软件计算出半数抑制率IC50。
2.2激光共聚焦显微镜观察GFP-LC3 以1.5×108/L的密度,应用无抗体的10%胎牛血清RPMI-1640培养液接种细胞于6孔板中培养,贴壁后以脂质体LipofectamineTM2000转染GFP-LC3质粒,G418筛选稳定表达GFP-LC3的细胞,加药处理24 h后,倒去培养液,用PBS洗涤3次,激光共聚焦荧光显微镜下观察、拍照。GFP-LC3质粒购自北京西美杰科技有限公司。
2.3Western blotting检测 取处于对数生长期的细胞,稀释成2×108/L,接种于6孔板,每孔2 mL,药物处理细胞后,收集细胞,PBS洗涤3次,加入细胞裂解液100 μL,14 000 r/min离心10 min,定量蛋白,取40 μg蛋白,加入上样缓冲液,95 ℃下变性10 min。聚丙烯酰胺SDS凝胶电泳后,电转移至PVDF膜上,5%脱脂牛奶封闭后依次加入Ⅰ抗、Ⅱ抗,在室温下孵育2 h,TBST缓冲液(10 mmol/L Tris-HCl, pH 7.4,150 mmol/L NaCl,0.1% Tween-20)洗涤3次,每次10 min,加入化学发光剂,放入暗盒中并压片,2~5 min后显影、定影。
2.4流式细胞术 (flow cytometry,FCM) 检测细胞死亡 收集用药物处理过的细胞,PBS洗涤2次,离心。加入PBS调整细胞密度为1×109/L。取1 mL细胞悬液,加入10 μL 碘化丙啶(propidium iodide,PI; 10 mg/L)染色10 min,避光。立即将标本置于冰块中,1 h 内用流式细胞仪(Becton Dickinson)检测。
2.5siRNA干扰实验 设计靶向ULK1的siRNA序列为5’-GCCCTTTGCGTTATATTGTAT-3’和5’-CCTGGTTATGGAGTACTGCAA-3’。转染前24 h消化和计数肿瘤细胞,在6孔板中接种细胞,待细胞达到50%~60% 融合时进行转染。将5 μL siRNA稀释于100 μL无血清的基础培养基opti-MEM中,室温放置5 min;取2 μL LipofectamineTM2000 稀释于100 μL无血清的基础培养基opti-MEM中,室温放置5 min;将稀释的siRNA溶液加入脂质体溶液中,轻柔混匀,室温放置20 min;吸弃细胞培养物中的完全培养基,用基础培养基opti-MEM漂洗细胞2次,加入无血清基础培养基opti-MEM 0.8 mL;将siRNA-脂质体复合物加入细胞中,前后轻晃6孔板使混合液分散均匀。4~6 h 后吸弃转染复合物,换入含10%胎牛血清的新鲜培养基。转染后24 h 进行后续实验。
3统计学处理
采用SPSS 16.0 软件分析,计量资料采用均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析(One-way ANOVA)或t检验,以P<0.05 为差异有统计学意义。
结 果
1RAD001可抑制人子宫内膜癌Ishikawa细胞及HEC-1A细胞的增殖
以2.5、5、10、20、40和80 nmol/L RAD001处理Ishikawa细胞和HEC-1A细胞72 h,出现明显的增殖抑制作用,且呈浓度依赖性,其IC50分别为(36.80±1.64) nmol/L和(25.72±1.16) nmol/L,见图1。上述结果说明RAD001能抑制Ishikawa细胞和HEC-1A细胞的增殖。
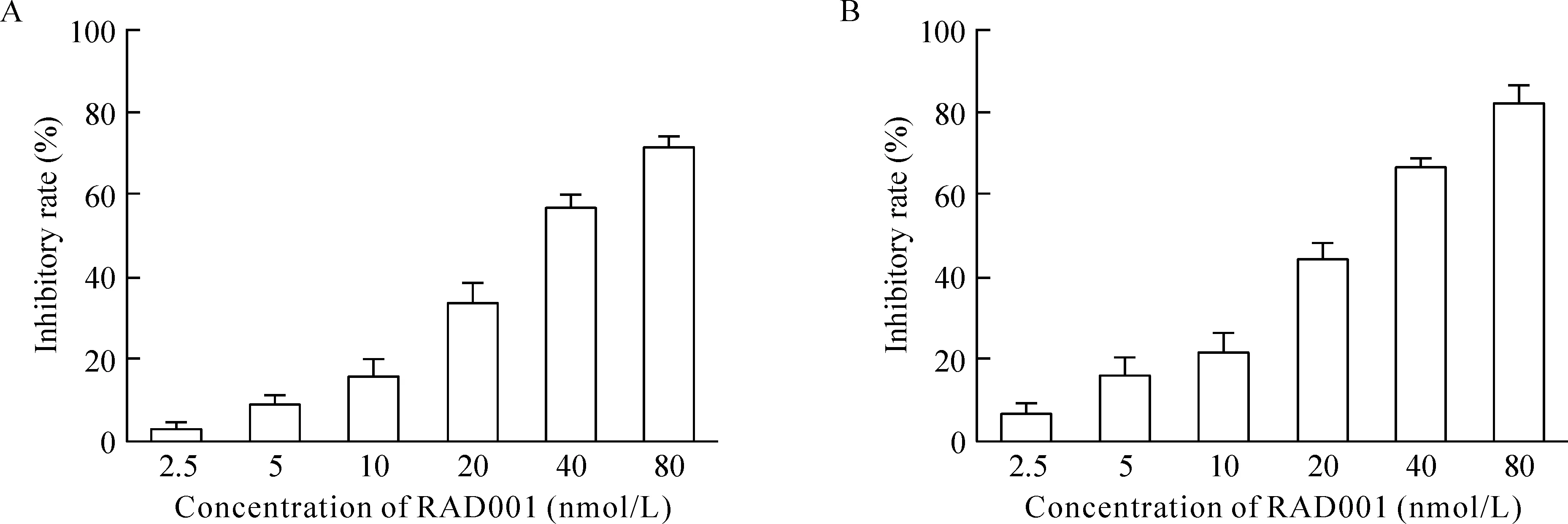
Figure 1. RAD001 suppressed the proliferation of Ishikawa cells (A) and HEC-1A cells (B). The cells were cultured in a 96-well plate (6 000 cells/well), exposed to the indicated concentrations of RAD001 and incubated for 72 h.mean±SD.n=3.
图1RAD001抑制Ishikawa细胞和HEC-1A细胞的增殖
2RAD001提高人子宫内膜癌Ishikawa细胞及HEC-1A细胞对紫杉醇的敏感性
RAD001联合不同浓度的紫杉醇作用于人子宫内膜癌Ishikawa细胞及HEC-1A细胞后,细胞生长受到明显抑制,其抑制率随药物浓度增加逐渐升高,见图2。在Ishikawa细胞中,单药紫杉醇的 IC50为(3.91±0.17)μmol/L,两药联用指数为 0.326。在HEC-1A细胞中,单药紫杉醇的IC50为(6.72±1.14) μmol/L,两药联用指数为0.805。两种细胞株中药物联用指数均小于1,说明两药联合应用对人子宫内膜癌Ishikawa细胞及HEC-1A细胞的生长抑制具有协同作用。

Figure 2. Cell inhibitory rate of taxol and RAD001 alone or together at the indicated concentrations for 72 h. Cells were cultured in a 96-well plate (6 000 cells/well), exposed to the indicated concentrations of taxol and RAD001 (30 nmol/L) for 72 h. The growth inhibition was detected using MTT assay, and the combination index (CI) was determined using CalcuSyn software.Mean±SD.n=3.*P<0.05vstaxol.
图2RAD001和紫杉醇联用对Ishikawa细胞及HEC-1A细胞的生长抑制具有协同作用
3RAD001诱导人子宫内膜癌Ishikawa及HEC-1A细胞发生自噬
LC3作为自噬体膜标志性蛋白,定位在自噬体内外膜上。由图 3A 中可以看出,RAD001 处理可使瞬时转染 GFP-LC3 质粒的 Ishikawa 及 HEC-1A 细胞胞浆中出现大量绿色荧光点状聚集,提示自噬体的形成。Western blotting检测的结果显示,不同浓度的 RAD001 处理上述细胞 24 h 后,LC3-I 逐渐向LC3-Ⅱ转化,并呈现明显的浓度依赖效应,见图3B。这些结果说明 RAD001 可以诱导 Ishikawa 细胞及 HEC-1A 细胞发生自噬。

Figure 3. RAD001 induced autophagy in Ishikawa cells and HEC-1A cells. A: the cells treated with RAD001 (30 nmol/L) for 24 h, the dots of GFP-LC3 accumulation were observed under confocal microscope; B: the cells were treated with RAD001 at the indicated concentrations for 24 h, and Western blotting was used for detecting LC3-I and LC3-II.
图3RAD001诱导Ishikawa细胞及HEC-1A细胞发生自噬
4RAD001诱导Ishikawa细胞和HEC-1A细胞发生自噬性细胞死亡
由图4A中可以看出,当联用CQ处理细胞后,LC3-II及p62的聚集较分别RAD001单用时明显增多,表明CQ能够有效地阻断自噬,引起自噬溶酶体内蛋白质的不断堆积。MTT的结果显示,自噬的抑制使RAD001对Ishikawa细胞和HEC-1A细胞的抑制明显下调,见图4B。这提示RAD001诱导人子宫内膜癌Ishikawa细胞和HEC-1A细胞发生自噬性细胞死亡。
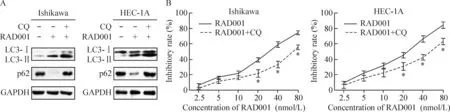
Figure 4. Treatment with RAD001 induced autophagic cell death in Ishkawa cells and HEC-1A cells. A: lysates from Ishikawa cells or HEC-1A cells were treated with RAD001 (30 nmol/L) and CQ (10 mg/mL) alone or together, and Western blotting was used to detect the expression of LC3-II and p62; B: the cells were incubated with the indicated concentrations of RAD001 or in combination with 10 mg/mL CQ for 24 h,and the inhibitory rate was detected by MTT assay.Mean±SD.n=3.*P<0.05vsRAD001.
图4RAD001诱导Ishikawa细胞和HEC-1A细胞发生自噬性细胞死亡
5RAD001抑制mTOR/p70S6K通路
RAD001能显著抑制Ishikawa细胞及HEC-1A细胞中mTOR的磷酸化水平,并随药物浓度的增加抑制作用越明显,且mTOR的总量并无改变,见图5。进一步观察到mTOR下游重要底物p70S6K的磷酸化水平被明显抑制,而其总量并无改变,见图5。这些结果提示RAD001作用于肿瘤细胞Ishikawa及HEC-1A后,可以显著抑制其mTOR途径。
6RAD001上调自噬相关蛋白ULK1的表达
ULK1是参与自噬的重要蛋白,在自噬体形成早期发挥重要的作用。Western blotting检测结果显示,RAD001能显著上调Ishikawa细胞及HEC-1A细胞中ULK1蛋白的表达水平,并呈显著的浓度依赖性,见图6。
7RAD001通过上调ULK1诱导自噬而产生紫杉醇增敏效应
图7A显示,siRNA干扰使ULK1的表达下降70%以上。由图7B中可以看出,ULK1的表达下调后,RAD001诱导的LC3-I向LC3-II的转化被显著地抑制。RAD001分别处理Ishikawa/control和Ishikawa/siULK1细胞,PI染色结果发现,抑制ULK1表达有效阻断了RAD001诱导的自噬性细胞死亡,见图7C。RAD001联合紫杉醇处理可以明显增加细胞死亡,ULK1表达抑制有效阻断了这一增敏作用,见图7D。上述结果提示RAD001通过上调ULK1诱导自噬,增强紫杉醇的抗肿瘤效应。
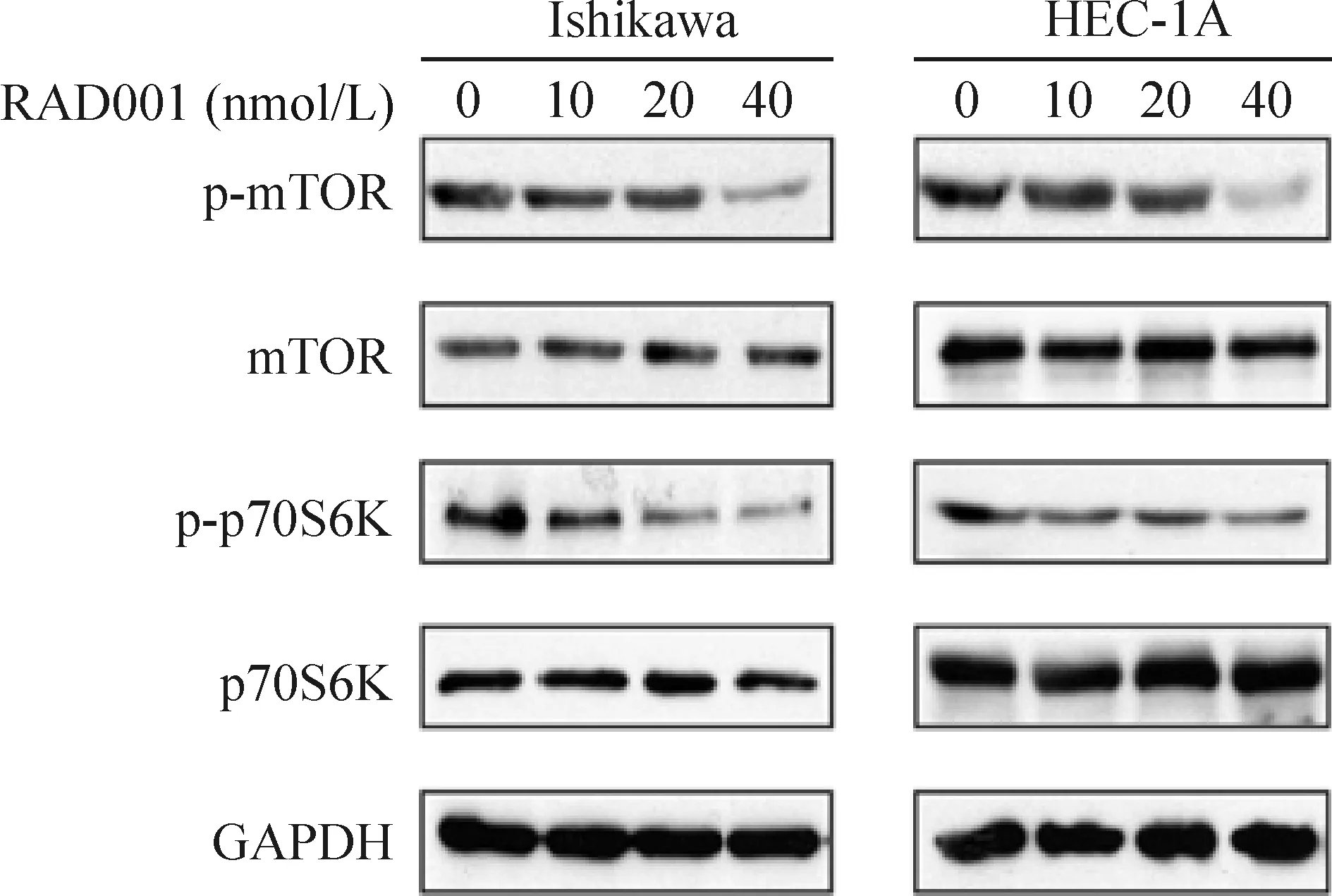
Figure 5. The effect of RAD001 on mTOR pathway in Ishikawa cells and HEC-1A cells. The cells were treated with RAD001 at the indicated concentrations for 24 h. The cell lysates were analyzed by Western blotting.
图5RAD001显著抑制Ishikawa细胞及HEC-1A细胞的mTOR通路
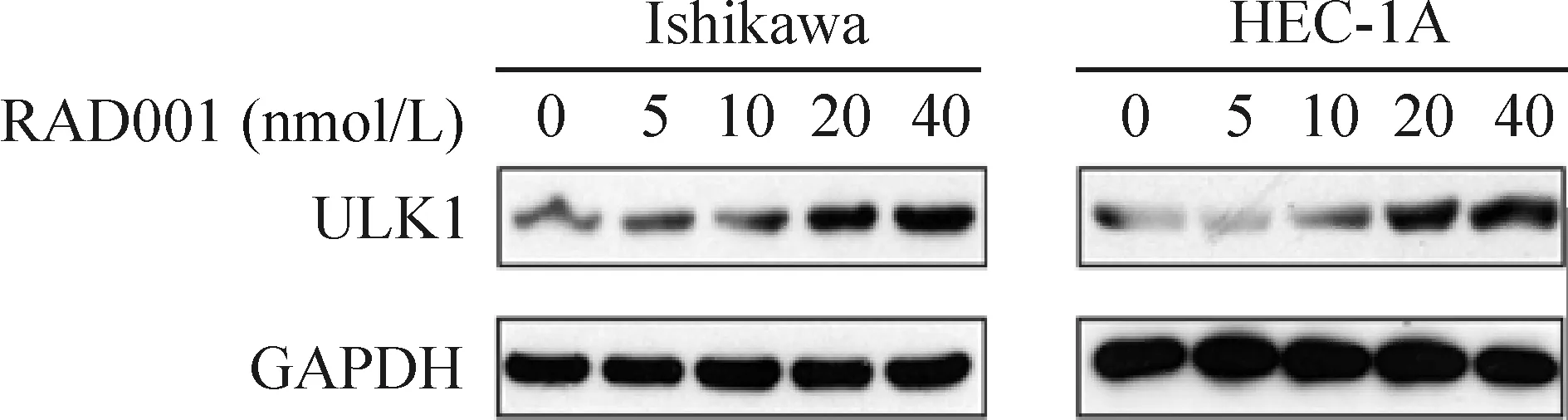
Figure 6. The effect of RAD001 on ULK1 expression in Ishikawa cells and HEC-1A cells. The cells were treated with the indicated concentrations of RAD001 for 24 h, and the expression of ULK1 was examined by Western blotting.
图6RAD001显著上调Ishikawa细胞及HEC-1A细胞中ULK1蛋白的表达水平
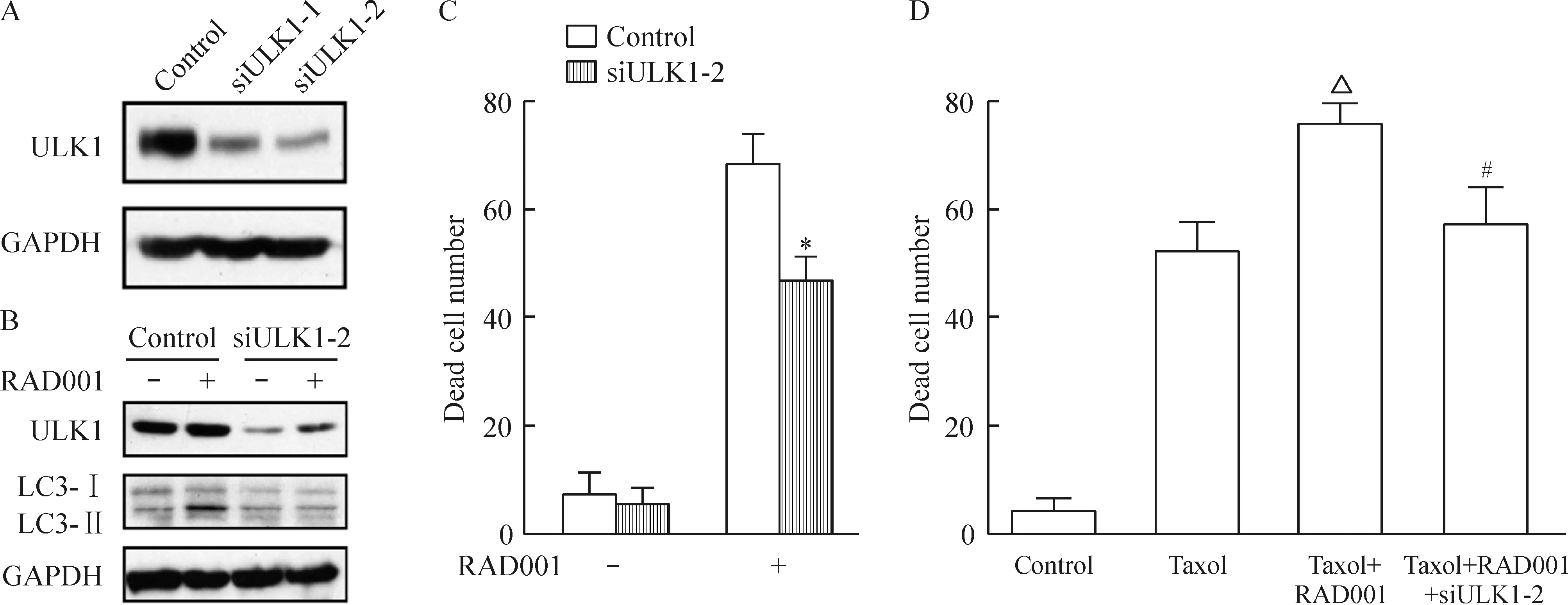
Figure 7. Silencing ofULK1 blocked RAD001-mediated autophagy and cell death. A: Ishikawa cells were transfected withULK1 siRNA-1 and -2, and the ULK1 protein expression was determined by Western blotting; B: Ishikawa cells were treated with RAD001 (30 nmol/L) in the absence or presence ofULK1 siRNA, and then LC3 protein expression was analyzed; C and D: Ishikawa/control cells and Ishikawa/siULK1 cells were exposed to RAD001 (30 nmol/L) or taxol (4 μmol/L) for 24 h, and the number of dead cells was quantified using PI staining and flow cytometry.Mean±SD.n=3.*P<0.05vscontrol;△P<0.05vstaxol;#P<0.05vstaxol+RAD001.
图7RAD001通过上调ULK1诱导自噬而产生紫杉醇增敏作用
讨 论
子宫内膜癌目前是妇科三大恶性肿瘤之一,发病率逐年上升,已占到女性生殖系统恶性肿瘤的20%~30%。部分国家已经超过宫颈癌,成为最常见的女性生殖道恶性肿瘤[1]。
mTOR是PI3K/Akt 通路的下游分子,以mTOR 为靶点可抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡和逆转肿瘤细胞对细胞毒药物的耐药性。目前,以mTOR为治疗靶点已成为肿瘤治疗的研究新热点,mTOR抑制剂RAD001正是其中的代表之一,它作为一种有潜力的肿瘤治疗剂已经引起国内外学者的广泛关注。
紫杉醇是当前子宫内膜癌联合化疗中最常用的药物之一,但其药理作用的发挥往往需要很高剂量,从而导致患者较为严重的不良反应。在本研究中,作者利用RAD001 联合紫杉醇处理人子宫内膜癌Ishikawa及HEC-1A细胞,结果显示RAD001可提高人子宫内膜癌Ishikawa及HEC-1A细胞对紫杉醇的敏感性,从而提示RAD001 与紫杉醇联合应用不但可以增强紫杉醇的药理作用,而且可以减少其剂量,从而达到增效减毒的作用。另外RAD001 具有只针对肿瘤细胞、不攻击正常细胞、对正常机体不良反应小的优点[11]。因此,RAD001 可以作为一种较理想的协同化疗药物,具有广泛的临床应用前景。
自噬是一个保守的代谢过程,在饥饿、缺氧、高热及药物诱导的情况下发生,能够降解长周期蛋白、细胞器和胞质。mTOR作为一种丝氨酸/苏氨酸激酶,在细胞自噬信号转导中处于核心地位。作为mTOR的抑制剂,我们的研究证实RAD001可以诱导Ishikawa及HEC-1A细胞发生自噬。自噬是维持细胞内稳态的重要途径,然而,自噬也被称为II型程序性细胞死亡。因此,我们在研究抗肿瘤药物诱导的自噬时,更需谨慎判断自噬的作用。本研究中,我们进一步应用自噬抑制剂CQ阻断自噬的发生,结果表明自噬被有效地抑制后,死亡的细胞减少,细胞存活率增高。上述结果证明RAD001诱导的是自噬性细胞死亡。
已有研究证实,在饥饿或雷帕霉素作用条件下,mTOR活性被抑制,Atg13去磷酸化,与Atg1亲和力增加,并与Atg17-29-31紧密结合,形成Atg1复合体,在Atg13和Atg17共同作用下,Atg1激活,定位于前自噬体结构(pre-autophagosomal structure,PAS),从而启动自噬的发生[12-13]。因此mTOR是自噬的负调控分子,并发挥自噬启动“门卫”的作用。在本研究中,我们证实RAD001能显著抑制Ishikawa细胞及HEC-1A细胞中mTOR的磷酸化水平,进而抑制其下游重要底物p70S6K的激活。我们的研究进一步证实RAD001能上调ULK1的表达,抑制ULK1表达有效阻断了RAD001诱导的自噬性细胞死亡。
综上所述,在人子宫内膜癌Ishikawa细胞及HEC-1A细胞中,RAD001可以通过抑制mTOR信号通路,上调ULK1的表达,诱导自噬性细胞死亡的发生,从而提高肿瘤细胞对紫杉醇的敏感性。本实验表明RAD001在子宫内膜癌的治疗方面有望成为一种新型的化疗增敏剂,进一步丰富了子宫内膜癌的治疗模式。
[1] Jemal A, Siegel R, Xu J, et al. Cancer statistics, 2010[J]. CA Cancer J Clin, 2010, 60(5):277-300.
[2] Boya P, Gonzalez-Polo RA, Casares N, et al. Inhibition of macroautophagy triggers apoptosis[J]. Mol Cell Biol, 2005, 25(3):1025-1040.
[3] 胡鹏飞,赖东武,何 红. 自噬在晚期糖基化终产物诱导的内皮细胞凋亡中的作用[J]. 中国病理生理杂志,2012, 28(6):1006-1011.
[4] Ganley IG, Lam DH, Wang J, et al. ULK1·ATG13·FIP200 complex mediates mTOR signaling and is essential for autophagy[J]. J Biol Chem, 2009, 284(18): 12297-12305.
[5] Guertin DA, Sabatini DM. Defining the role of mTOR in cancer[J]. Cancer Cell,2007, 12(1): 9-22.
[6] Hippert MM, O’Toole PS, Thorburn A. Autophagy in cancer: good, bad or both? [J]. Cancer Res, 2006, 66(19): 9349-9351.
[7] Dengler J, von Bulonoff N, Decker T, et al. Combination of imatinib with rapamycin or RAD001 acts synergistically only in Bcr-Abl-positive cells with moderate resistance to imatinib[J]. Leukemia, 2005, 19(10):1835-1838.
[8] Cao C, Subhawong T, Albert JM, et al. Inhibition of mammalian target of rapamycin or apoptotic pathway induces autophagy and radiosensitizes PTEN null prostate cancer cells[J]. Cancer Res, 2006, 66(20):10040-10047.
[9] Haritunians T, Mori A, O’Kelly J, et al. Antiproliferative activity of RAD001 (everolimus) as a single agent and combined with other agents in mantle cell lymphoma[J]. Leukemia, 2007, 21(2):333-339.
[10] Panner A, Parsa AT, Pieper RO. Use of APO2L/TRAIL with mTOR inhibitors in the treatment of glioblastoma multiforme [J]. Expert Rev Anticancer Ther, 2006, 6(9):1313-1322.
[11] 陈 樑,张红峰.mTOR 信号通路与癌症治疗[J].生命的化学, 2005,25(2):127-129.
[12] Park HJ, Lee SJ, Kim SH, et al. IL-10 inhibits the starvation induced autophagy in macrophages via class I phosphatidylinositol 3-kinase (PI3K) pathway[J]. Mol Immunol, 2011, 48(4):720-727.
[13] Alonso S, Pethe K, Russell DG, et al. Lysosomal killing of mycobacterium mediated by ubiquitin-derived peptides is enhanced by autophagy[J]. Proc Natl Acad Sci U S A, 2007, 104(14): 6031-6036.
RAD001promoteschemotherapeuticsensitivityofhumanendometrialcarcinomacellstopaclitaxelviainducingautophagy
WANG Huan, LI Xiao-mao, LIU Sui-ling, LI Tian, DING Jie
(DepartmentofObstetricsandGynecology,theThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China.E-mail:tigerlee777@163.com)
AIM: To explore the effect of mammalian target of rapamycin (mTOR) inhibitor RAD001 on chemotherapeutic sensitivity of endometrial carcinoma cells to paclitaxel.METHODSMTT assay and PI staining were used to assess the cell death. The protein expression of LC3-I, LC3-II, mTOR and ULK1 was detected by Western blotting.ULK1 siRNA was used to abolish the activation of ULK1.RESULTSRAD001 significantly inhibited the growth of human endometrial carcinoma cell lines Ishikawa and HEC-1A. RAD001 enhanced the inhibitory effect of paclitaxel on the growth of Ishikawa cells and HEC-1A cells. RAD001 induced autophagy and autophagic cell death by the inhibition of mTOR/p70S6K pathway and up-regulation of ULK1 expression.CONCLUSIONRAD001 enhances the inhibitory effect of paclitaxel on endometrial carcinoma cell growth by inducing autophagy and autophagic cell death.
RAD001; Ishikawa cells; HEC-1A cells; Autophagy; Paclitaxel
R737.31
A
10.3969/j.issn.1000- 4718.2013.11.009
1000- 4718(2013)11- 1966- 06
2013- 08- 20
2013- 11- 04
广州市科技计划资助项目(No. 2012KP072)
△通讯作者 Tel: 020-85253040; E-mail: tigerlee777@163.com

