STK15过表达对人食管癌细胞株KYSE150生长的影响*
王晓霞, 李晓钟, 路 娜, 赵 艳, 王 康, 裴 毅
(1山西医科大学生物化学与分子生物学教研室, 山西 太原 030001; 2山西省人民医院急诊科,山西 太原 030012; 3山西医学科学院,山西大医院老年肿瘤科, 山西 太原 030032)
STK15过表达对人食管癌细胞株KYSE150生长的影响*
王晓霞1△, 李晓钟2, 路 娜1, 赵 艳1, 王 康1, 裴 毅3
(1山西医科大学生物化学与分子生物学教研室, 山西 太原 030001;2山西省人民医院急诊科,山西 太原 030012;3山西医学科学院,山西大医院老年肿瘤科, 山西 太原 030032)
目的探讨丝氨酸/苏氨酸激酶15 (serine/threonine kinase 15,STK15)过表达对人食管癌细胞株KYSE150生长的影响。方法采用脂质体法将pEGFP-C1-STK15真核表达载体转染人食管鳞癌细胞株KYSE150,构建STK15过表达的稳定细胞系(GFP-STK15),通过荧光显微镜和Western blotting检测STK15的表达。采用四甲基偶氮唑蓝(MTT)法观察STK15过表达对体外肿瘤细胞生长的影响。通过流式细胞术分析STK15过表达对细胞周期和凋亡的影响。采用裸鼠致瘤实验观察STK15过表达对体内肿瘤细胞生长的影响。结果pEGFP-C1-STK15质粒转染细胞后筛选得到稳定克隆,荧光显微镜显示GFP-STK15融合蛋白定位于细胞的中心体以及纺锤体,Western blotting可检测到GFP-STK15 融合蛋白的表达。与对照细胞相比,GFP-STK15细胞系的体外生长能力明显增加;G0/G1期细胞百分率降低,细胞凋亡率减少;GFP-STK15细胞系接种组裸鼠肿瘤明显增大,差异均具有统计学意义(P<0.01)。结论STK15过表达能促进人食管癌KYSE150细胞的生长,提示STK15将可能成为治疗食管癌的新靶点。
丝氨酸/苏氨酸激酶15; 食管肿瘤; 细胞增殖
丝氨酸/苏氨酸激酶15 (serine/threonine kinase 15),又名BTAK (breast tumor-amplified kinase)、Aurora-A、Aurora-2或AIK (Aurora/Ipl1 kinase)[1]。STK15在高等真核生物细胞分裂的过程中具有重要的作用,包括调节细胞周期G2/M转变、中心体的分离与成熟、纺锤体的装配以及胞质分裂等[2]。研究发现,STK15在许多肿瘤包括食管癌中存在过表达[3-11]。为了进一步探讨STK15在食管癌发生发展中的作用,我们将pEGFP-C1-STK15真核表达载体转染人食管鳞癌细胞,建立STK15过表达的稳定细胞系,以研究其对体内外肿瘤细胞生长的影响,从而为肿瘤的治疗寻求新的特异靶点。
材 料 和 方 法
1材料
人食管鳞癌KYSE150细胞购自中国医学科学院肿瘤细胞库;pEGFP-C1 载体由本室保存;DH5α菌株由本室保存。限制性内切酶、DNA marker、T4 DNA 连接酶和逆转录酶及引物购自TaKaRa;质粒提取试剂盒购自Qiagen;RPMI-1640培养基、小牛血清购自HyClone;脂质体转染试剂LipofectamineTM2000 购自Invitrogen;STK15抗体购自Cell Signal;β-actin抗体购自Santa Cruz;裸鼠购自北京维通利华实验动物有限公司。
2方法
2.1STK15 基因真核表达载体的构建及鉴定 用Trizol试剂抽提正常食管组织总RNA,以其为模板,逆转录成cDNA, 再以cDNA为模板扩增STK15基因。上游引物序列加入XhoⅠ酶切位点: 5’-GCCTCGAGGCATGGACCGATC-3’; 下游引物序列加入BamHⅠ酶切位点: 5’-CGGGATCCCTAAGACTGTTTG-3’。反应条件:94 ℃预变性5 min 后94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,末次循环后72 ℃ 10 min。STK15基因的cDNA 扩增产物及pEGFP-C1载体均用XhoⅠ和BamHⅠ双酶切,酶切产物经琼脂糖凝胶电泳后切胶纯化。基因片段及载体由T4 DNA 连接酶连接后转化DH5α细菌,挑取单克隆菌落进行扩大培养后提取质粒进行测序鉴定。同时经XhoⅠ单酶切以及XhoⅠ和BamHⅠ双酶切后,用1%琼脂糖电泳鉴定。
2.2细胞培养及稳定转染 KYSE150细胞培养于含10%胎牛血清的RPMI-1640培养液中,置37 ℃、5%CO2的培养箱中培养。细胞达70%融合时,按LipofectamineTM2000说明书将pEGFP-C1-STK15重组质粒及空载体pEGFP-C1分别转染入细胞内。48 h后加入G418筛选,14 d后获得STK15稳定表达克隆及对照克隆,并扩大培养,采用荧光显微镜和Western blotting鉴定。
2.3Western blotting检测 肿瘤细胞或裸鼠肿瘤组织用PBS漂洗2遍, 加入细胞裂解液,置于冰上40 min,12 000 r/min离心20 min后, 收集上清即为细胞提取蛋白。经10% SDS-PAGE电泳分离后,电转移至硝酸纤维素膜,以STK15(1∶1 000稀释)为Ⅰ抗,HRP标记的羊抗兔IgG为Ⅱ抗,经孵育洗膜后ECL曝光显影,检测细胞内蛋白的表达水平,以β-actin为内参照。图像分析系统测定灰度值。
2.4MTT法测定细胞生长曲线 将对数生长期的细胞用胰酶消化后制成细胞悬液,接种在96孔培养板中,每孔接种3 000个细胞,设8个平行孔。分别在1、3、5、7和9 d以MTT法检测其吸光度(A)。检测前弃去上清,每孔加入100 μL含0.2 g/L MTT的无血清培养基,在37℃培养4 h后弃去上清,并加入150 μL DMSO,混匀后,在酶标仪上用波长为570 nm测定A值,并绘制生长曲线。
2.5流式细胞术分析 胰酶消化并收集细胞,预冷的70%乙醇4 ℃固定过夜。加入RNase A(1 g/L),37 ℃水浴30 min,再加入PI染色液(50 mg/L),至4 ℃避光30 min,用流式细胞仪检测细胞周期和凋亡率。以G2/M期和S期细胞百分比之和代表细胞的增殖能力。
2.6裸鼠致瘤实验 裸鼠12只,随机分为2组,每组各6只。分别取1×106个细胞悬浮于0. 2 mL PBS 中,在无菌条件下接种裸鼠(BALB/cnu/nu)左侧前肢皮下,3个月后处死动物剥取瘤体,测量肿瘤体积并拍照。
2.7逆转录聚合酶链反应(RT-PCR) 参照Trizol 说明书提取裸鼠肿瘤组织总RNA,并逆转录成cDNA,再以cDNA 为模板,PCR 扩增STK15基因,上游引物5′-AATGATTGAAGGTCGGATGC-3′,下游引物5′-TTCTCTGAGCATTGGCCTCT-3′。以看家基因GAPDH 为内参照,上游引物5′-GCTGAGAACGGGAAGCTTGT-3′,下游引物5′-GCCAGGGGTGCTAAGCAGTT-3′。引物由TaKaRa合成。反应条件为:94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,共30 个循环。图像分析系统测定灰度值。
3统计学处理
应用SPSS 11.5 软件分析,数据以均数±标准差(mean±SD)表示,组间数据的比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1pEGFP-C1-STK15表达载体的构建及鉴定
真核表达载体pEGFP-C1 分子量大小为4.7 kb,在绿色荧光蛋白(green fluorescent protein,GFP)读码框的C 端含有多克隆位点,可供外源基因插入,从而构建得到EGFP-C1-STK15重组质粒。pEGFP-C1和EGFP-C1-STK15载体单酶切后经琼脂糖电泳,可见分子量约为4.7 kb和5.9 kb的片段。重组体双酶切后经琼脂糖电泳,可得到1条约为1.2 kb的目的片段和1条约为4.7 kb 的载体片段,见图1,与预期结果相符,表明STK15基因已插入到pEGFP-C1载体中。测序进一步证实重组质粒中插入的目的基因片段大小、方向和插入位点均正确。
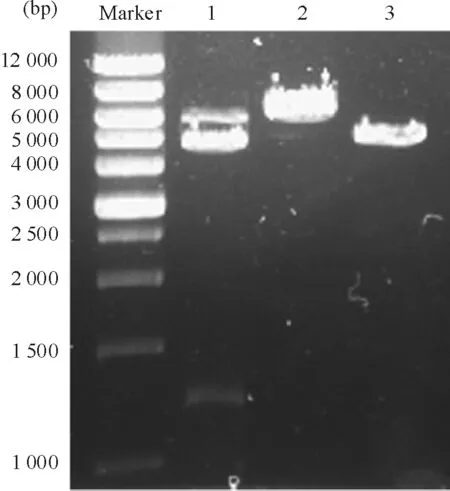
Figure 1. Identification of recombinant pEGFP-C1-STK15 expression vector by enzyme digestion. 1: pEGFP-C1-STK15 digested byXhoⅠ+BamHⅠ; 2: pEGFP-C1-STK15 digested byXhoⅠ;3: pEGFP-C1 digested byXhoⅠ.
图1重组质粒pEGFP-C1-STK15的酶切鉴定
2荧光镜下观察GFP-STK15的表达
pEGFP-C1-STK15载体稳定转染细胞后,荧光镜下可观察到绿色荧光,见图2,GFP标记的STK15蛋白主要定位于细胞的中心体以及纺锤体(GFP-STK15),这与文献报道一致[2],证明STK15载体构建成功并能在细胞中正确表达。pEGFP-C1转染细胞后也可观察到绿色荧光,GFP在胞质及胞核均有表达(control)。
3Westernblotting检测STK15蛋白的表达
pEGFP-C1-STK15质粒转染后筛选出4个稳定克隆(将其命名为GFP-STK15),可以检测到分子量为73 kD的GFP-STK15融合蛋白。而空载体转染后筛选到的5个细胞克隆并未检测到此条带(将其命名为control),仅有1条内源性的STK15蛋白表达条带,见图3。而且,灰度分析显示GFP-STK15细胞系中总STK15表达量均显著高于对照组,差异有统计学意义(P<0.01),证明STK15过表达稳定细胞系构建成功。选取外源性STK15蛋白表达相对比较高的一株细胞克隆以及随机选取一株空载细胞克隆进行后续实验。

Figure 2. The location of GFP-STK15 protein in ESCC KYSE150 cell line detected by fluorescence microscopy.A:GFP-STK15;B:control.
图2荧光镜下观察GFP-STK15在细胞内的表达
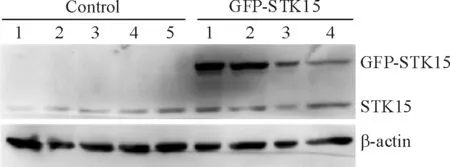
Figure 3. The expression of STK15 protein and GFP-STK15 fusion protein in ESCC KYSE150 cell line detected by Western blotting.
图3Westernblotting鉴定STK15蛋白和GFP-STK15融合蛋白在肿瘤细胞中的表达
4STK15过表达对体外肿瘤细胞生长的影响
如图4所示,GFP-STK15细胞系的生长能力明显高于对照细胞,差异显著(P<0.01)。
5STK15过表达对细胞周期和凋亡的影响
如表1所示,与对照组相比,GFP-STK15细胞系G0/G1期细胞百分率明显降低,细胞增殖率明显增加,细胞凋亡率有所减少,差异均有统计学意义(P<0.01)。
6STK15过表达对裸鼠肿瘤生长的影响
裸鼠接种肿瘤细胞1周后,可观察到皮下肿瘤出现。3个月后处死裸鼠,随机选取每组各1只裸鼠拍照,GFP-STK15细胞系接种组肿瘤明显大于对照组,差异显著(P<0.01),见图5。

Figure 4. Effects of STK15 overexpression on growth of ESCC KYSE150 cell line detected by MTT assay. Mean±SD.n=8.**P<0.01vscontrol.
图4STK15过表达对体外肿瘤细胞生长的影响
表1STK15过表达对细胞周期和凋亡的影响
Table 1. Effects of STK15 overexpression on cell cycle distribution and apoptosis of ESCC KYSE150 cell line detected by flow cytometry (%. Mean±SD.n=3)

GroupG0/G1ProliferationrateApoptoticrateControl44.1±1.555.9±1.62.8±0.3GFP-STK1529.4±1.2**70.6±1.9**1.6±0.2**
**P<0.01vscontrol.
7RT-PCR和Westernblotting检测STK15在裸鼠肿瘤组织中的表达
随机选取3个GFP-STK15细胞系接种组和3个对照组裸鼠肿瘤组织,进行RT-PCR检测,结果显示,GFP-STK15细胞系接种组裸鼠肿瘤组织中STK15 mRNA表达水平明显高于对照组,灰度分析显示2组差异有统计学意义(P<0.01),见图6A。Western blotting检测结果显示在GFP-STK15细胞系接种组裸鼠肿瘤组织中可检测到GFP-STK15融合蛋白的表达,而对照组仅可检测到内源性STK15蛋白的表达,灰度分析显示2组STK15总蛋白的表达差异有统计学意义(P<0.01),见图6B。
讨 论
食管癌的发生和发展是一个涉及多基因、多分子水平变化的非常复杂的过程。研究表明,肿瘤抑癌基因p53、Rb和ras在食管癌中存在点突变;myc、cyclin D1等癌基因在食管癌中均有不同程度的扩增[9, 12]。近年来,一种参与有丝分裂的丝氨酸/苏氨酸激酶——STK15备受关注,这是因为它与许多肿瘤的发生发展密切相关。例如在乳腺癌[3]、肝癌[4]、卵巢癌[5]、鼻咽癌[6]、前列腺癌[7]、肾癌[8]等癌症中均发现有STK15的过表达。另外在食管癌中也存在STK15的过表达,而且STK15的表达水平与食管癌的侵袭潜能和淋巴结转移呈正相关[9-11]。因此,深入研究STK15在食管癌发生发展中的作用,将有助于进一步阐明食管癌发生发展的分子机制。

Figure 5. Effects of STK15 overexpression on tumor growth of nude mice. Mean±SD.n=6.**P<0.01vscontrol.
图5STK15过表达对裸鼠肿瘤生长的影响
本研究采用基因工程技术构建STK15基因的重组表达载体pEGFP-C1-STK15,通过双酶切和测序鉴定均证实载体构建成功。而且,pEGFP-C1质粒含有GFP作为报告基因,在荧光显微镜下可显示绿色荧光,该基因与目的基因STK15连接形成融合基因,不影响目的基因的表达[13],可以追踪目的基因STK15在细胞中的定位以及表达情况。因此,重组表达载体pEGFP-C1-STK15的成功构建为后续研究奠定了良好的实验基础。
本研究进一步采用脂质体法将重组表达载体pEGFP-C1-STK15稳定转染人食管鳞癌细胞,证实GFP-STK15主要定位于细胞的中心体以及纺锤体,说明pEGFP-C1-STK15载体能在细胞中正确表达。同时Western blotting进一步证实筛选得到了STK15过表达的稳定细胞克隆。而且,我们发现STK15过表达能促进体外肿瘤细胞和体内裸鼠肿瘤细胞的生长,并使G0/G1期细胞百分率降低,细胞增殖率增加,细胞凋亡率减少,提示STK15过表达可能通过加速细胞周期进程和抑制细胞凋亡而促进肿瘤生长。与对照组相比,STK15过表达细胞系接种组裸鼠肿瘤组织中存在STK15过表达,进一步说明STK15过表达促进了裸鼠肿瘤的生长。Tanaka等[14]曾经报道,利用RNA干扰抑制STK15的表达,可以抑制肿瘤细胞的生长,与本文研究结果相一致。综上所述,本研究初步揭示了STK15过表达对食管癌发生发展的影响,因而为进一步阐明STK15的功能提供了一定的实验和研究基础,提示STK15将可能成为治疗食管癌的新靶点。

Figure 6. The expression of STK15 mRNA (A) and protein (B) in tumor tissues of nude mice detected by RT-PCR (A) and Western blotting (B), respectively. Mean±SD.n=3.**P<0.01vscontrol.
图6RT-PCR和Westernblotting检测STK15在裸鼠肿瘤组织中的表达
[1] Green MR, Woolery JE, Mahadevan D. Update on aurora kinase targeted therapeutics in oncology [J]. Expert Opin Drug Discov, 2011, 6(3):291-307.
[2] Giet R, Prigent C. Aurora/Ipl1p-related kinases, a new oncogenic family of mitotic serine-threonine kinases [J]. J Cell Sci, 1999, 112(Pt 21):3591-3601.
[3] Zhou H, Kuang J, Zhong L, et al. Tumour amplified kinase STK15/BTAK induces centrosome amplification, aneuploidy and transformation [J]. Nat Genet, 1998, 20(2): 189-193.
[4] Jeng YM, Peng SY, Lin CY, et al. Overexpression and amplification of Aurora-A in hepatocellular carcinoma [J]. Clin Cancer Res, 2004, 10(6): 2065-2071.
[5] Lassus H, Staff S, Leminen A, et al. Aurora-A overexpression and aneuploidy predict poor outcome in serous ovarian carcinoma [J]. Gynecol Oncol, 2011, 120(1):11-17.
[6] Liu ZG, Yi W, Tao YL, et al. Aurora-A is an efficient marker for predicting poor prognosis in human nasopharyngeal carcinoma with aggressive local invasion: 208 cases with a 10-year follow-up from a single institution [J]. Oncol Lett, 2012, 3(6):1237-1244.
[7] Kumano M, Miyake H, Terakawa T, et al. Suppressed tumour growth and enhanced chemosensitivity by RNA interference targeting Aurora-A in the PC3 human prostate cancer model [J]. BJU Int, 2010, 106(1):121-127.
[8] Ferchichi I, Kourda N, Sassi S, et al. Aurora A overexpression and pVHL reduced expression are correlated with a bad kidney cancer prognosis [J]. Dis Markers, 2012, 33(6):333-340.
[9] Tong T, Zhong Y, Kong J, et al. Overexpression of Aurora-A contributes to malignant development of human esophageal squamous cell carcinoma [J]. Clin Cancer Res, 2004, 10(21): 7304-7310.
[10] Shi J, Xue LY, Yin N, et al. Clinical significance of abnormal expression of Aurora-A in human esophageal squamous cell carcinoma with or without lymph node metastasis [J]. Zhonghua Zhong Liu Za Zhi, 2010, 32(10):748-751.
[11] Wang X, Lu N, Niu B, et al. Overexpression of Aurora-A enhances invasion and matrix metalloproteinase-2 expression in esophageal squamous cell carcinoma cells [J]. Mol Cancer Res, 2012, 10(5):588-596.
[12] 昌毓穗, 刘季春, 傅华群, 等. Ras-MAPK通路在食管癌中的研究进展[J]. 中国病理生理杂志, 2013, 29(2):376-380.
[13] Chalfie M, Tu Y, Euskirchen G, et al. Green fluorescent protein as a marker for gene expression [J]. Science, 1994, 263(5148):802-805.
[14] Tanaka E, Hashimoto Y, Ito T, et al. The suppression of aurora-A/STK15/BTAK expression enhances chemosensitivity to docetaxel in human esophageal squamous cell carcinoma [J]. Clin Cancer Res, 2007, 13(4):1331-1340.
EffectsofSTK15overexpressionongrowthofhumanesophagealcarcinomacelllineKYSE150
WANG Xiao-xia1, LI Xiao-zhong2, LU Na1, ZHAO Yan1, WANG Kang1, PEI Yi3
(1DepartmentofBiochemistryandMolecularBiology,ShanxiMedicalUniversity,Taiyuan030001,China;2DepartmentofEmergency,ShanxiProvincialPeople’sHospital,Taiyuan030012,China;3DepartmentofGeriatricOncology,ShanxiAcademyofMedicalSciences,ShanxiDayiHospital,Taiyuan030032,China.E-mail:wxiaoxia99007@126.com)
AIM: To investigate the effects of serine/threonine kinase 15 (STK15) overexpression on the growth of human esophageal squamous-cell carcinoma (ESCC) cell line KYSE150.METHODSRecombinant pEGFP-C1-STK15 expression vector was transfected into KYSE150 cells using LipofectamineTM2000 and the expression of STK15 was detected by fluorescence microscopy and Western blotting. The proliferation of the cellsinvitrowas measured by MTT assay. The cell cycle distribution and apoptosis were detected by flow cytometry. The proliferation of the cellsinvivowas measured by tumorigenicity experiment in nude mice.RESULTSAfter recombinant pEGFP-C1-STK15 expression vector was stably transfected into KYSE150 cells, GFP-STK15 fusion protein localized to centrosome and spindle. The STK15-overexpressing colonies were further confirmed by Western blotting. MTT assay showed that the proliferation of the cells in STK15 overexpression group was increased compared with control group (P<0.01). Flow cytometry analysis showed that the percentage of the cells in G0/G1phase and the cell apoptosis in STK15 overexpression group were decreased compared with control group (P<0.01). The tumorigenicity experiment in nude mice showed that the proliferation of the cells in STK15 overexpression group was increased compared with control group (P<0.01).CONCLUSIONOverexpression of STK15 in human ESCC KYSE150 cells promotes the cell growthinvitroandinvivo, indicating that STK15 may serve as a novel therapeutic target for esophageal carcinoma.
Serine/threonine kinase 15; Esophageal neoplasms; Cell proliferation
R735.1
A
10.3969/j.issn.1000- 4718.2013.11.007
1000- 4718(2013)11- 1957- 05
2013- 05- 10
2013- 07- 17
国家自然科学基金资助项目(No. 30973401);山西省自然科学基金资助项目(No. 2009011052)
△通讯作者 Tel: 0351-4135637; E-mail: wxiaoxia99007@126.com

