上调miR-187* 表达对人结肠癌细胞株增殖活性的影响*
张丽静, 刘 博, 赵增仁, 樊智彬, 田延锋
(河北医科大学第一医院普外科,河北 石家庄050031)
近年来,我国结直肠癌的发病率逐年上升。研究表明,微小RNA(microRNA,miRNA)可通过调控靶基因的表达,在细胞分化、细胞周期及凋亡过程中发挥重要作用[1]。本课题组早期利用miRNA 芯片筛查了结直肠癌组织和正常黏膜的miRNA 表达谱,发现miR-187* 是其中具有显著差异性表达的miRNA 之一。为此,本研究通过实时定量PCR 验证miR-187* 的表达结果,并通过转染模拟物,观察上调miR-187* 表达对结肠癌细胞增殖及细胞周期的影响。
材 料 和 方 法
1 实验对象
人结肠癌细胞株Caco-2、DLD1、HCT116、HT29、LoVo、SW480、SW620 和SW1116 由香港中文大学消化疾病研究所于君教授馈赠。收集河北医科大第一医院2010 年6 月至2012 年6 月间正常结肠黏膜组织10 例。新鲜组织切除后快速置于液氮后储存于-80 ℃冰箱。
2 主要试剂
McCoys 5A 培养基、RPMI-1640 培养基和DMEM高糖培养基购自Gibco;胎牛血清购自HyClone;脂质体转染试剂LipofectamineTM2000 购自Invitrogen;miRNA 提取试剂盒和miR-187* 荧光定量PCR 检测试剂盒购自Ambion;miR-187* 模拟物和阴性对照购自广州锐博生物技术有限公司;MTS 细胞增殖检测试剂盒购自Promega。
3 主要方法
3.1 miRNA 微阵列芯片检测 选取3 例性别、年龄及临床病理资料一致的结直肠癌患者,收集术中肿瘤组织及切缘正常黏膜组织标本,提取RNA 后,采用ParafloTMmiRNA 微阵列芯片分析,筛选出结直肠癌组织中异常表达的miRNAs。miRNA 探针序列信息来自于Sanger miRBase Release 17.0 版本数据库,该芯片含有1 719 条成熟的人miRNAs 探针,此项工作由美国LC Sciences 公司完成。
3.2 细胞培养、细胞株及正常结肠组织中miR-187* 表达水平的检测 DLD1 细胞、SW480、SW620 和SW1116 细胞培养于RPMI-1640 培养基中,HT29 和HCT116 细胞培养于McCoy's 5A 培养基中,LoVo 细胞培养于DMEM 培养基中,均添加10%胎牛血清。6 孔板细胞培养板隔天传代扩增结肠癌细胞,待细胞状态良好,近90%融合时,预冷PBS 冲洗细胞3 次终止培养,冰上刮棒刮取细胞移入离心管,离心后收集细胞备用。
取新鲜结肠组织100 mg,置于液氮预冷处理的研钵中,固化、研碎,备用提取RNA。按照miRNA 提取试剂盒说明,分别抽提8 株结肠癌细胞株及正常结肠新鲜组织中总miRNA。按照Ambion 公司的qRT-PCR miRNA 检测试剂盒说明,首先对各个细胞系和新鲜组织总miRNA 进行逆转录,然后在实时定量PCR 仪上进行PCR 扩增,使用U6 作为内参照。
3.3 miR-187* 模拟物的转染 将结肠癌细胞HCT116 细胞接种后24 h,待贴壁细胞达到40% ~50% 时进行转染,参照脂质体转染试剂说明书分别转染miR-187* 模拟物和阴性对照(negative control,NC)。
3.4 细胞增殖活性的检测 (1)转染miR-187* 模拟物组和NC 组结肠癌HCT116 细胞株,于转染后24 h ,消化细胞,分别接种于96 孔板。按照MTS 细胞增殖检测试剂盒说明,分别于接种96 孔板后12、24、36、48 和60 h 各检测1 次。每组设5 个复孔,实验重复3 次。(2)细胞转染后24 h,收集提取2 组细胞中RNA,进行反转录,检测增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)mRNA 的变化。PCNA 及GAPDH 引物由北京赛百盛生物公司合成。PCNA 上游引物5'-CTTTTCTGTCACCAAATTTGTACC-3',下游引物5'-AACTGCATTTAGAGTCAAGACCC-3';GAPDH上游引物5'-AGCCTCAAGATCATCAGCAATG-3',下游引物5'-TGTGGTCATGAGTCCTTCCACG-3'。结果用2-ΔCt法计算,ΔCt =目的基因平均Ct 值-内参照基因平均Ct 值。
3.5 流式细胞术检测细胞周期 转染miR-187* 模拟物组和NC 组结肠癌HCT116 细胞株,于转染后48 h,消化收集细胞样品,制成单细胞悬液,然后1 200 r/min 离心5 min,弃上清液。用4 ℃预冷的70%冷乙醇固定,4 ℃保存,固定18 h。调整细胞浓度为1 ×109cells/L,取1 mL 细胞悬液,用PBS 洗3 次,细胞重悬于1 mL PI 染液中,室温避光孵育30 min 后,流式细胞仪测荧光强度,PI 染液终浓度为50 mg/L,RNase 终浓度为10 mg/L。CellQuest 分析软件进行细胞周期DNA 含量分析,确定细胞周期分布。
3.6 miR-187* 的靶基因预测及表达情况 检索miRDB、DIANA-microT 和microRNA. org 等数据库,取多个数据库预测靶基因的交集,发现miR-187* 可能的靶基因有TBX22、B 细胞特异性莫洛尼小鼠白血病病毒整合位点1(B-cell-specific Moloney murine leukemia virus integration site 1,BMI-1)、CDH2、MYB、RB1、FZD3 等。查阅相关文献后,我们初步选定BMI-1 为可能的靶基因。随后我们检测了BMI-1 mRNA 在人结肠癌细胞株及正常结肠组织中的表达情况。BMI-1 上游引物为5'-GTGCTTTGTGGAGGGTACTTCAT-3 ',下 游 引 物 为 5 '-TTGGACATCACAAATAGGACAATACTT-3',以GAPDH 作为内参照。细胞转染后24 h,收集细胞,Trizol 法提取细胞中的总RNA。采用荧光定量RT-PCR 方法检测各转染组细胞中BMI-1 mRNA 的表达,结果用2-ΔCt法计算。
4 统计学处理
采用SPSS 16.0 统计软件分析。数据用均数±标准差(mean±SD)表示,两组间比较用t 检验,多组数据之间的差异采用单因素方差分析。以P <0.05为差异有统计学意义。
结 果
1 结肠癌细胞株中miR-187* 的表达
本课题组前期使用miRNA 芯片检测了3 对结直肠癌组织及匹配的远端正常黏膜组织中的miRNA表达谱,发现miR-187* 在结直肠癌组织中的表达较正常结直肠黏膜组织明显下调,见图1。本实验中我们检测了8 种结肠癌细胞株中miR-187* 的表达,如图2 所示,在结肠癌细胞株中miR-187* 的表达较正常结直肠黏膜组织明显下调,与组织芯片结果一致。

Figure 1. miRNA array results. T1,T2,T3:the primary tumor tissues from three cases of colorectal cancer patients;N1,N2,N3:the matched normal mucosal tissues.图1 miRNA 芯片结果
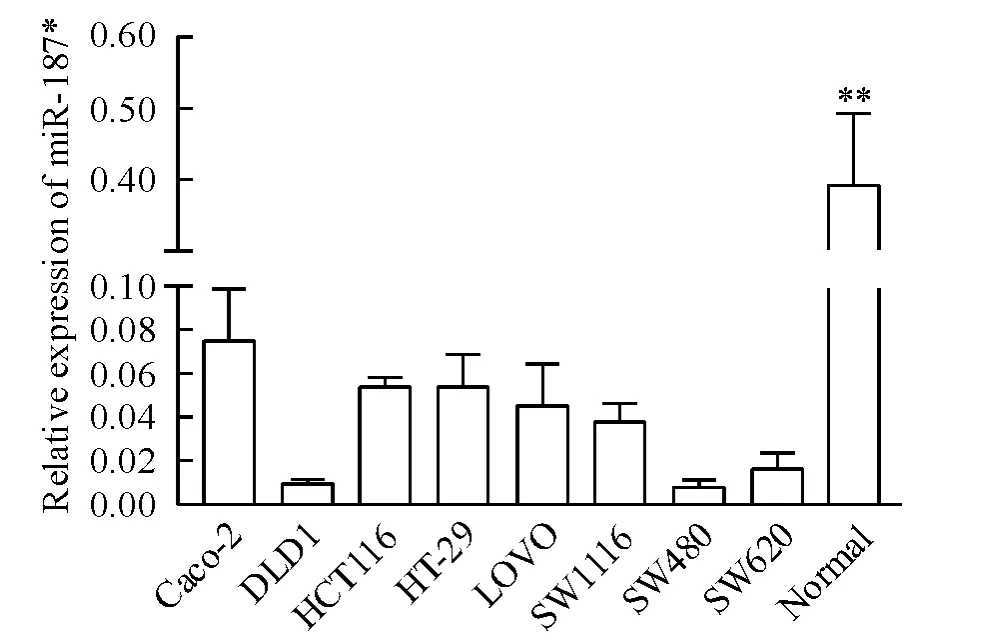
Figure 2. miR-187* expression in eight colon cancer cell lines and the normal colon tissues. Mean ± SD. n = 3.**P <0.01 vs colon cancer cell lines.图2 结肠癌细胞株及正常结肠黏膜组织中miR-187* 的表达
2 miR-187* 对结肠癌细胞HCT116 增殖活性的影响
将HCT116 细胞分别转染miR-187 模拟物和阴性对照,检测miR-187* 的表达,结果显示,转染miR-187* 模拟物组,miR-187* 的表达水平明显升高,约是NC 组的1 000 倍,见图3A。随后使用MTS法检测这2 组细胞在不同时点的增殖活性,结果发现转染miR-187* 模拟物组与NC 组相比,各个时点细胞的增殖活力显著降低(P <0.01),见图3B。同时转染miR-187* 模拟物组,PCNA mRNA 的表达亦明显降低(P <0.05),见图3C。
3 miR-187* 对结肠癌细胞HCT116 细胞周期的影响
对转染48 h 后的细胞进行细胞周期分析,与NC对照组相比,转染miR-187 模拟物后,G2/M 期的细胞比例明显增加,见图4。
4 结肠癌细胞株中BMI-1 mRNA 的表达
采用荧光定量RT-PCR 检测8 种结肠癌细胞株和正常结直肠黏膜组织中BMI-1 mRNA 的表达情况,发现结肠癌细胞株中BMI-1 mRNA 的表达较正常结直肠黏膜组织表达明显增高,见图5。
5 转染miR-187* 抑制BMI-1 mRNA 表达
瞬时转染HCT116 细胞,应用实时荧光定量PCR 检测转染后实验组及对照组HCT116 细胞中BMI-1 mRNA 的表达水平,结果表明,miR-187* 高表达导致BMI-1 mRNA 表达下调(P <0.01),见图6。
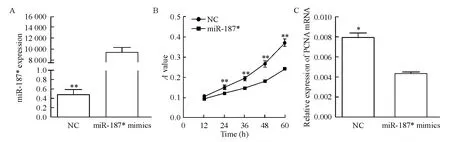
Figure 3. The effect of miR-187* on the proliferation of HCT116 cells.A:miR-187* expression after transfection with miR-187*mimics (n=3);B:MTS results(n=5);C:PCNA mRNA expression(n=3).Mean±SD. * P <0.05,**P <0.01 vs miR-187* mimics.图3 miR-187* 对结肠癌细胞HCT116 增殖活性的影响
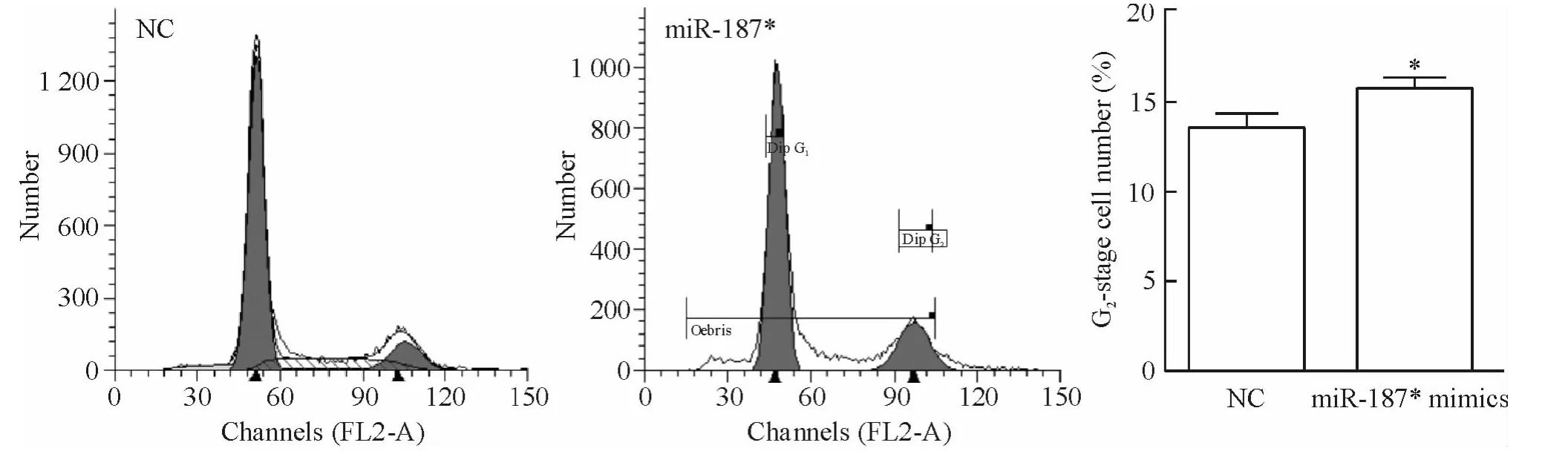
Figure 4. Cell cycle of HCT116 cells tested by flow cytometry. Mean±SD.n=3. * P <0.05 vs NC.图4 流式细胞术分析细胞周期
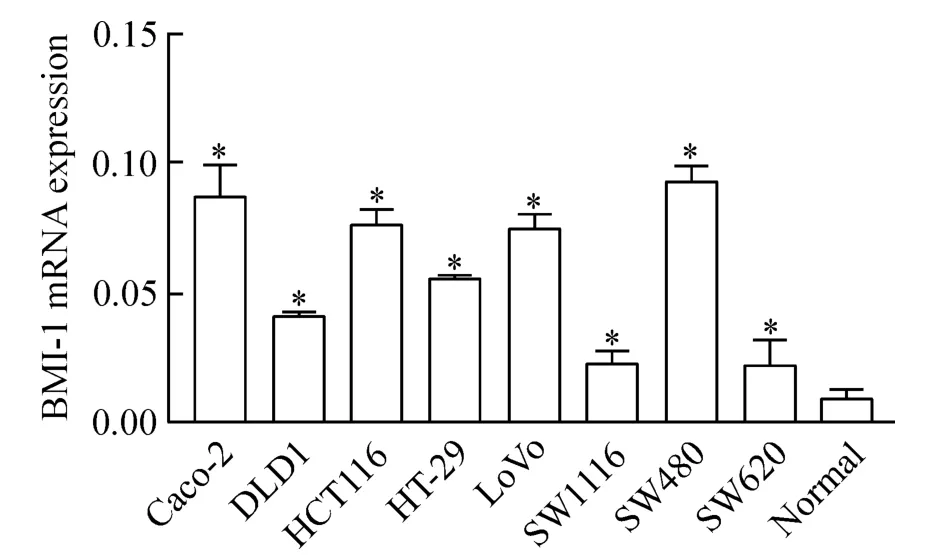
Figure 5. BMI-1 mRNA expression in human colon cancer cell lines and the normal mucosal tissues detected by realtime RT-PCR. Mean ± SD. n =3. * P <0. 05 vs normal.图5 结肠癌细胞株中BMI-1 mRNA 的表达
讨 论
miRNA 是一类长约19 ~24 nt 的单链非编码RNA,它具有多种调控基因表达的功能。miRNA 主要通过特异性识别并结合靶mRNA 的3'-非翻译区(untranslated region,UTR),于转录后促进靶mRNA降解和(或)抑制翻译过程而发挥作用[2]。miRNAs几乎在所有细胞的生物学进程中发挥重要的调控作用,如细胞增殖、分化、代谢、凋亡和应激等。人类蛋白质编码基因约1/3 受miRNA 的调控[3]。
研究表明,miRNA 在结直肠癌发生和发展过程中发挥了重要的作用。表达谱分析发现,结直肠癌中存在许多异常表达的miRNA,功能研究也发现不同的miRNA 在结直肠癌的进程中发挥着不同的作用:某些miRNA 通过靶向调节原癌基因起到抑制肿瘤的作用[4],而某些miRNA 则通过靶向调节抑癌基因发挥促进结直肠癌发生发展的作用[5]。例如:miR-143 通过直接抑制K-ras 癌基因的表达而抑制结直肠癌细胞增殖[6];miR-195 通过调节Bcl-2 的表达,抑制结直肠癌细胞凋亡[7];miR-137 通过调节FMNL2 表达调控结直肠癌细胞的浸润和转移[8]。
为了探讨miRNA 参与结肠癌发生发展的分子机制,本研究前期通过miRNA 芯片技术筛选出大量差异性表达的miRNA,其中miR-187* 在结直肠癌组织中表达明显下调。miR-187* (miR-187-5p)是miR-187 家族的一员,位于18 号染色体上[9]。目前关于miR-187 在肿瘤中的作用尚存在一定的争议,有学者研究证实,卵巢癌中miR-187 呈高表达[10],乳腺癌中miR-187 的高表达和患者的不良预后有关[11],然而前列腺癌和胰腺癌细胞中miR-187 低表达[12-13]。
目前关于miR-187* 在肿瘤中的研究罕有报道。Liu 等[14]发现miR-187* 在胃癌患者中表达水平明显升高,Ho 等[15]研究证实,毛细胞型星形细胞瘤标本中miR-187* 的表达水平明显低于正常组织。然而未见在结直肠癌组织中的相关研究。为了验证前期芯片中miR-187* 表达的结果,本研究通过实时荧光定量PCR 技术再次检测了8 种结肠癌细胞株中miR-187* 的 表 达 状 况,结 果 发现,结肠癌细胞株中miR-187* 的表达较正常结肠组织显著降低,与miRNA 芯片结果一致,表明miR-187* 的表达下调可能与结直肠癌发展有关。
为了深入了解miR-187* 在结肠癌发病过程中的具体作用及其对结肠癌细胞生物学行为的影响,本研究使用化学合成的miR-187* 模拟物转染结肠癌HCT116 细胞,上调结肠癌HCT116 细胞中miR-187* 的表达,采用MTS 与流式细胞技术检测细胞周期,测定细胞增殖活性,发现miR-187* 模拟物转染结肠癌细胞后,明显抑制该细胞增殖速度,抑制效应持续48 h 以上;且转染miR-187* 模拟物组PCNA mRNA 表达也明显下降。miR-187* 模拟物转染组中G2/M 期细胞明显增多,提示转染miR-187*模拟物后,可致HCT116 细胞周期发生改变。miR-187* 可能是通过将细胞周期阻滞在G2期,延长细胞增殖周期而起到抑制细胞增殖的作用。
细胞增殖过程有诸多蛋白参与,推测miR-187*可能直接或间接锚定其中某些蛋白mRNA 3'-UTR区,使蛋白合成抑制或减少,使细胞周期与细胞增殖活性失调而发生恶性转化。卵巢癌中的一项研究表明,miR-187 通过调控抑癌基因Dab2 促进细胞增殖[10]。本课题组通过对多种miRNA 靶标数据库进行预测,发现BMI-1 可能是miR-187* 的下游靶点。BMI-1 是多梳家族成员之一,通过调控组蛋白乙酰化或去乙酰化修饰过程,影响细胞增殖、凋亡过程[16-17]。研究证实,BMI-1 在多种肿瘤中高表达,包括胃癌、结肠癌、乳腺癌等。蒋丽丽等[18]研究发现,BMI-1 在胶质瘤的发生发展过程中起到重要作用,抑制BMI-1 表达可以抑制胶质瘤细胞的增殖及血管增生能力。本实验中,我们转染miR-187* 模拟物之后,miR-187* 的表达明显增加,同时发现,miR-187* 的高表达显著抑制了BMI-1 的转录。因此我们推测miR-187* 可能通过调控BMI-1 而发挥抑制肿瘤细胞增殖的作用。但其具体作用机制尚待进一步研究。
综上所述,miR-187* 高表达能够抑制结肠癌细胞增殖活性,影响细胞周期,在结肠癌发生发展中起重要作用。BMI-1 可能为miR-187* 的作用靶点,深入探讨二者的相互关系可为阐明miR-187* 的抑癌机制提供新的思路。
[1] Ambros V. The function of animal microRNAs[J]. Nature,2004,431(7006):350-355.
[2] Rosenfeld N,Aharonov R,Meiri E,et al. MicroRNAs accurately identify cancer tissue origin[J]. Nat Biotechnol,2008,26(4):462-469.
[3] Lim LP,Lau NC,Garrett-Engele P,et al. Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs[J]. Nature,2005,433(7027):769-773.
[4] Zhang N,Li X,Wu CW,et al. microRNA-7 is a novel inhibitor of YY1 contributing to colorectal tumorigenesis[J]. Oncogene,2013,32(42):5078-5088.
[5] He X,Dong Y,Wu CW,et al. MicroRNA-218 inhibits cell cycle progression and promotes apoptosis in colon cancer by downregulating BMI1 polycomb ring finger oncogene[J]. Mol Med,2012,18:1491-1498.
[6] Chen X,Guo X,Zhang H,et al. Role of miR-143 targeting KRAS in colorectal tumorigenesis[J]. Oncogene,2009,28(10):1385-1392.
[7] Liu L,Chen L,Xu Y,et al. microRNA-195 promotes apoptosis and suppresses tumorigenicity of human colorectal cancer cells[J]. Biochem Biophys Res Commun,2010,400(2):236-240.
[8] Liang L,Li X,Zhang X,et al. MicroRNA-137,an HMGA1 target,suppresses colorectal cancer cell invasion and metastasis in mice by directly targeting FMNL2[J]. Gastroenterology,2013,144(3):624-635.e4.
[9] Ferracin M,Pedriali M,Veronese A,et al. microRNA profiling for the identification of cancers with unknown primary tissue-of-origin[J]. J Pathol,2011,225(1):43-53.
[10] Chao A,Lin CY,Lee YS,et al. Regulation of ovarian cancer progression by microRNA-187 through targeting Disabled homolog-2[J]. Oncogene,2012,31(6):764-775.
[11]Mulrane L,Madden SF,Brennan DJ,et al.miR-187 is an independent prognostic factor in breast cancer and confers increased invasive potential in vitro[J].Clin Cancer Res,2012,18(24):6702-6713.
[12]Fuse M,Kojima S,Enokida H,et al. Tumor suppressive microRNAs (miR-222 and miR-31)regulate molecular pathways based on microRNA expression signature in prostate cancer[J]. J Hum Genet,2012,57(11):691-699.
[13]Schultz NA,Andersen KK,Roslind A,et al. Prognostic microRNAs in cancer tissue from patients operated for pancreatic cancer:five microRNAs in a prognostic index[J].World J Surg,2012,36(11):2699-2707.
[14]Liu H,Zhu L,Liu B,et al. Genome-wide microRNA profiles identify miR-378 as a serum biomarker for early detection of gastric cancer[J]. Cancer Lett,2012,316(2):196-203.
[15]Ho CY,Bar E,Giannini C,et al. MicroRNA profiling in pediatric pilocytic astrocytoma reveals biologically relevant targets,including PBX3,NFIB,and METAP2[J]. Neuro Oncol,2013,15(1):69-82.
[16]崔学江,朱定军,韩金利,等. siRNA 干扰Bmi-1 基因对膀胱癌EJ 细胞增殖的调控作用及其机制[J]. 中国病理生理杂志,2011,27(8):1519-1524.
[17]练国达,邓 辉,陈茵婷,等.Bmi-1 基因过表达对人正常胃黏膜上皮细胞株GES-1 增殖的影响[J]. 中国病理生理杂志,2012,28(5):807-810.
[18]蒋丽丽,杨昌山,赵灿国. Bmi-1 促人胶质瘤SNB19 细胞生长恶化的作用机制[J]. 中国病理生理杂志,2013,29(3):418-424.

