骨髓基质细胞介导的微环境对人肝癌细胞株SMMC-7721的作用以及机制研究*
白慧丽, 李宝林, 何 方, 张汝益, 严树涓, 刘 晨, 杨丹丹, 施 琼
(重庆医科大学检验医学院临床检验诊断学教育部重点实验室,重庆400016)
肝癌是世界上癌症死亡的三大原因之一,在我国居于第二位。肝癌预后差的主要原因是门静脉侵袭引起的高发肝内转移[1],因此,控制肝癌转移是改善病人预后的重要课题。而早在100多年以前,学者[2]基于乳腺癌的器官特异性转移中的临床观察,提出了著名的“种子与土壤”学说,该学说证实了肿瘤发生发展及转移的整个过程都与其所处的微环境密切相关。
骨髓基质细胞(marrow stromal cells,MSCs)也被称为间充质干细胞(mesenchymal stem cells,MSCs)[3],是肿瘤基质的重要组成成分,在体内可以通过分泌多种生长因子来影响肿瘤的生长,其中趋化因子CCL5即受激活调节的正常T细胞表达和分泌因子(regulated upon activation,normal T-cell expressed and secreted,RANTES),是 T细胞和单核细胞的CC类趋化细胞因子,其受体有CCR1、CCR3和CCR5。大量研究表明MSCs可以刺激肿瘤细胞分泌CCL5。Stormes等[4]认为高表达 CCL5的肿瘤细胞具有更强的转移能力。CCL5/CCR5在很多实体瘤中已有研究,包括乳腺癌、黑色素瘤、胃癌、卵巢癌、子宫颈癌、结肠癌、前列腺癌和肾癌等[5]。研究发现CCL5及其受体CCR1和CCR5在肝纤维化的进展中发挥很重要作用[6]。MSCs对肿瘤的影响可为促进作用也可为抑制作用,而对肝癌细胞的作用及机制尚未阐明。因此,本研究采用人骨髓基质细胞HS-5为研究对象,分别利用HS-5细胞条件培养基 (HS-5 cell-conditioned medium,HS-5-CM)和HS-5细胞处理肝癌细胞SMMC-7721,旨在探讨MSCs对肝癌细胞的作用和机制,以及肿瘤微环境中趋化因子CCL5及其受体分泌的变化,为临床应用提供更广阔的空间。
材料和方法
1 材料
1.1 细胞株 人肝癌细胞株SMMC-7721和人正常肝细胞株LO2由重庆医科大学临床检验诊断学教育部重点实验室前期保存备用,人骨髓基质细胞株HS-5购自ATCC。
1.2 主要试剂 DMEM高糖培养基和胎牛血清购自HyClone;逆转录PCR和定量PCR SYBR Premix Ex Taq购自TaKaRa;引物由TaKaRa合成;MTT试剂、基质胶购自Sigma;Human CCL5 ELISA检测试剂盒购自RayBio;Western blotting及蛋白质提取相关试剂购自上海碧云天生物技术有限公司;PI3K特异性抑制剂LY294002、抗Akt抗体和抗p-Akt473抗体购自Cell Signaling;抗CCR1、CCR3和CCR5抗体购自Abcam;抗β-actin抗体购自Santa Cruz;Ⅱ抗山羊抗鼠IgG和山羊抗兔IgG购于北京中杉金桥生物技术有限公司;化学发光试剂盒购自Millipore;苏木精、伊红等试剂为进口分装或国产分析纯。
2 方法
2.1 共培养体系的建立 采用具有PET膜的Transwell小室(孔径为0.4μm)进行间接共培养:将HS-5细胞接种于 Transwell小室 1×105cells/well,SMMC-7721细胞接种于6孔板2×105cells/well,待细胞8 h贴壁后,将小室悬挂6孔板上。Control组:SMMC-7721细胞;co-culture组:SMMC-7721细胞+HS-5细胞。2组均更换为双无DMEM培养基,培养3 d。
2.2 HS-5-CM的制备 将细胞密度为70%的HS-5细胞接种于直径为10 cm的培养皿中,待贴壁后,PBS洗3次,更换为10 mL无血清的DMEM高糖培养基,每24 h收集1次上清,并更换为新鲜无血清的DMEM高糖培养基,收集3 d,混匀,1 000 r/min离心15 min,取上清配制50%HS-5-CM(HS-5-CM∶无血清DMEM培养基为1∶1)和100%HS-5-CM于 -20℃保存备用。
2.3 MTT检测HS-5-CM对SMMC-7721细胞增殖能力的影响 SMMC-7721细胞以500 cells/well接种于96孔板中,每组6个平行孔,待细胞贴壁后PBS洗3次,加入无血清培养液100μL,control组:SMMC-7721细胞;50%HS-5-CM组:SMMC-7721细胞 +50%HS-5-CM;100%HS-5-CM组:SMMC-7721细胞+100%HS-5-CM。分别于 0 d、1 d、2 d、3 d 对SMMC-7721细胞进行 MTT检测,每孔加入20μL MTT(5.0 g/L),继续培养4 h,吸尽孔内培养液,加入150μL/well DMSO,轻摇振荡10 min,使紫色结晶物充分溶解,于酶标仪492 nm处检测各孔的吸光度(absorbance,A),重复3次取平均值。
2.4 划痕实验检测HS-5-CM对SMMC-7721细胞迁移能力的影响 SMMC-7721细胞以2×105cells/well接种于6孔板中,细胞密度达到90%时,用0.5 mm中性笔尖行“一”字划痕,PBS洗3次,更换为含不同浓度HS-5-CM完全培养基2 mL,倒置显微镜下观察照相,此时记为0 h;37℃、5%CO2饱和湿度孵箱中继续培养,48 h时在同一观察点观察划痕愈合情况。实验分组同上,通过测量多个点划痕宽度,比较各组的细胞愈合情况,计算平均划痕愈合率。划痕愈合率(%)=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%,重复3次取平均值。
2.5 Transwell实验检测HS-5-CM对SMMC-7721细胞迁移和侵袭能力的影响 将对数生长期SMMC-7721细胞制成无血清的单细胞悬液,细胞密度4×107cells/L,取400μL接种在Transwell小室的上室中(做侵袭实验需要铺基质胶,基质胶与预冷的双无
DMEM培养基按1∶7的比例铺设),下室中加入600 μL含20%血清的培养液。实验分组同上,24 h后取出小室,用湿棉签拭去微孔膜上层细胞,无水乙醇固定20 min,苏木精和伊红各染色20 min。置于载玻片上在显微镜下计数,每个小室至少计数10个视野,每组3个平行孔,计算均值,实验重复3次。
2.6实时荧光定量RT-PCR(qRT-PCR)检测SMMC-7721细胞中CCL5及其受体mRNA表达 Trizol法提取各组SMMC-7721细胞总RNA,按试剂盒的方法逆转录,以逆转后的cDNA进行PCR扩增。通过Primer Premier 5软件设计引物,引物序列见表1。反应体系为:cDNA 2 μL,SyberGreen Mix 10 μL,上、下游引物各0.8 μL,ddH2O 6.4 μL。反应条件为:95 ℃ 30 s,95 ℃ 5 s,60℃ 20 s,72℃ 20 s,共40个循环。所有样本结果以GAPDH的表达做相对定量分析。数据分析采用比较Ct法(ΔΔCt),相对表达量 =2-ΔΔCt=2-(ΔCtco-culture-ΔCtcontrol)=2-[(Ct co-culture-Ct GAPDH)-(Ct control-Ct GAPDH)]。实 验 分 组:control组为SMMC-7721细胞;co-culture组为SMMC-7721细胞+HS-5细胞。
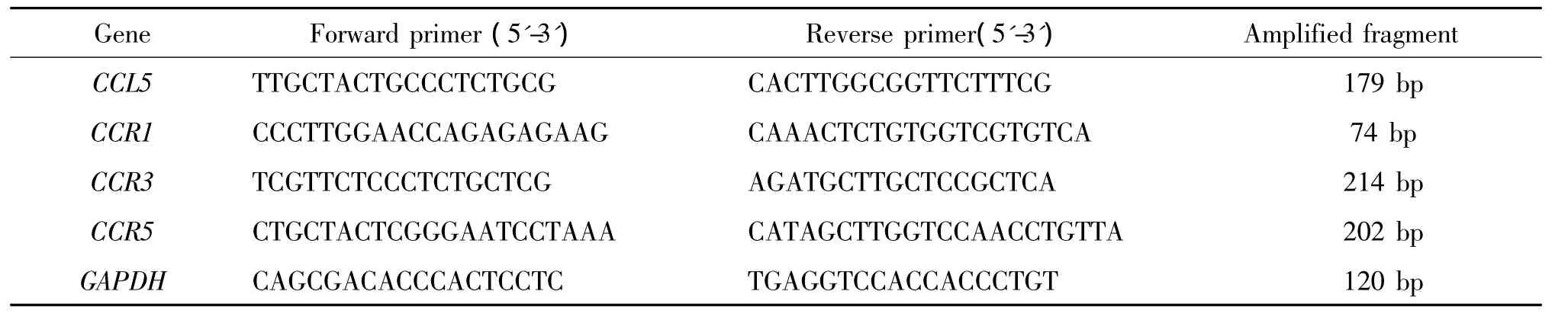
表1 扩增基因引物序列Table 1.The sequences of PCR primers for each gene
2.7 ELISA测定SMMC-7721细胞培养液中CCL5蛋白表达水平 收集各组SMMC-7721细胞培养上清,收集上清24 h前终止共培养并更换为新鲜无血清培养基,1 000 r/min离心15 min,收集上清液,按照Human CCL5 ELISA试剂盒说明书进行操作,450 nm处检测各孔吸光度值(A),使用Curve Expert软件根据标准曲线计算各组细胞中CCL5表达水平。数据取3次重复的平均值。
2.8 Western blotting测定 共培养 3 d后,提取SMMC-7721细胞总蛋白,BCA法检测蛋白浓度。取200μg蛋白质样品,与5×上样缓冲液混合,沸水煮8 min变性,经 SDS-PAGE、转膜、封闭。加入Ⅰ抗(1∶1 000),4 ℃ 孵 育 过 夜,洗 膜,加 入 Ⅱ 抗(1∶5 000),37 ℃孵育1 h,洗膜,化学发光显影,以 βactin作为内参照进行吸光度分析,实验重复3次。
3 统计学处理
数据以均数±标准差(mean±SD)表示,采用t检验比较两组间差异的显著性,两组以上比较采用单因素方差分析。采用SSPS 16.0统计软件分析,以P<0.05为差异有统计学意义。
结 果
1 HS-5-CM能促进SMMC-7721细胞的增殖能力
MTT结果显示,细胞培养第1天、第2天时50%HS-5-CM和100%HS-5-CM组A492值较control组增加不明显;第3天时50%HS-5-CM和100%HS-5-CM组A492值较control组分别增加12.43%(P>0.05)和43.29%(P<0.05),见图1。这说明HS-5-CM可以促进SMMC-7721细胞的增殖能力。
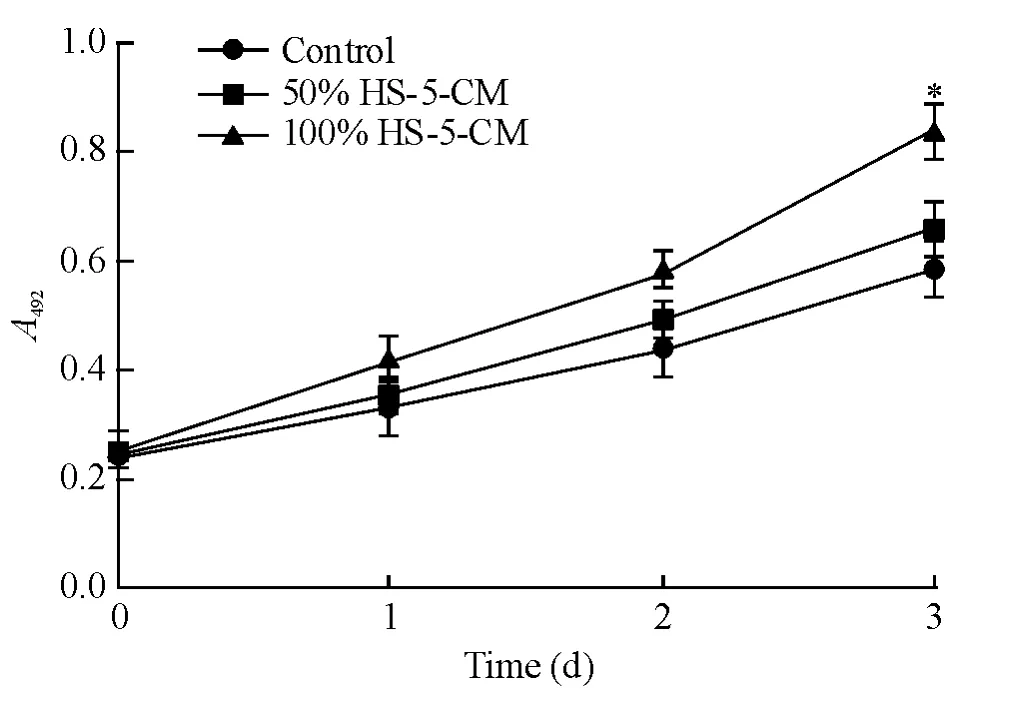
Figure 1.Effects of HS-5-CM on the proliferation of SMMC-7721 cells measured by MTT assay.Mean ± SD.n=3.*P <0.05 vs control group.图1 MTT测定HS-5-CM对SMMC-7721细胞增殖的影响
2 HS-5-CM能促进SMMC-7721细胞的迁移能力
划痕实验结果显示,50%HS-5-CM组和100%HS-5-CM组的细胞划痕在48 h愈合率分别是65.35% ±2.46%和88.99% ±2.59%,与control组(52.73% ±2.53%)比较差异显著 (P<0.01),见图2A。Transwell实验结果显示,control组中 SMMC-7721细胞穿过小室膜的细胞数为(32±3)个,50%HS-5-CM组和100%HS-5-CM组则分别为(80±4)个和(124±4)个,均较control明显增加(P<0.01),见图2B。这说明HS-5-CM明显促进SMMC-7721细胞的迁移。
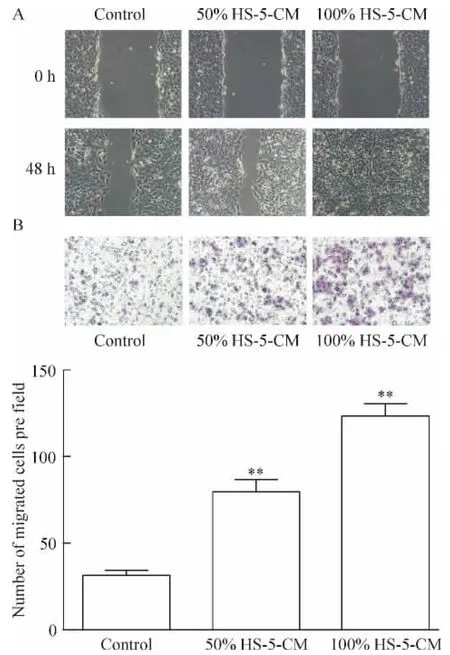
Figure 2.Effects of HS-5-CM on the migration of SMMC-7721 cells.A:the migration of SMMC-7721 cells measured by wound-healing assay(×100);B:the migration of SMMC-7721 cells measured by Transwell assay(×150).Mean±SD.n=3.**P <0.01 vs control group.图2 HS-5-CM对SMMC-7721细胞迁移的影响
3 HS-5-CM能促进SMMC-7721细胞的侵袭能力
Control组中穿过基质胶的细胞数为(45±5)个,50%HS-5-CM组和100%HS-5-CM组则分别为(87±3)个和(110±7)个,100%HS-5-CM组较control组明显增加(P<0.01),见图3。这提示 HS-5-CM明显促进SMMC-7721细胞的侵袭。
4 HS-5细胞可以增加SMMC-7721细胞中CCL5的表达
qRT-PCR检测结果显示(图4A),共培养3 d,与control组比,co-culture组 SMMC-7721细胞中 CCL5 mRNA表达增加69.39%(P<0.05);同样,ELISA方法检测SMMC-7721细胞上清中CCL5蛋白表达(图4B),第 1天时 co-culture组较 control组增加4.22%,第2天增加7.84%,第3天增加57.13%(P<0.01),差异有统计学意义。这表明HS-5细胞可以增加SMMC-7721细胞中CCL5的表达。

Figure 3.Effects of HS-5-CM on the invasion of SMMC-7721 cells measured by Transwell assay(×150).Mean±SD.n=3.**P <0.01 vs control group.图3 Transwell实验测定HS-5-CM对SMMC-7721细胞侵袭的影响

Figure 4.The expression of CCL5 mRNA and protein in SMMC-7721 cells after co-cultured with HS-5 cells.A:CCL5 mRNA detected by qRT-PCR;B:CCL5 protein detected by ELISA assay.Mean ± SD.n=3.*P <0.05,**P <0.01 vs control group.图4 SMMC-7721细胞与HS-5细胞共培养后SMMC-7721细胞中的CCL5 mRNA和蛋白的表达变化
5 HS-5细胞可以增加SMMC-7721细胞中CCL5受体CCR5的表达
qRT-PCR及Western blotting结果显示,共培养3 d,co-culture组与control组相比,CCR1和CCR3 mRNA和蛋白表达变化不大,而CCR5 mRNA表达较control组明显上升49.95%(P<0.01),蛋白水平较control组增加了1.77倍(P<0.01),见图5。这说明HS-5细胞能增加SMMC-7721细胞中CCR5 mRNA和蛋白表达。
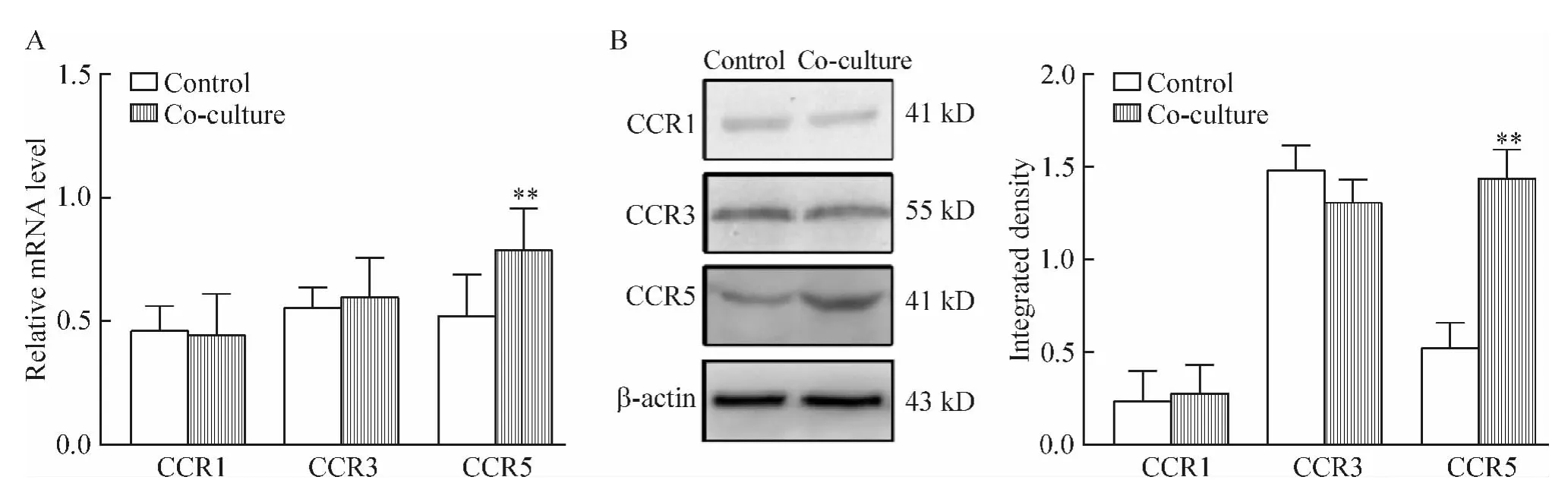
Figure 5.The expression of CCR1,CCR3 and CCR5 mRNA and proteins in SMMC-7721 cells after co-cultured with HS-5 cells for 3 d.A:CCR1,CCR3 and CCR5 mRNA detected by qRT-PCR;B:CCR1,CCR3 and CCR5 proteins detected by Western blotting.Mean±SD.n=3.**P <0.01 vs control group.图5 SMMC-7721细胞与HS-5细胞共培养3 d后SMMC-7721细胞中CCR1、CCR3和CCR5 mRNA和蛋白表达变化
6 激活PI3K-Akt通路可以增加共培养后SMMC-7721细胞中CCL5的表达
Western blotting结果显示(图6A),与control组相比,co-culture组的SMMC-7721细胞总Akt蛋白水平增加 98.68%(P<0.01),p-Akt473增加26.78%(P<0.05),差异有统计学意义。加入20μmol/L PI3K抑制剂 LY294002处理24 h后,co-culture组SMMC-7721细胞的总Akt和p-Akt473蛋白表达分别减少77.21%(P<0.01)和61.59%(P<0.01);control组 SMMC-7721细胞的 p-Akt473水平减少31.35%(P<0.05),但总Akt的蛋白水平变化不明显。qRT-PCR(图6B)和ELISA检测(图6C)显示,LY294002减少了co-culture组 SMMC-7721细胞中CCL5 mRNA(P<0.01)和蛋白表达(P<0.05),但是LY294002对control组CCL5分泌影响不大。
讨 论
MSCs作为一种新型的基因治疗的靶细胞,已广泛应用于解决肝移植、肝细胞移植和人工肝等治疗肝源短缺的问题。目前MSCs作为组织工程最有希望的种子细胞,具有多向分化潜能及低免疫源性等特点,而且诸多实验研究表明MSCs在体内外均能被诱导分化为肝细胞[7]。本课题应用的HS-5细胞为永生化的人MSCs,解决了原代细胞不易提取、传代次数少的问题。大多文献报道MSCs存在双向性,在白血病[8]、非霍奇金淋巴瘤[9]研究中 MSCs抑制肿瘤的增殖和发展,而在乳腺癌[10]、前列腺癌[11]研究中发现MSCs促进肿瘤生长和转移。本实验中采用HS-5-CM处理SMMC-7721细胞,发现HS-5-CM可以促进SMMC-7721细胞增殖、迁移和侵袭的能力,并采用间接共培养的方法,人为构建肿瘤微环境使得MSCs向肿瘤细胞趋化,来验证HS-5细胞对肝癌细胞SMMC-7721的作用,得出与HS-5-CM相似的结果。这可能为MSCs主要通过旁分泌细胞因子来诱导肝癌微环境的变化提供可能性依据。
有文献报道MSCs的分布大多聚集在肿瘤部位[12],可能是因为肿瘤细胞可以分泌趋化因子、细胞因子来招募和激活大量的未分化的基质细胞,反过来,基质细胞也促进肿瘤细胞的侵袭和转移[13]。越来越多的研究表明,趋化因子及其受体在肿瘤的发生发展,尤其是肿瘤转移过程中具有重要作用[14]。Aldinucci等[15]证实CCL5/CCR5信号通路不仅能参与调控霍奇金淋巴瘤细胞的增殖,而且在维持霍奇金淋巴瘤的组织微环境中也发挥重要作用。本研究中SMMC-7721细胞的CCL5表达水平较低,共培养后,CCL5 mRNA和蛋白水平均有明显增加,其受体CCR5也明显增加。因此我们认为在构建的肿瘤微环境体外模型中,CCL5有可能是通过CCR5起作用的。CCL5被称为是一个存在于肿瘤细胞和基质之间的中介者,而且CCL5也可以增加肝炎病人肝癌的发生风险[16]。此研究中 ELISA测定培养上清中CCL5的表达增加,测定的培养基为终止共培养后的新鲜培养基,可以认为是HS-5细胞介导的微环境刺激了SMMC-7721细胞自身的CCL5分泌增加,那么HS-5细胞促进肝癌细胞SMMC-7721的侵袭和迁移能力是否与此有关还有待我们深一步的探讨。此外Western blotting显示,PI3K抑制剂可以抑制共培养后SMMC-7721细胞PI3K-Akt通路的Akt和p-Akt的升高。文献指出 CCL5 可以激活 Gαi-PI3K-Akt[17],本课题的进一步研究得出PI3K抑制剂下调了共培养后SMMC-7721细胞CCL5的表达,这说明CCL5的升高在肝癌微环境中是通过PI3K-Akt通路发挥作用的。
综上所述,本研究说明了HS-5细胞可以促进肝癌细胞SMMC-7721的增殖、迁移和侵袭能力,而且可以通过激活PI3K-Akt通路增加SMMC-7721细胞CCL5的分泌,帮助我们进一步研究趋化因子在肿瘤微环境中的作用提供方向,并为人工肝移植提供理论依据。
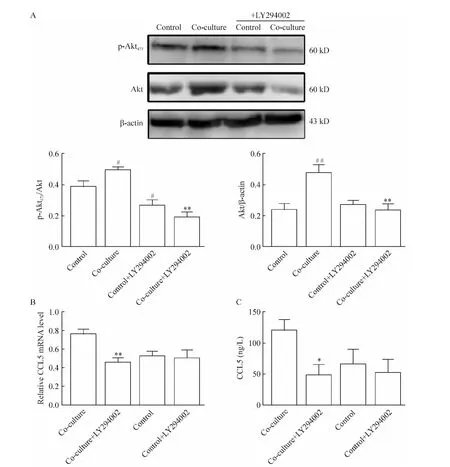
Figure 6.Expression of Akt,p-Akt473 and CCL5 in SMMC-7721 cells treated with PI3K inhibitor LY294002 after co-cultured with HS-5 cells.A:expression of Akt and p-Akt473 proteins detected by Western blotting;B:expression of CCL5 mRNA detected by qRT-PCR;C:secretion of CCL5 protein detected by ELISA assay.Mean±SD.n=3.#P<0.05,##P<0.01 vs control group;*P <0.05,** P <0.01 vs co-culture group.图6 PI3K抑制剂LY294002对共培养后SMMC-7721的Akt、p-Akt473和CCL5表达的影响

