心力衰竭家兔心室动作电位时程整复性变化对室性心律失常的影响
陈世健, 魏妮娜, 李 艳
(湖北民族学院附属民大医院心内科,湖北 恩施 445000)
心力衰竭家兔心室动作电位时程整复性变化对室性心律失常的影响
陈世健△, 魏妮娜, 李 艳
(湖北民族学院附属民大医院心内科,湖北 恩施 445000)
目的探讨压力负荷诱导的兔慢性心力衰竭(CHF)模型离体心室动作电位时程整复性(APDR)变化对室性心律失常(VA)的影响。方法雄性新西兰大耳兔20只,随机分为对照(CTL)组和CHF组,每组10只。CHF模型制备采用经腹主动脉缩窄术,造模结束4周后行心脏超声检查评价造模结果。在整体心脏Langendorff灌流条件下行离体电生理研究,分别记录和测量心室不同位点的单相动作电位(MAP)及有效不应期(ERP),并绘制APDR曲线;对2组心脏进行快速电刺激,观察室性心律失常(VA)的诱发。结果与CTL组相比,CHF组心室相同部位90%单相动作电位时程(MAPD90)、ERP及APDR曲线最大斜率(Smax)均明显增大(均P<0.01),且VA更容易诱发(均P<0.05);此外,CHF组动物APDR曲线Smax的变异系数(COV-Smax)均较CTL组增大(均P<0.05)。结论CHF时心室APDR曲线Smax及COV-Smax均增大,促进室性心律失常的发生。
慢性心力衰竭; 动作电位时程; 整复性; 室性心律失常
慢性心力衰竭(chronic heart failure, CHF)是多种心脏器质性疾病发生发展的终末阶段,包括了心脏结构重构及电重构,后者又可导致恶性室性心律失常的发生,进而增加患者心源性猝死的发生率。因此,探讨CHF时室性心律失常(ventricular arrhythmia,VA)发生机制对于改善CHF患者预后具有重大意义。近年来动作电位时程整复性(action potential duration restitution, APDR)这一动态变化因素被提出,并认为其与VA发生及维持密切相关[1-2]。本实验应用压力负荷诱导的CHF模型,在整体心脏Langendorff灌流条件下,运用相关电生理技术探讨CHF时APDR变化对VA的影响。
材 料 和 方 法
1动物模型制备与分组
实验用新西兰大耳兔20只,均为雄性,体重2.0~3.0 kg,由武汉大学医学部实验动物中心提供。将动物随机分为2组:对照组(control, CTL组,n=10)和慢性心力衰竭组(CHF组,n=10)。CHF组动物经耳缘静脉注射异丙肾上腺素(Sigma)(300 μg·kg-1·d-1),CTL组动物经3%戊巴比妥钠溶液麻醉后,采用腹主动脉缩窄术制作心脏压力负荷模型,对照组开腹不接扎。术后14 d,自由进食给水[3-4]。
2心脏超声检查
完成制备CHF模型4周后,对所有动物行超声心动图检查。通过M型超声获得舒张期室间隔厚度(interventricular septal thickness in diastole,IVSd)及左室后壁厚度(left ventricular posterior wall thickness in diastole, LVPWd);在心尖四腔心切面测量左室舒张末期内径(left ventricular end-diastolic diameter, LVEDD)及左室收缩末期内径(left ventricular end-systolic diameter,LVESD);根据改良的Simpon公式计算出左室射血分数(left ventricular ejection fraction,LVEF)及左室短轴缩短率(left ventricular fractional shortening, LVFS)。
3离体电生理研究
以3%戊巴比妥钠溶液(北京化学试剂公司;30 mg/kg)行耳缘静脉注射全身麻醉,随后继续经耳缘静脉注射肝素钠2 000 U抗凝,10 min后迅速开胸取出心脏,置于100%氧饱和的4 ℃生理盐水中剪去心包以及周围结缔组织,洗净残血,连接于Langendorff心脏灌流装置经主动脉逆行灌流Tyrode’s液,灌流速度20~25 mL/min。
3.1记录各部位单相动作电位(monophasic action potential, MAP)和有效不应期(effective refractory period, ERP) 将刺激电极置于右室基底部心外膜行基础周长为300 ms的S1S1刺激(脉宽2 ms、刺激强度为舒张期起搏阈值的2倍),分别记录左室前壁基底部(left anterior basal, LAB)、左室前壁心尖部(left anterior apex, LAA)、左室后壁基底部(left posterior basal, LPB)和左室后壁心尖部(left posterior apex, LPA)4个部位的MAP。并在连续发放8个起搏刺激波S1后发放早搏刺激波S2(S1S1=300 ms,S1S2=280 ms,刺激强度为舒张期起搏阈值的2倍),以10 ms反扫,记录ERP。
3.2构建APDR曲线 测量不同S1S2间期程序化刺激过程中S2诱发动作电位的MAPD90及每个S2刺激前的舒张间期(diastolic interval, DI; S2前一个S1诱发的动作电位终点到S2诱发的动作电位起点的时间间隔)。应用Origin 6.0软件以DI为横坐标、S2的MAPD90为纵坐标,代入sigmoid函数公式:MAPD90=y0+A1(1-e-DI/T1)进行APDR曲线构建;计算APDR曲线最大曲线斜率(Smax):将sigmoid函数求得的A1、T1及最小DI值代入曲线斜率公式:slope=(A1/T1)*[Exp(-DI/T1)]得出APDR曲线Smax。APDR曲线Smax的变异系数(coefficient of variation of Smax,COV-Smax)定义为6个标测部位Smax标准差与均数的比值,用以评价APDR在整个心室分布的不均一性。
3.3VA的诱发 Burst刺激诱发:将刺激电极分别置于右室基底部(right basal, RB)、右室心尖部(right apex,RA)、左室基底部(left basal, LB)和左室心尖部(left apex, LA),给予50 Hz持续时间2 s的Train刺激进行VA的诱发,各个部位总刺激时间小于3 min。VA持续时间超过2 s即记为VA可诱发,超过30 s即记为持续性VA[6]。
4统计学处理
计量资料用均数±标准差(mean±SD)表示,组间比较采用两样本均数比较的t检验,以P<0.05为差异有统计学意义。应用SPSS 18.0软件处理。
结 果
1造模结束4周后2组动物心脏超声结果
与CTL组相比,CHF组动物LVEF和LVFS明显降低(均P<0.01),IVSd和LVPWd减小(均P<0.05),LVEDD和LVESD明显增大(均P<0.01),表明CHF模型制备成功,见表1。

表1 2组家兔心脏超声检查结果
**P<0.01vscontrol (CTL).
22组动物各部位ERR和MAPD90结果
与CTL组相比,CHF组动物心室相同部位EPR和MAPD90均增大(均P<0.05),见表2。

表2 2组家兔心室有效不应期和90%单相动作电位时程的变化
RB:right basal; RA: right apex; LB: left basal; LA: left apex.**P<0.01vscontrol (CTL).
32组动物各部位APDR结果
与CTL组相比,CHF组动物心室相同部位APDR曲线Smax及整个左室COV-Smax(0.38±0.05vs0.26±0.03)均增大(均P<0.01),见表3。
表32组APDR曲线最大斜率的变化
Table 3. The maximal slope of APDR curves between CTL and CHF groups (Mean±SD.n=10)

ItemCTLCHFRB0.7±0.11.5±0.2##RA0.8±0.21.4±0.1##LB0.9±0.31.6±0.1##LA0.9±0.11.9±0.2##COV-Smax0.26±0.030.38±0.05##
RB: right basal; RA: right apex; LB: left basal; LA: left apex.##P<0.01vsCTL.
4室性快速心律失常诱发率
在Burst刺激诱发下,CHF组动物心室各部位心律失常诱发率明显高于对照组,且还出现了持续性心律失常,其中又以左室心尖部最为多见,见表4。
表42组家兔室性心律失常诱发率的变化
Table 4. The induction rate of ventricular arrhythmia between CTL and CHF groups (n=10)
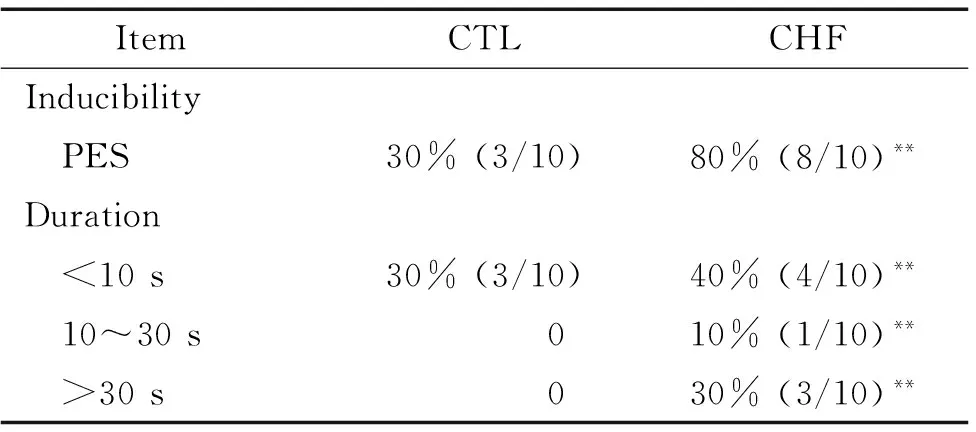
ItemCTLCHFInducibility PES30%(3/10)80%(8/10)**Duration <10s30%(3/10)40%(4/10)** 10~30s010%(1/10)** >30s030%(3/10)**
PES: programmed electrical stimulation.**P<0.01vsCTL.
讨 论
在心衰发展中,伴随着心肌组织学上肥厚性重构变化,心肌细胞的电生理特性亦发生重构性改变,主要表现为复极化过程延迟而致动作电位时程(action potential duration,APD)延长,体表心电图上相应改变为 QT 间期延长[3-4]。至今,对心衰时 APD 延长如何诱发心律失常产生的机制仍了解不多,故揭示疾病过程中电生理重构与心律失常发生的关系是当今心血管领域研究的热点课题。本研究也发现CHF组动物心室各部位MAPD90及ERP均较对照组相同部位明显延长,并且多位点均呈现相同的变化趋势。同时观察到CHF组各标测部位APD整复性曲线斜率均较对照组相同部位明显增大。既往研究表明APDR曲线Smax与心肌细胞电稳定性有关:即当Smax>1时,DI轻微变化即可引起APD和ERP的较大波动,这种波动可以增加相邻部位APD复极的功能性差异有利于折返的形成,心脏就容易发生VA;而当Smax<1时,APD和ERP的波动消失,心脏则不易发生VA。Smax仅能局限地反映心脏单个标测部位的APDR,而心室不同部位心肌细胞的APDR却存在区域性差异[5-6],且APDR的这种区域性差异增大对VA发生具有重要作用,由此可见仅仅依靠Smax是否大于1来解释VA的发生和维持是不够的。因此,我们也对心室不同部位的COV-Smax进行了比较,并发现CHF组COV-Smax显著大于对照组。这也进一步解释了CHF组心律失常发生率增加的原因。
[1] Qin M, Liu T, Hu H, et al. Effect of isoprenaline chronic stimulation on APD restitution and ventricular arrhythmogenesis[J]. J Cardiol,2013,61(2):162-168.
[2] Qin M, Huang H, Wang T, et al. Absence of Rgs5 prolongs cardiac repolarization and predisposes to ventricular tachyarrhythmia in mice[J]. J Mol Cell Cardiol,2012,53(6):880-890.
[3] 李 兵,陈香健,朱舒舒,等.培哚普利对慢性心力衰竭大鼠心肌能量代谢及超微结构的影响[J].中华急诊医学杂志,2011,20(9):955-959.
[4] 刘 韬,秦 牧,黄从新,等. 激活蛋白激酶C对离体兔心室电整复性及室性心律失常的影响[J].中华心血管病杂志2012,40(9):780-785.
[5] Weiss JN, Qu Z, Chen PS, et a1.The dynamics of cardiac fibrillation[J].Circulation, 2005, 112(8): 1232-1240.
[6] 秦 牧,刘 韬, 于胜波, 等. 蛋白激酶C的空间不均一性分布与室性心律失常发生的关系[J]. 中华心律失常学杂志,2013,17(3):219-223.
Effectsofactionpotentialdurationrestitutiononventriculararrhythmiainchronicheartfailurerabbithearts
CHEN Shi-jian, WEI Ni-na, LI Yan
(DepartmentofCardiovascularMedicine,MinDaHospitalAffiliatedtoHubeiUniversityforNationalities,Enshi445000,China.E-mail:chenshijianyun@163.com)
AIM: To determine the effects of action potential duration restitution (APDR) on ventricular arrhythmia (VA) in Langendorff-perfused chronic heart failure (CHF) rabbit hearts.METHODSTwenty male New Zea-land rabbits were equally divided into 2 groups randomly: control (CTL) group and CHF group. CHF was induced by abdominal aortic banding for 14 d. The echocardiography was applied to assess the cardiac function and structural change in both groups 4 weeks after the end of modeling. In the whole Langendorff-perfused hearts, the monophasic action potential (MAP) and the effective refractory period (ERP) were recorded and measured in ventricular chamber, and the action potential duration (APD) curves were also constructed in both groups. The burst pacing was used to induce APD alternans and VA.RESULTSCompared with the same sites of CTL group, the 90% of MAP duration (MAPD90), the ERP, the maximal slope (Smax) of APDR curves were increased in CHF group (allP<0.05). The VAs in CHF group were easier to be induced than those in CTL group (allP<0.05). The coefficients of variation of Smax(COV-Smax) of APDR curves in CHF group were greater than those in CTL group (allP<0.05).CONCLUSIONBoth Smaxand COV-Smaxof APDR curves increase during CHF to facilitate the ventricular arrhythmia.
Chronic heart failure; Action potential duration; Restitution; Ventricular arrhythmia
R363
A
10.3969/j.issn.1000- 4718.2013.11.033
1000- 4718(2013)11- 2097- 03
2013- 06- 15
2013- 09- 04
△通讯作者 Tel: 0718-8301386; E-mail: chenshijianyun@163.com

