上调c-myc基因的表达对U937白血病细胞的影响
潘晓娜, 方志刚, 龙梓洁, 陈家杰, 刘玲玲, 范蕊芳, 林东军
(中山大学附属第三医院血液科,中山大学血液病研究所,广东 广州 510630)
上调c-myc基因的表达对U937白血病细胞的影响
潘晓娜▲, 方志刚▲, 龙梓洁, 陈家杰, 刘玲玲, 范蕊芳, 林东军△
(中山大学附属第三医院血液科,中山大学血液病研究所,广东 广州 510630)
目的构建稳定表达外源c-myc基因的人单核细胞白血病细胞株U937,并初步分析其特性。方法首先构建重组质粒MSCV-c-myc-IRES-GFP (MMIG)载体,分别用MMIG及空载体MSCV-IRES-GFP(MIG)包装病毒,并感染U937细胞,用流式细胞术分选绿色荧光细胞,获得 U937/GFP和U937/MYC细胞,用荧光显微镜及流式细胞术检测GFP阳性率,用Western blotting测定细胞中c-Myc、survivin、X连锁凋亡抑制蛋白(XIAP)和Bcl-2的蛋白表达水平,流式细胞术检测U937/GFP和U937/MYC细胞周期,并用MTT法测定U937/GFP和U937/MYC细胞的生长情况,克隆形成实验检测克隆形成能力。结果荧光显微镜观察,MIG和MMIG病毒感染后,2种细胞均表达绿色荧光蛋白;流式细胞术结果显示,MIG病毒感染的细胞荧光率为26.0%,MMIG病毒感染的细胞荧光率为27.7%;Western blotting的结果显示,c-Myc蛋白在MMIG病毒感染的细胞中表达水平升高。流式细胞术分选后,荧光显微镜观察可见绿色荧光蛋白表达明显增多,U937/GFP和U937/MYC细胞绿色荧光蛋白表达率分别达98.7%和93.7%。 U937/MYC细胞中c-Myc蛋白表达较U937/GFP细胞显著升高,c-Myc蛋白下游的survivin表达增多,而凋亡相关蛋白XIAP及Bcl-2的表达则没有明显变化。细胞周期检测显示,U937/MYC细胞处于S期的细胞数增多。MTT实验结果显示,U937/MYC细胞的生长速率较U937/GFP细胞增快。U937/MYC细胞的克隆形成能力较U937/GFP细胞强。结论成功构建了c-myc基因高表达的U937稳定细胞株U937/MYC。在U937/MYC细胞中,c-Myc及其下游的survivin表达明显上调,处于细胞周期S期的细胞数增多、细胞生长加快、克隆形成能力增强,提示c-Myc可能通过增强自我更新能力、加快细胞周期、促进相关抗凋亡蛋白表达从而提高细胞的存活率。
c-Myc蛋白; 载体构建; U937细胞
髓细胞瘤病癌基因(myelocytomatosis oncogene,myc)是髓细胞增生原癌基因,编码的Myc蛋白结合于其它基因以调控基因的表达。N-myc、L-myc和c-myc是原癌基因myc三大家族成员。N-myc具有一定的组织特异性,主要与神经系统相关,在1/3的神经母细胞瘤病人中有N-Myc高表达[1]。L-Myc的表达和活性均比较低,研究最多的是c-Myc。人类c-myc基因定位于8q24,其编码蛋白质的功能区含有碱性结构域-螺旋-回旋-螺旋-亮氨酸拉链结构域(basic helix-loop-helix/leucine zipper motif,bHLHZ),该区域与Max蛋白结合,形成Myc/Max异二聚体。异二聚体与靶基因的E-box DNA(5’-CACGTG-3’)区域结合,发挥转录功能,调节下游基因[2]。c-myc基因的mRNA一般情况下极不稳定,半衰期较短,常在10 min之内发生降解,但在细胞受到刺激时其稳定性常发生改变[3]。
Myc是Wnt、转化生长因子β(transforming growth factor β,TGF-β)、受体酪氨酸激酶(receptor tyrosine kinase,RTK)及T细胞受体(T-cell receptor,TCR)等多条信号通路的交汇点,参与细胞的生长、增殖、肿瘤形成及肿瘤耐药。除此之外,Myc还与Sox2、Oct4和KLF4共同参与成纤维细胞诱导成多能干细胞的过程,是调节细胞干性的关键基因[4]。c-Myc与多种实体瘤密切相关,在乳腺癌、前列腺癌、胃肠癌、黑色素瘤等均发现c-Myc的异常表达,且与肿瘤的分期和预后相关[5]。
在血液系统中,c-Myc参与造血,且在Burkitt 淋巴瘤和多发性骨髓瘤中明显高表达[6]。在急性淋巴细胞白血病(acute lymphocytic leukemia, ALL)中,c-Myc与NOTCH共同参与肿瘤的维持[7]。在急性髓系白血病(acute myelocytic leukemia,AML)中有约1/3的患者c-Myc高表达,且c-Myc的表达水平与初诊时外周血白细胞的数目呈正相关,化疗可降低c-Myc的表达水平[8]。Strassburg等[9]通过对初诊和复发 AML患者c-myc mRNA检测发现,在复发难治患者中c-myc mRNA表达明显高于初诊患者,化疗无效或不缓解的AML患者的c-myc mRNA和蛋白表达呈持续高水平,白血病c-myc基因的表达水平可能是反映白血病细胞恶性程度及判断预后的重要指标之一。因此,针对c-Myc对白血病细胞影响的研究对临床有重要意义。本文旨在构建c-myc稳定高表达的人单核细胞白血病细胞株U937(U937/MYC),研究c-myc基因高表达对AML细胞系特性的影响。
材 料 和 方 法
1主要试剂
细胞培养用的胎牛血清为HyClone产品, RPMI-1640培养基为Gibco产品, Trizol试剂为Ambion产品,DL2000 marker以及构建载体所用的限制性内切酶BglII、NotI和PCR所用的高保真DNA聚合酶均为TaKaRa产品,细胞转染试剂为Invitrogen公司的Lipofectamine 2000。
2重组质粒MSCV-c-myc-IRES-GFP(MMIG)载体的构建
2.1目的基因c-myc的获得 利用从ADDGENE质粒库上购买的FUW-tetO-c-myc质粒(质粒编号为20324)为模板进行PCR扩增反应。PCR扩增所用的引物序列为:上游引物5’-AGCTCTCAGATCTATGCCCCTCAACGTTAGCT-3’,下划线处为BglII 酶切位点;下游引物5’-AAGGAAAAATGCGGCCGCTTAC-GCACAAGAGTTCCGTA-3’,下划线处为NotI酶切位点。PCR反应条件为94 ℃预变性5 min,94 ℃ 30 s,55 ℃ 40 s,72 ℃ 1.5 min,25个循环,72 ℃ 10 min。将PCR产物进行0.8%琼脂糖凝胶电泳,观察结果并将目的条带进行回收。
2.2MMIG载体的连接和酶切鉴定 将 PCR回收产物与MSCV-IRES-GFP(MIG)载体分别用BglⅡ和NotⅠ进行双酶切,纯化回收酶切产物,将c-myc片段与MIG载体用T4 DNA连接酶于16 ℃ 连接过夜,转化感受态大肠杆菌DH5α,在铺有氨苄青霉素琼脂糖平板上进行单个菌落挑取,37 ℃培养过夜,提取重组质粒DNA,用BglⅡ和NotⅠ双酶切鉴定,观察c-myc基因片段是否克隆到MIG载体中。阳性质粒由深圳华大基因研究院进行DNA测序分析。测序正确的重组质粒载体即MMIG。
3细胞培养
人单核细胞白血病细胞株U937用含10%胎牛血清的RPMI-1640培养基于37 ℃、5% CO2条件下常规培养。每隔2~3 d进行传代,取对数生长期细胞进行细胞实验。
4逆转录病毒的包装及对U937细胞的感染
4.1逆转录病毒的包装 转染前将GP2-293包装细胞在60 mm培养皿接种1×106~2×106,生长密度达到80%左右进行转染。用脂质体介导的方法将重组逆转录病毒载体(MIG和MMIG)和pVSV-G载体共转染GP2-293包装细胞。将GP2-293细胞放于5% CO2、37 ℃孵箱培养。转染后48和72 h后分别收集病毒液,0.45 μm滤器过滤后混匀,4 ℃保存。
4.2逆转录病毒对U937细胞的感染 感染前将U937细胞低密度传至培养皿中,加病毒液,同时加入聚凝胺(polyberne)使其终浓度为至8 mg/L。感染4~6 h后去除病毒液,加入新鲜培养基继续培养,感染24~36 h后在倒置荧光显微镜下观察GFP表达情况。GFP阳性表达的细胞继续培养,3 d后利用流式细胞术分析GFP阳性细胞的比率。
5稳定细胞株U937/GFP和U937/MYC的流式分选
将阳性的稳定细胞株用MoFlo XDP细胞分选流式仪(Beckman)进行GFP阳性细胞的分选。MIG病毒感染分选后的U937稳定细胞株命名为U937/GFP,而MMIG病毒感染分选后的U937稳定细胞株命为U937/MYC。
6Westernblotting检测c-Myc及相关蛋白的表达水平
U937/GFP和U937/MYC细胞,用细胞裂解液(20 mmol/L Tris, pH 7.5,150 mmol/L NaCl, 0.25% NP40,2.5 mmol/L sodium pyprophosphate,1 mmol/L EGTA,1 mmol/L EDTA,1 mmol/L β-glycerophosphate,1 mmol/L Na3VO4,1 mmol/L PMSF,1 mg/L leupeptin)提取细胞总蛋白。用考马斯亮蓝法进行蛋白定量后,按40 μg上样,12% SDS-PAGE进行电泳,将蛋白转移至硝酸纤维素膜(10 V,50 min),Ⅰ抗孵育,4 ℃过夜, HRP标记的抗鼠或兔IgG的Ⅱ抗孵育1 h,于暗室中曝光。以GAPDH作为内参照。
7MTT法检测稳定细胞株增殖情况
将U937/GFP和U937/MYC细胞按1×103cells/well培养于96孔板,分别培养1 d、2 d、3 d、4 d、5 d和6 d,检测前每孔加入20 μL MTT溶液,继续孵育4 h,弃上清液,然后每孔加入150 μL DMSO溶解沉淀,于490 nm波长的酶标仪测定吸光度(absorbance,A),1 d吸光度为对照组吸光度,其余为实验组吸光度。细胞存活率(%)=实验组吸光度/对照组吸光度×100%。
8流式细胞术检测细胞周期
收集细胞,1 500 r/min 离心5 min, PBS洗涤2次,后用冰乙醇固定过夜,碘化丙啶(propidium iodide,PI)染色后流式细胞仪测定细胞周期。以上实验重复3次。
9甲基纤维素克隆形成实验
U937/GFP和U937/MYC细胞分别以500 cells/well种于400 μL甲基纤维素中, 37 ℃、5% CO2条件下培养6 d后荧光显微镜下观察克隆。
10统计学处理
用SPSS 13.0统计软件分析,数据用均数±标准差(mean±SD)表示,组间均数比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1MMIG载体的构建
PCR扩增c-myc基因片段,经琼脂糖凝胶电泳显示扩增条带与预期大小相一致,于1 000~2 000 bp处,见图1A。纯化PCR产物与MIG载体均用BglⅡ和NotⅠ双酶切后,电泳显示目的基因片段(图1B泳道4)和MIG载体(图1B泳道5)双酶切后得到线性片段大小与理论值相符。连接产物转化感受态E.coliDH5α,挑3个重组质粒提取质粒DNA进行BglⅡ和NotⅠ双酶切鉴定,电泳分析得有2个阳性的重组质粒,见图1C。将此2个质粒进行DNA测序。测序结果经BLAST分析, 证实该重组质粒插入的序列与GenBank的人类c-myc基因(基因登录号:V00568.1)的开放读码框序列同源性为100%。
2c-myc高表达的U937细胞株的感染情况分析
将质粒MIG和MMIG分别进行病毒包装,感染U937细胞株。荧光显微镜观察两种病毒感染的U937细胞均有GFP表达,见图2A。经流式细胞术分析得出MIG病毒感染的U937细胞GFP阳性率为26.0%,MMIG为27.7%,见图2B。Western blotting结果显示,MMIG病毒感染的U937细胞中c-Myc蛋白表达水平有上调现象,见图2C。
3c-myc高表达的U937稳定细胞株U937/MYC的建立与验证
用Beckman MoFlo XDP细胞分选流式仪分选得到稳定细胞株U937/GFP和U937/MYC。荧光显微镜观察,相同放大倍数视野内绿色荧光细胞较分选前明显增多,见图3A。流式细胞术检测U937/GFP细胞中的GFP阳性细胞的比率是98.7%,U937/MYC细胞中GFP阳性细胞的比率为93.7%,见图3B。Western blotting进一步证实,c-Myc蛋白表达比分选前增多,见图3C,说明成功地得到c-myc高表达的U937稳定细胞株U937/MYC。
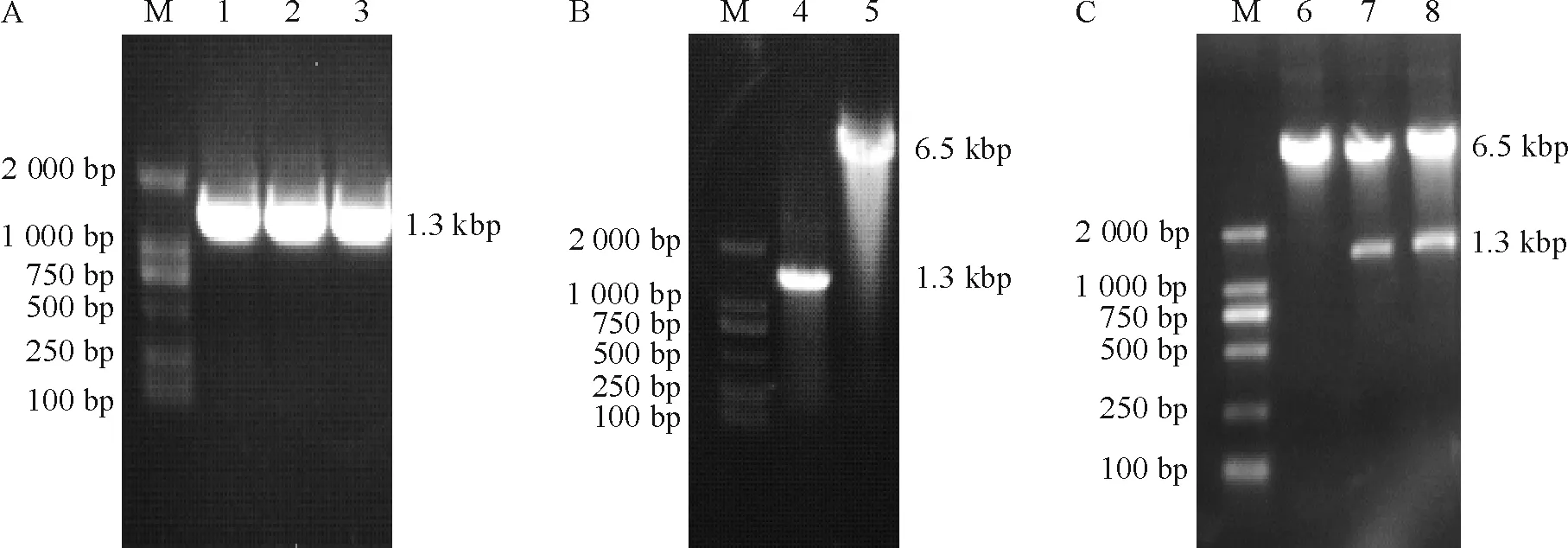
Figure 1. Electrophoresis of MSCV-c-myc-IRES-GFP recombinant. A: PCR amplification of FUW-tetO-c-myc plasmid; B, C:BglII andNotI digestion. M: DL2000 DNA marker; 1~3:c-mycPCR product; 4:c-mycPCR product digested byBglII andNotI, generating ac-mycDNA; 5: MIG vector digested byBglII andNotI, generating a linear plasmid; 6~8: three recombinants digested byBglII andNotI. Two positive clones were obtained (7 and 8).
图1构建MSCV-c-myc-IRES-GFP重组载体电泳图
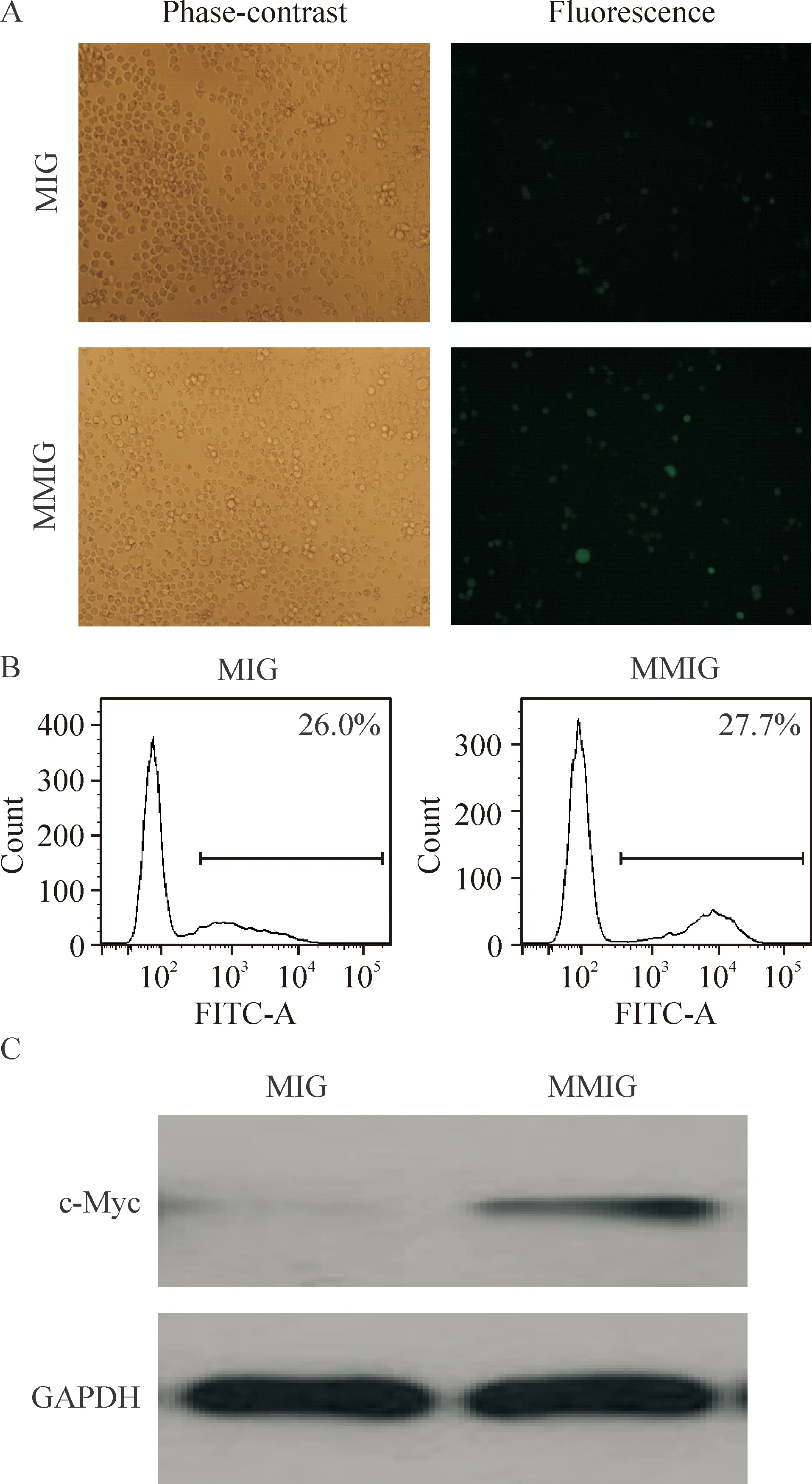
Figure 2. Analysis of c-Myc expression after virus infection in U937 cells. A: images of U937 cells infected with MIG or MMIG under phase-contrast microscope and fluorescence microscope (×200); B: GFP positive rates in U937 cells infected with MIG or MMIG analyzed by flow cytometry; C: the expression of c-Myc in U937 cells infected with MIG or MMIG detected by Western blotting.
图2MIG和MMIG病毒感染后U937细胞中c-Myc的表达分析

Figure 3. Characteristics of U937/MYC and U937/GFP cells after fluorescence-activated cell sorting. A: images of U937/MYC cells under phase-contrast microscope and fluorescence microscope (×200); B: GFP positive rates of U937/GFP and U937/MYC cells determined by flow cytometry; C: the expression of c-Myc in U937/GFP and U937/MYC cells analyzed by Western blotting.
图3U937/MYC和U937/GFP细胞中c-Myc的表达分析
4稳定细胞株U937/MYC相关蛋白的表达情况
Western blotting结果显示,c-Myc下游的survivin在U937/MYC细胞中较U937/GFP细胞明显上调,而其它凋亡相关蛋白X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)及Bcl-2无明显改变,见图4。
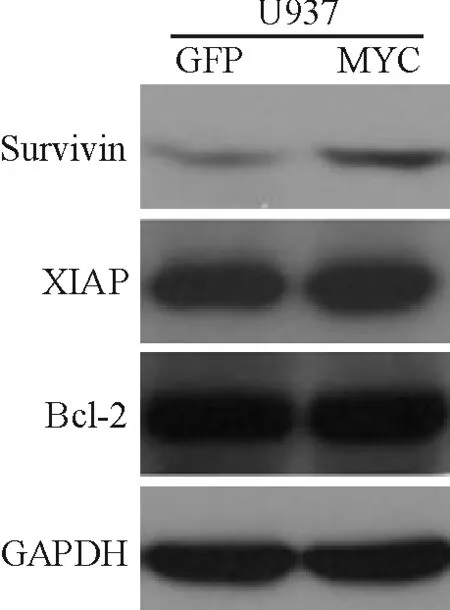
Figure 4. The protein expression of survivin, XIAP and Bcl-2 detected by Western blotting.
图4U937/MYC和U937/GFP细胞中survivin、XIAP及Bcl-2蛋白表达分析
5U937/MYC和U937/GFP细胞株细胞周期及生长情况
用流式细胞术检测U937/MYC和U937/GFP细胞周期,显示U937/MYC细胞处于S期的细胞数较U937/GFP细胞多,见图5A。将两细胞株以1×103cells/well接种于96孔板,MTT检测培养1 d、2 d、3 d、4 d、5 d和6 d细胞的生长情况,结果显示,U937/MYC细胞在培养3 d、4 d、5 d和6 d时生长较U937/GFP细胞快(P<0.05),见图5B。克隆形成实验结果显示,U937/MYC细胞的克隆形成能力较U937/GFP细胞强,见图5C。
讨 论
近年来,逆转录病毒表达载体系统在研究基因的下游靶点和功能中得到广泛应用。MoMLV(Moloney murine leukemia virus)和MSCV(murine stem cell virus)是目前常用的逆转录病毒载体,用于干细胞或前体细胞,特别是血液细胞的感染。MoMLV载体广泛用于悬浮真核细胞基因转染,但在未分化的胚胎干细胞中常因启动子甲基化、增强子缺乏和负调控因子增多而导致沉默,降低转录活性[10]。而基于MoMLV载体改造的MSCV在原先的长末端重复(long terminal repeat,LTR)基础上发生点突变和缺失,使其在造血干细胞和胚胎干细胞的表达率提高,安全性更高。文献报道MSCV在白细胞中的感染率也达到1.6%~47.5%[11]。MSCV载体因其在造血干/祖细胞中对外源基因的转染和表达具有明显优势而得到广泛应用。
Figure 5. Cell cycle and growth analysis of U937/GFP and U937/MYC cells. A: cell cycle distribution determined by PI staining; B: cell viability measured by MTT assay; C: clone-forming images under phase-contrast microscope and fluorescence microscope (×200). Mean±SD.n=5.*P<0.05vsU937/GFP.
图5U937/MYC和U937/GFP细胞株细胞周期及生长情况分析
U937细胞系来源于组织细胞性淋巴瘤的病人,最早由Dr. K. Nilsson实验室于1974年建立,在多种因子诱导下具有向单核细胞分化的恶性幼稚细胞[12-13]。本文采用MSCV载体介导c-myc基因在U937细胞系高表达,结果表明,MSCV-c-myc-IRES-GFP对U937细胞的感染率达到27.7%,感染率较高。
为了进一步验证经流式分选获得的U937/MYC细胞能稳定高表达c-myc,我们利用Western blotting方法观察细胞内c-Myc下游的蛋白表达水平。与c-Myc相关的下游基因高达600多种,研究表明其中经典的有survivin和多种microRNA[14]。本实验结果显示,U937/MYC细胞中survivin明显高表达,而该细胞中其它凋亡相关蛋白XAIP及Bcl-2表达水平无明显改变。
c-myc基因的表达能影响细胞周期的变化。Link等[15]报道,c-Myc的靶基因可调节细胞由G1期向S期转变。Polioudakis等[16]也证实,促有丝分裂物质可以通过上调c-Myc促进miR-22的转录,从而使静止的细胞进入细胞周期,促进分裂增殖。本实验中细胞周期分析显示U937/MYC细胞处于S期的比例(60.03%)比U937/GFP细胞(40.26%)多,说明细胞的增殖速度加快,与之前的研究结果一致。克隆形成实验结果表明,U937/MYC细胞的自我更行能力也增强。此外,细胞生长曲线显示,U937/MYC细胞在第3天、第4天、第5天和第6天的细胞存活率均比U937/GFP细胞高。因此,高表达c-myc的U937细胞可能通过上调c-myc基因的表达来加速细胞周期,增强自我更新能力,提高细胞的生长速度,同时通过增加抗凋亡蛋白survivin的表达提高细胞的存活率。
本实验成功地构建了c-myc基因高表达的U937稳定细胞株U937/MYC,并初步分析了c-Myc对该白血病细胞株特性的影响。该细胞可以作为较好的细胞模型进一步用于研究c-myc基因在白血病发生发展中的机制,并为治疗白血病药物的筛选提供基础。
[1] Seeger RC, Brodeur GM, Sather H, et al. Association of multiple copies of the N-myconcogene with rapid progression of neuroblastomas[J]. N Engl J Med, 1985,313(18):1111-1116.
[2] Gomez-Curet I, Perkins RS, Bennett R, et al. c-Myc inhibition negatively impacts lymphoma growth[J]. J Pediatr Surg,2006,41(1):207-211.
[3] Malempati S, Tibbitts D, Cunningham M, et al. Aberrant stabilization of c-Myc protein in some lymphoblastic leukemias[J]. Leukemia, 2006, 20(9):1572-1581.
[4] Dang CV. MYC on the path to cancer[J]. Cell, 2012,149(1):22-35.
[5] Nesbit CE, Tersak JM, Prochownik EV. MYC oncogenes and human neoplastic disease[J]. Oncogene, 1999,18(19):3004-3016.
[6] 林媛媛,杨文萍.c-myc基因与血液细胞生成及白血病研究现状[J].实验与检验医学, 2012, 30(3):247-251.
[7] Demarest RM, Dahmane N, Capobianco AJ. Notch is oncogenic dominant in T-cell acute lymphoblastic leukemia[J]. Blood, 2011,117(10):2901-2909.
[8] 陈 琰,肖若芝,王立琳,等.U0126增强索拉非尼对K562细胞增殖抑制、凋亡及诱导分化作用[J].中国病理生理杂志,2011,27(5):859-864.
[9] Strassburg CP, Neubauer V, Poliwoda H, et al. Regulation of the proto-oncogenesc-sis,c-fos,c-mycandc-mybin acute myeloid leukemias[J]. Neoplasma, 1992, 39(6):343-347.
[10] Feuer G, Taketo M, Hanecak RC, et al. Two blocks in Moloney murine leukemia virus expression in undifferentiated F9 embryonal carcinoma cells as determined by transient expression assays[J]. J Virol, 1989, 63(5):2317-2324.
[11] Oue M, Handa H, Matsuzaki Y, et al. The murine stem cell virus promoter drives correlated transgene expression in the leukocytes and cerebellar purkinje cells of transgenic mice[J]. PLoS ONE, 2012, 7(11):e51015.
[12] Ralph P, Moore MA, Nilsson K. Lysozyme synthesis by established human and murine histiocytic lymphoma cell lines[J]. J Exp Med, 1976,143(6):1528-1533.
[13] Olsson I, Gullberg U, Ivhed I, et al. Induction of diffe-rentiation of the human histiocytic lymphoma cell line U-937 by 1alpha,25-dihydroxycholecalciferol[J]. Cancer Res, 1983, 43(12 Pt 1):5862-5867.
[14] Papanikolaou V, Iliopoulos D, Dimou I, et al. Survivin regulation by HER2 through NF-kappaB and c-myc in irradiated breast cancer cells[J]. J Cell Mol Med, 2011, 15(7):1542-1550.
[15] Link JM, Hurlin PJ. MYC needs MNT[J]. Cell Cycle, 2013, 12(3):385-386.
[16] Polioudakis D, Bhinge AA, Killion PJ, et al. A Myc-microRNA network promotes exit from quiescence by suppressing the interferon response and cell-cycle arrest genes[J]. Nucleic Acids Res, 2013,41(4):2239-2254.
Effectsofup-regulationofc-mycexpressiononU937cellline
PAN Xiao-na, FANG Zhi-gang, LONG Zi-jie, CHEN Jia-jie, LIU Ling-ling, FAN Rui-fang, LIN Dong-jun
(DepartmentofHematology,theThirdAffiliatedHospital,SunYat-senUniversity,SunYat-senInstituteofHematology,Guangzhou510630,China.E-mail:lindongjun0168@163.com)
AIM: To establish a human monocytic leukemia cell line U937 stably expressingc-mycgene and to investigate the biological characteristics of this cell line.METHODSThe recombinant plasmid MSCV-c-myc-IRES-GFP (MMIG) was constructed. MMIG and MSCV-IRES-GFP (MIG) were used to package the viruses for infecting U937 cells. Fluorescence-activated cell sorter (FACS) was used for sorting U937/GFP and U937/MYC cells. The GFP-positive cells were detected by fluorescence microscopy and FACS. The protein expression of c-Myc, survivin, X-linked inhibitor of apoptosis protein (XIAP) and Bcl-2 was detected by Western blotting. Cell proliferation was evaluated by MTT assay. Propidium iodide (PI) staining was used to determine the cell cycle distribution. Self-renewal ability was observed by colony- forming assay.RESULTSThe GFP expression in the cells infected with MIG or MMIG virus was observed under fluorescence microscope. The green fluorescent rate of the cells infected with MIG was 26.0%, while that of the cells infected with MMIG was 27.7%. The protein expression of c-Myc in MMIG-infected U937 cells was higher than that in MIG-infected cells. After sorting, the green fluorescent rates of U937/GFP and U937/MYC cells reached 98.7% and 93.7%, respectively. The protein expression of c-Myc in U937/MYC cells was higher than that in U937/GFP cells. In addition, survivin, a downstream protein of c-Myc, was up-regulated, while the protein expression of XIAP and Bcl-2 remained unchanged. Cell cycle analysis showed that the percentage of the cells in S phase increased in U937/MYC cells. Moreover, the proliferation and colony-forming ability of U937/MYC cells were also enhanced.CONCLUSIONU937/MYC cell line stably expressingc-mycgene was successfully established. c-Myc may increase cell viability via enhancing the expression of anti-apoptotic protein survivin, the cell cycle transition and the self-renewal ability.
c-Myc protein; Vector construction; U937 cells
R733.7
A
10.3969/j.issn.1000- 4718.2013.11.012
1000- 4718(2013)11- 1984- 06
2013- 02- 19
2013- 08- 22
△通讯作者 Tel: 020-85252227; E-mail: lindongjun0168@ 163.com
▲并列第1作者

