SCD-1在宫颈癌中的表达及其表达下调对宫颈癌细胞增殖和凋亡的影响*
杨 君, 张彩凤, 秦瑞英, 任艳芳, 王慧玲, 华方方
(新乡医学院第一附属医院 1妇产科, 2消化科,河南 新乡 453100)
SCD-1在宫颈癌中的表达及其表达下调对宫颈癌细胞增殖和凋亡的影响*
杨 君1△, 张彩凤2, 秦瑞英1, 任艳芳1, 王慧玲1, 华方方1
(新乡医学院第一附属医院1妇产科,2消化科,河南 新乡 453100)
目的检测正常宫颈组织、宫颈鳞癌组织以及宫颈癌细胞株HeLa、SiHa和CaSki中酰基辅酶A去饱和酶1(stearoyl-CoA desaturase-1,SCD-1)蛋白的表达,分析SCD-1表达下调对宫颈癌细胞增殖和凋亡的影响。方法采用Western blotting检测正常宫颈组织、宫颈鳞癌组织以及宫颈癌细胞株HeLa、SiHa和CaSki中SCD-1蛋白的表达。利用脂质体2000将SCD-1 siRNA和对照siRNA转染CaSki细胞,采用Western blotting检测转染SCD-1 siRNA后CaSki细胞中SCD-1蛋白的表达。进一步利用CCK-8试剂和流式细胞术检测转染后CaSki细胞增殖和细胞凋亡的变化,并利用Caspase-Glo®3/7和9检测试剂盒检测转染后caspase-3和caspase-9活性的变化,采用Western blotting检测Bcl-2和Bax蛋白的表达。结果宫颈鳞癌组织中SCD-1蛋白的表达显著高于其对应的正常宫颈组织(P<0.05),而3株宫颈癌细胞中SCD-1蛋白表达也显著高于正常宫颈组织,其中CaSki细胞中SCD-1蛋白表达最高(P<0.05)。此外,SCD-1 siRNA组中CaSki细胞中SCD-1蛋白的表达显著低于未处理组和对照siRNA组,差异有统计学意义(P<0.05)。与未处理组和对照siRNA组相比,SCD-1 siRNA组中CaSki细胞的增殖显著受到抑制(P<0.05)。SCD-1 siRNA组中CaSki细胞的早期凋亡率显著高于未处理组和对照siRNA组(P<0.05)。进一步发现SCD-1 siRNA转染后caspase-3、caspase-9活性和Bax蛋白表达显著上升,而Bcl-2蛋白表达显著下调(P<0.05)。结论SCD-1可能在宫颈癌发生发展中发挥重要作用,其表达下调介导的细胞增殖抑制和细胞凋亡可能与caspase-3、caspase-9活性以及Bcl-2和Bax表达变化密切相关。
酰基辅酶A去饱和酶1; 宫颈肿瘤; 细胞增殖; 细胞凋亡
肿瘤细胞能够增加糖酵解和脂肪合成从而改变其自身的代谢[1]。持续增殖的肿瘤细胞不仅在脂质从头生物合成中具有量的改变,而且能修饰脂质膜构成发生质的改变进而影响膜的流动性、信号转导和基因表达[2]。从转化细胞的脂质分析表明饱和脂肪酸(saturated fatty acid,SFA)向单不饱和脂肪酸(monounsaturated fatty acid,MUFA)的量逐渐增加[3],酰基辅酶A去饱和酶1(stearoyl-CoA desaturase-1,SCD-1)是Δ9脂肪酸去饱和酶异构体,能将SFA转换为MUFA[4],提示其可能在肿瘤的脂质代谢过程中发挥极其重要的作用。研究显示SCD-1在遗传上易于发生肝癌的鼠模型中过表达,表明SCD-1可能与肿瘤发生密切相关[5]。最近,越来越多的研究显示,SCD-1在多种不同的肿瘤包括食管癌、结肠癌、肝癌以及化学诱导的乳腺肿瘤中均呈现过表达[3, 6-8],但在前列腺癌中呈现低表达[9],提示SCD-1表达水平可能具有肿瘤类型依赖性。最近,SCD-1在RNAi筛选中被鉴定为肿瘤治疗的潜在分子靶点[10]。我们通过文献检索发现,迄今为止,关于SCD-1与宫颈癌发生发展之间的关系尚未见报道。因此在本研究中,我们检测宫颈癌细胞和组织中SCD-1蛋白的表达,研究其表达下调对宫颈癌细胞增殖和凋亡的影响,并分析与细胞凋亡密切相关的caspase-3和caspase-9的活性,检测抑凋亡蛋白Bcl-2和促凋亡蛋白Bax的表达,初步阐明SCD-1在宫颈癌发生发展中可能的作用,为以SCD-1为靶点的宫颈癌分子靶向治疗提供理论依据。
材 料 和 方 法
1材料
宫颈鳞癌组织和正常宫颈组织均通过病理学证实,取自新乡医学院第一附属医院,并经液氮保存备用。宫颈癌细胞株HeLa、SiHa和CaSki购自中国典型培养物保藏中心。DMEM培养液、胰酶和胎牛血清均购自Gibco;凋亡检测试剂盒Annexin V-FITC Kit购自Beckman Coulter;兔抗人SCD-1和β-actin抗体、鼠抗人Bcl-2和Bax抗体、SCD-1 siRNA和对照siRNA均购自Santa Cruz;细胞裂解液购自宝生物工程(大连)有限公司;Caspase-Glo®3/7和9试剂盒购自Promega。
2细胞培养、转染及实验分组
HeLa、SiHa和CaSki细胞复苏后置于含10 %胎牛血清的DMEM培养液中培养,当细胞传代到状态稳定后,采用Western blotting法检测随机选取的2例正常宫颈组织、2例宫颈鳞癌组织和3株宫颈癌细胞中SCD-1蛋白的表达。将上述SCD-1表达量最高的CaSki细胞培养至细胞融合度为90%左右时,将SCD-1 siRNA和对照siRNA采用脂质体介导法转染至CaSki细胞,转染后将细胞分为3组进行相关实验:未处理组(不作任何处理)、对照siRNA组(利用对照siRNA转染)和SCD-1 siRNA组(采用SCD-1 siRNA转染)。
3细胞增殖分析
分别收集转染后24 h、48 h、72 h及96 h的3组宫颈癌CaSki细胞,并将每孔2 000个细胞接种于96孔板,每个时点设置5个复孔,当测定生长速率时,加入含10% CCK-8的等量新鲜培养基于37 ℃继续培养2 h,最后采用酶标仪测定450 nm的吸光度。
4流式细胞术检测宫颈癌CaSki细胞凋亡
收集转染后48 h的3组宫颈癌CaSki细胞,于预冷PBS中洗涤。每组1×109/L的细胞重悬,取100 μL细胞置于试管中,加入Annexin V-FITC和碘化丙啶(propidium iodide,PI)各5 μL,避光孵育15 min后,采用流式细胞术检测1×104个细胞,并利用CellQuest软件分析结果。
5Caspase-3和caspase-9的活性分析
采用caspase-Glo®3/7和9检测试剂盒分析3组宫颈癌CaSki细胞中caspase-3和caspase-9的活性。SCD-1 siRNA和对照siRNA转染后于48 h收获3组宫颈癌CaSki细胞,分别置于缓冲液(25 mmol/L HEPES,pH 7.5,5 mmol/L MgCl2,1 mmol/L EGTA,1 mmol/L Pefabloc®丝氨酸蛋白酶抑制剂,胃酶抑素、亮肽素和抑肽酶各1 mg/L)中充分悬浮后,于4 ℃、13 000 r/min离心15 min,澄清提取液。将澄清的提取液中的蛋白浓度预先调整为1 g/L,于-80 ℃下冻存。为了测定caspase活性,将稀释后的提取液(10 mg/L)与caspase-Glo®检测试剂等体积混合,置于96孔白壁培养板中,室温孵育1 h,然后采用发光检测仪获取数据。
6Westernblotting检测
Western blotting采用吴裕丹等[11]报道的方法。收集转染后48 h的3组宫颈癌CaSki细胞,利用细胞裂解液提取总蛋白,并采用Bradford法测定各组蛋白浓度。将50 μg总蛋白在上样缓冲液中煮5~10 min,采用10% SDS-PAGE进行蛋白分离,接着将凝胶上的蛋白转移至硝酸纤维素(nitrocellulose,NC)膜上。将NC膜用含5%脱脂奶粉的TBST于室温封闭2 h,分别加Ⅰ抗(SCD-1、Bcl-2、Bax和β-actin;按1∶200稀释)于含5%脱脂奶粉的TBST中4 ℃过夜孵育,接着用TBST洗膜3次,每次5 min,洗膜结束后加Ⅱ抗室温孵育2 h,然后曝光成像。最后用Gene Tools软件分析蛋白相对表达量(目的蛋白表达量与内参照β-actin表达量的比值)。
7统计学处理
采用统计学软件SPSS 13.0分析,数据以均数±标准差(mean±SD)表示,3组之间比较采用单因素方差分析(One-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1SCD-1在宫颈癌组织和细胞中的表达
用Western blotting方法检测宫颈不同组织和细胞中SCD-1蛋白的表达,结果表明,2例宫颈鳞癌组织中SCD-1蛋白表达均显著高于2例正常宫颈组织,差异有统计学意义(P<0.05);与正常宫颈组织相比,3株宫颈癌细胞系中SCD-1蛋白表达均显著上调(P<0.05);在所有检测的组织和细胞中,CaSki细胞中SCD-1蛋白表达显著高于其它各组(P<0.05),见图1。因此,在后续的研究中我们选用CaSki细胞作为研究对象。
2SCD-1siRNA抑制宫颈癌CaSki细胞中SCD-1蛋白的表达
SCD-1 siRNA组中SCD-1蛋白表达显著低于未处理组和对照siRNA组(P<0.05),而未处理组与对照siRNA组之间的SCD-1蛋白表达无显著差异(P>0.05),见图2。
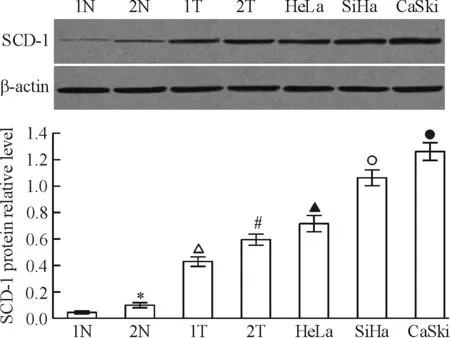
Figure 1. Expression of SCD-1 protein in cervical carcinoma tissues and cells detected by Western blotting.N: normal cervical tissues;T: cervical carcinoma tissues. β-actin was utilized as internal control.Mean±SD.n=3.*P<0.05vs1N;△P<0.05vs1N and 2N;#P<0.05vs1N, 2N and 1T;▲P<0.05vs1N, 2N, 1T and 2T;○P<0.05vs1N, 2N, 1T, 2T and HeLa;●P<0.05vsother groups.
图1SCD-1蛋白在宫颈癌组织和细胞中的表达

Figure 2. Effect of SCD-1 siRNA on the protein expression of SCD-1 in cervical carcinoma CaSki cells.Mean±SD.n=3.*P<0.05vsuntreated group and control siRNA group.
图2SCD-1siRNA对宫颈癌CaSki细胞中SCD-1蛋白表达的影响
3SCD-1表达下调抑制宫颈癌CaSki细胞增殖
收集SCD-1 siRNA和对照siRNA处理后不同时间点的3组宫颈癌CaSki细胞,采用CCK-8检测试剂盒分析不同时间点CaSki细胞增殖的变化,结果表明,与未处理组和对照siRNA组相比,SCD-1 siRNA组中CaSki细胞在转染后的24 h、48 h、72 h和96 h,其细胞增殖均受到明显抑制(P<0.05),而未处理组和对照siRNA组之间CaSki细胞的增殖无显著差异(P>0.05),见图3。

Figure 3. Effect of down-regulation of SCD-1 on the proliferation in cervical carcinoma CaSki cells. Mean±SD.n=3.*P<0.05vsuntreated group and control siRNA group.
图3SCD-1表达下调对宫颈癌CaSki细胞增殖的影响
4SCD-1表达下调诱导宫颈癌CaSki细胞凋亡
SCD-1 siRNA组中CaSki细胞的早期凋亡率(19.32%±0.93%)显著高于未处理组(8.25%±0.35%)和对照siRNA组(8.29%±0.22%),而未处理组和对照siRNA组之间CaSki细胞早期凋亡率无显著差异。此外,SCD-1 siRNA组(66.59%±1.28%)中CaSki细胞的活细胞率显著低于未处理组(87.35%±0.89%)和对照siRNA组(86.87%±0.93%),而未处理组和对照siRNA组之间CaSki细胞的活细胞率无显著差异,见表1。
表1SCD-1表达下调对宫颈癌CaSki细胞凋亡的影响
Table 1. Effect of down-regulation of SCD-1 on the apoptosis of cervical carcinoma CaSki cells(%.Mean±SD.n=3)

GroupEarly-phaseapoptoticratio ViablecellratioUntreated8.25±0.3587.35±0.89ControlsiRNA8.29±0.2286.87±0.93SCD-1siRNA19.32±0.93*66.59±1.28*
*P<0.05vsuntreated group and control siRNA group.
5SCD-1表达下调对宫颈癌CaSki细胞caspase-3和caspase-9活性的影响
收集转染后48 h的3组宫颈癌CaSki细胞,采用Caspase-Glo®3/7和9检测试剂盒分析3组细胞中caspase-3和caspase-9的活性,结果显示,与未处理组和对照siRNA组相比,SCD-1 siRNA组中caspase-3和caspase-9的活性均显著上升(P<0.05),而未处理组和对照siRNA组中caspase-3和caspase-9的活性无显著差异(P>0.05),见图4。

Figure 4. Down-regulation of SCD-1 significantly enhanced the activities of caspase-3 and caspase-9 in cervical carcinoma CaSki cells.Mean±SD.n=3.*P<0.05vsuntreated group and control siRNA group.
图4SCD-1表达下调显著提高宫颈癌CaSki细胞caspase-3和caspase-9的活性
6SCD-1表达下调对宫颈癌CaSki细胞Bcl-2和Bax蛋白表达的影响
SCD-1 siRNA组中Bcl-2蛋白的表达显著低于未处理组和对照siRNA组,而Bax蛋白表达显著高于未处理组和对照siRNA组(P<0.05),而未处理组和对照siRNA组之间Bcl-2和Bax蛋白的表达无显著差异(P>0.05),见图5。
讨 论
对于正常细胞和肿瘤细胞的增殖、死亡和衰老的控制是与代谢的调控密切相关,特别是脂质信号和结构的合成与重建[12]。SCD-1是脂肪酸合成的关键调控基因,与肿瘤的发生发展关系十分密切,并牵涉肿瘤发展的多方面,包括:细胞增殖、细胞周期、凋亡、炎症反应和转化等[12]。Falvella等[5]研究发现SCD-1 mRNA在小鼠和大鼠肝癌中的表达水平分别是正常肝组织的10倍和4倍,提示SCD-1可能与肝癌发生发展关系密切。Mauvoisin等[13]在研究SCD-1在乳腺癌MCF7和MDA-MB-231细胞中的功能时,发现转染SCD-1 siRNA其表达水平显著低于对照组,并且其表达下调能明显抑制β-catenin信号途径,抑制细胞的增殖和降低细胞的侵袭能力,提示SCD-1在乳腺癌中可能扮演癌基因的作用。尽管上述研究支持SCD-1在这些肿瘤中作为癌基因发挥作用,但是Zhang等[14]研究SCD-1在白血病干细胞中的作用时,发现SCD-1在白血病干细胞中表达下调,在白血病干细胞中发挥肿瘤抑制的作用,并对正常造血干细胞无影响,进一步研究发现缺失SCD-1能加速慢性髓细胞样白血病的进展,相反SCD-1过表达延迟慢性髓细胞样白血病的进展,这一研究提示SCD-1在白血病中发挥抑癌基因的作用。SCD-1在宫颈癌中的作用如何?目前尚不清楚,因此在本研究中,我们检测了宫颈鳞癌组织和细胞中SCD-1蛋白的表达,发现SCD-1蛋白在随机选择的2例宫颈鳞癌组织中比其相应的正常宫颈组织显著升高(P<0.05),并且3株宫颈癌细胞HeLa、SiHa和CaSki中SCD-1蛋白的表达也明显高于其它组织中SCD-1蛋白的表达,且CaSki细胞中SCD-1蛋白水平最高(P<0.05),我们这里呈现的结果初步提示SCD-1可能在宫颈癌的发生发展过程中发挥重要作用,但其确切的表达模式尚需进一步探讨。

Figure 5. Effect of down-regulation of SCD-1 on the protein expression of Bcl-2 and Bax in cervical carcinoma CaSki cells.Mean±SD.n=3.*P<0.05vsuntreated group and control siRNA group.
图5SCD-1表达下调对宫颈癌CaSki细胞中Bcl-2和Bax蛋白表达的影响
活化的脂肪生成,尤其是膜脂的合成对于肿瘤细胞的连续增殖起关键的调控作用,是避免肿瘤细胞进行凋亡程序的关键机制[15]。已有的研究结果显示SCD-1能调控肿瘤细胞的增殖和存活,通过siRNA沉默SCD-1能显著降低多种人类肿瘤细胞系的存活[10]。在本研究中,我们首先通过SCD-1 siRNA转染宫颈癌CaSki细胞,结果发现,与未处理组和对照siRNA组相比,SCD-1 siRNA能显著下调宫颈癌CaSki细胞中SCD-1蛋白水平(P<0.05)。进一步我们采用CCK-8试剂分析SCD-1表达下调对宫颈癌CaSki细胞增殖的影响,结果显示,与未处理组和对照siRNA组相比,SCD-1 siRNA组中宫颈癌CaSki细胞的增殖明显受到抑制,这一结果提示SCD-1能调控宫颈癌细胞的增殖,但其确切的分子机制尚待进一步鉴定。
研究表明,抑制SCD-1表达能显著增加肿瘤细胞的凋亡[16],提示肿瘤细胞的存活需要适量的SCD-1水平去维持。在多种不同类型的肿瘤中,抑制SCD-1的表达能够导致细胞凋亡[10]。Minville-Walz等[17]发现,在人骨肉瘤U2OS细胞中抑制SCD-1的表达能诱导高水平的caspase-3活性,从而促进肿瘤细胞凋亡。为了进一步探讨是否抑制宫颈癌细胞中SCD-1的表达能诱导细胞凋亡?在本研究中,我们采用流式细胞术分析SCD-1 siRNA处理前后宫颈癌CaSki细胞凋亡水平,结果表明,SCD-1 siRNA组中细胞早期凋亡数显著高于未处理组和对照siRNA组,而活细胞数显著低于未处理组和对照siRNA组(P<0.05),提示SCD-1表达下调能明显诱导宫颈癌细胞发生凋亡。进一步分析与细胞凋亡密切相关的caspase-3、caspase-9、Bcl-2和Bax蛋白的活性和表达水平,结果发现SCD-1表达下调能显著提升caspase-3和caspase-9的活性,增加Bax蛋白的表达水平,但降低Bcl-2蛋白的水平,这一结果提示SCD-1表达下调介导的细胞凋亡可能与caspase-3和caspase-9活性的升高、Bax蛋白表达上调以及Bcl-2表达下调密切相关。
总之,我们的结果显示,SCD-1表达下调能显著抑制宫颈癌细胞增殖和诱导细胞凋亡,其凋亡发生可能与凋亡相关蛋白表达变化密切相关,未来进一步研究SCD-1在宫颈癌发生发展中的分子机制有望为宫颈癌的分子靶向治疗提供新的实验依据。
[1] Deberardinis RJ, Sayed N, Ditsworth D, et al. Brick by brick: metabolism and tumor cell growth[J]. Curr Opin Genet Dev, 2008, 18(1):54-61.
[2] Swinnen JV, van Veldhoven PP, Timmermans L, et al. Fatty acid synthase drives the synthesis of phospholipids partitioning into detergent-resistant membrane microdomains[J]. Biochem Biophys Res Commun, 2003, 302(4):898-903.
[3] Li J, Ding SF, Habib NA, et al. Partial characterization of a cDNA for human stearoyl-CoA desaturase and changes in its mRNA expression in some normal and malignant tissues[J]. Int J Cancer, 1994, 57(3):348-352.
[4] Enoch HG, CatalA, Strittmatter P. Mechanism of rat liver microsomal stearyl-CoA desaturase. Studies of the substrate specificity, enzyme-substrate interactions, and the function of lipid[J]. J Biol Chem, 1976, 251(16): 5095-5103.
[5] Falvella FS, Pascale RM, Gariboldi M, et al. Stearoyl-CoA desaturase 1 (Scd1) gene overexpression is associated with genetic predisposition to hepatocarcinogenesis in mice and rats[J]. Carcinogenesis, 2002, 23(11): 1933-1936.
[6] Yahagi N, Shimano H, Hasegawa K, et al. Co-ordinate activation of lipogenic enzymes in hepatocellular carcinoma[J]. Eur J Cancer, 2005, 41(9):1316-1322.
[7] Thai SF, Allen JW, DeAngelo AB, et al. Detection of early gene expression changes by differential display in the livers of mice exposed to dichloroacetic acid[J]. Carcinogenesis, 2001, 22(8):1317-1322.
[8] Lu J, Pei H, Kaeck M, et al. Gene expression changes associated with chemically induced rat mammary carcinogenesis[J]. Mol Carcinog, 1997, 20(2): 204-215.
[9] Moore S, Knudsen B, True LD, et al. Loss of stearoyl-CoA desaturase expression is a frequent event in prostate carcinoma[J]. Int J Cancer, 2005, 114(4):563-571.
[10] Morgan-Lappe SE, Tucker LA, Huang X, et al. Identification of Ras-related nuclear protein, targeting protein for xenopus kinesin-like protein 2, and stearoyl-CoA desaturase 1 as promising cancer targets from an RNAi-based screen[J]. Cancer Res, 2007, 67(9):4390-4398.
[11] 吴裕丹, 倪嘉延, 陈耀庭, 等. 沉默HIF-1α基因表达对大鼠肝癌细胞增殖的影响[J]. 中国病理生理杂志, 2013, 29(7):1207-1212.
[12] Igal RA. Stearoyl-CoA desaturase-1: a novel key player in the mechanisms of cell proliferation, programmed cell death and transformation to cancer[J]. Carcinogenesis, 2010, 31(9):1509-1515.
[13] Mauvoisin D, Charfi C, Lounis AM, et al. Decreasing stearoyl-CoA desaturase-1 expression inhibits β-catenin signaling in breast cancer cells[J]. Cancer Sci, 2012, 104(1):36-42.
[14] Zhang H, Li H, Ho N, et al. Scd1 plays a tumor-suppressive role in survival of leukemia stem cells and the development of chronic myeloid leukemia[J]. Mol Cell Biol, 2012, 32(10):1776-1787.
[15] Cui Z, Houweling M, Chen MH, et al. A genetic defect in phosphatidylcholine biosynthesis triggers apoptosis in Chinese hamster ovary cells[J]. J Biol Chem, 1996, 271(25):14668-14671.
[16] Scaglia N, Chisholm JW, Igal RA. Inhibition of stearoylCoA desaturase-1 inactivates acetyl-CoA carboxylase and impairs proliferation in cancer cells: role of AMPK[J]. PLoS One, 2009, 4(8):e6812.
[17] Minville-Walz M, Pierre AS, Pichon L, et al. Inhibition of stearoyl-CoA desaturase 1 expression induces CHOP-dependent cell death in human cancer cells[J]. PLoS One, 2010, 5(12):e14363.
ExpressionofSCD-1incervicalcarcinomaandeffectofitsdown-regulationonproliferationandapoptosisofcervicalcarcinomacells
YANG Jun1, ZHANG Cai-feng2, QIN Rui-ying1, REN Yan-fang1, WANG Hui-ling1, HUA Fang-fang1
(1DepartmentofObstetricsandGynecology,2DepartmentofGastroenterology,theFirstAffiliatedHospitalofXinxiangMedicalUniversity,Xinxiang453100,China.E-mail:wylyangjun888@126.com)
AIM: To examine the expression of stearoyl-CoA desaturase-1 (SCD-1) in normal cervical tissues, cervical squamous cell carcinoma tissues, and cervical carcinoma cell lines HeLa, SiHa and CaSki, and to investigate the effect of down-regulation of SCD-1 on the proliferation and apoptosis of cervical carcinoma cells.METHODSThe expression of SCD-1 was detected by Western blotting in normal cervical tissues, cervical squamous cell carcinoma tissues, and cervical carcinoma cell lines HeLa, SiHa and CaSki. SCD-1 siRNA and control siRNA were utilized to transfect CaSki cells by Lipofectamine 2000, and SCD-1 protein level was determined by Western blotting after transfection. Furthermore, CCK-8 and flow cytometry were utilized to investigate the changes of cell proliferation and apoptosis after transfection with SCD-1 siRNA in CaSki cells. Subsequently, the activities of caspase-3 and caspase-9 were analyzed by Caspase-Glo®3/7 and 9 detection kit after transfection with SCD-1 siRNA in CaSki cells. Finally, the protein expression of Bcl-2 and Bax was detected by Western blotting.RESULTSThe protein expression of SCD-1 in cervical squamous cell carcinoma tissues was significantly higher than that in normal cervical tissues, and the protein expression of SCD-1 in the 3 cervical carcinoma cell lines was obviously higher than that in normal cervical tissues, in which CaSki cells displayed the highest SCD-1 protein level. In addition, the protein expression of SCD-1 in SCD-1 siRNA group was significantly lower than that in untreated group and control siRNA group. Compared with untreated group and control siRNA group, the proliferation of CaSki cells was markedly inhibited in SCD-1 siRNA group. Early apoptotic rate in SCD-1 siRNA group was evidently higher than that in untreated group and control siRNA group. The activities of caspase-3 and caspase-9, and the level of Bax protein were significantly elevated, and the protein level of Bcl-2 was obviously reduced after transfection with SCD-1 siRNA in CaSki cells.CONCLUSIONSCD-1 may play an important role in the occurrence and development of cervical carcinoma, and its down-regulation, which mediates cell proliferation inhibition and apoptosis, may be tightly associated with the activities of caspase-3 and caspase-9, and the protein expression of Bcl-2 and Bax.
Stearoyl-CoA desaturase-1; Uterine cervical neoplasms; Cell proliferation; Apoptosis
R363
A
10.3969/j.issn.1000- 4718.2013.11.010
1000- 4718(2013)11- 1972- 06
2013- 07- 01
2013- 10- 08
河南省人口和计划生育科学技术研究课题(No. 20121026)
△通讯作者 Tel: 0373-4402424; E-mail: wylyangjun888@163.com

