IL-23/IL-17炎症轴在咪喹莫特诱导的小鼠银屑病样皮肤损害中的作用*
赵京霞, 底婷婷, 王 燕, 刘 欣, 梁代英, 李 萍△
(1北京中医药大学基础医学院, 北京 100029; 2北京市中医研究所, 首都医科大学附属北京中医医院, 北京 100010)
IL-23/IL-17炎症轴在咪喹莫特诱导的小鼠银屑病样皮肤损害中的作用*
赵京霞1,2, 底婷婷2, 王 燕2, 刘 欣2, 梁代英2, 李 萍1,2△
(1北京中医药大学基础医学院, 北京 100029;2北京市中医研究所, 首都医科大学附属北京中医医院, 北京 100010)
目的观察IL-23/IL-17炎症轴在咪喹莫特诱导的小鼠银屑病样皮损形成过程中的作用及变化规律。方法雌性BALB/c小鼠随机分为正常对照组和咪喹莫特组,采用PASI评分观察银屑病样小鼠模型皮损动态变化;光镜观察皮损组织形态学变化;细胞因子抗体芯片技术对比检测两组小鼠血清及皮损组织中细胞因子谱的变化;采用流式细胞小球微阵列术、实时荧光定量PCR和蛋白免疫印迹分析技术对小鼠血清及皮肤组织中细胞因子含量、mRNA和蛋白表达水平进行检测;流式细胞术分析外周血及脾细胞成分。结果咪喹莫特诱导小鼠产生红斑、鳞屑、增厚等典型的银屑病样皮损,并随着给药时间的延长呈现一个抛物线型的动态变化;经咪喹莫特外用刺激后,小鼠皮肤及血清中IL-23/IL-17轴相关细胞因子、Th1、Th2和Treg类细胞因子含量及表达水平均显著升高。IL-23/IL-17轴细胞因子表达也呈现一个先升高后降低的动态变化过程。咪喹莫特组小鼠外周血及脾细胞中树突状细胞比例显著升高,脾细胞中Th17细胞比例升高,约为正常对照组的3~4倍,Treg细胞比例约为正常对照组的2倍。结论咪喹莫特诱导小鼠产生的皮损症状、病理学特征及细胞因子改变都与银屑病相似,是进行银屑病研究可行的动物模型,该模型制备后第1~8天可模拟疾病的发展阶段。Th17细胞活化及IL-23/IL-17轴参与了该模型皮损的形成,并呈现一个先升高后降低的动态变化过程。Th1细胞介导的炎症反应也参与了该模型皮损的形成,并且伴随Treg 和Th2类细胞因子的反馈性升高。
银屑病; 咪喹莫特; 白细胞介素23/白细胞介素17轴; Th17
银屑病是一种常见的以鳞屑性红斑为特点的慢性炎性皮肤病,目前已被定义为器官特异性的自身免疫性疾病[1],白细胞介素(interleukin,IL)-23/IL-17炎症轴在银屑病的发病过程中起着重要的作用[2]。树突状细胞分泌的IL-23 分子与受体结合后可诱导Th17细胞增殖、活化并分泌IL-17、IL-22等多种细胞因子[3],这些细胞因子募集中性粒细胞[4],诱发银屑病等多种炎性损伤,这被称为IL-23/IL-17炎性轴。
咪喹莫特(imiquimod,IMQ)是Toll样受体(Toll-like receptor,TLR)7/8的激动剂,主要用于外阴及肛周疣和光化性角化病的局部治疗。临床应用时发现,该药物可加重银屑病患者的症状或诱导银屑病的复发[5]。进一步研究发现将咪喹莫特外涂于小鼠皮肤,可诱导小鼠皮肤出现银屑病样皮损及组织学改变,与人类银屑病病理变化有很多相似之处[6]。我们的前期研究也证实了这个结果[7]。van der Fits等[8]报道,咪喹莫特诱导的小鼠银屑病样皮损改变伴随着IL-23/IL-17轴的变化,但其具体的变化规律未见报道,是否其它T细胞(Th1、Th2和Treg)介导的免疫应答也参了此模型皮损的形成过程,目前仍不清楚。本实验拟在此基础上,观察IL-23/IL-17炎症轴在该模型中的变化规律,对其作为银屑病药物筛选及机制研究的动物模型前景进行探索。
材 料 和 方 法
1动物
雌性BALB/c小鼠[由北京华阜康生物科技股份有限公司提供,动物许可证号为SCXK(京)20090007],体重18~20 g,饲养于SPF级动物室。
2试剂和药物
咪喹莫特乳膏(四川明欣药业有限责任公司);凡士林(河北兰炼飞天石化有限公司);CD3-FITC、CD4-PE、CD8-APC和CD11c-PE单克隆抗体(Biole-gend);佛波醇-12-肉豆蒄酯-13-乙酯(phorbol-12-myristate-13-acetate,PMA)和ionomycin(Sigma); IL-17-PE抗体、IFN-γ-APC抗体、IL-4-APC抗体、Foxp3-PE抗体、CD4-FITC抗体和CD25-APC抗体(eBioscience);小鼠细胞因子抗体芯片试剂盒(RayBio);小鼠Th17/Th2/Th1 流式细胞小球微阵列术(cytometric bead array,CBA)定量检测试剂盒(BD);HiFi-MMLV cDNA第一链合成试剂盒和UltraSYBR Mixture(CWbio);IL-23兔多克隆抗体和IL-17兔多克隆抗体(Abcam)。
3方法及分组
BALB/c小鼠戊巴比妥钠80 mg/kg腹腔注射麻醉,刮除其背部毛发,形成约2 cm×3 cm大小的暴露区域,单笼饲养。随机分为正常对照组(control,CTRL)和IMQ组。IMQ组小鼠每天涂抹5%IMQ乳膏42 mg,正常对照组小鼠背部每日涂抹等量凡士林,连续14 d,分别于2、4、6、8、10、12和14 d取材。
4检测指标与方法
4.1小鼠银屑病样皮损面积和疾病严重程度(psoriasis area and severity index,PASI)评分 采用数码照相的方法每天记录,并依据PASI评分标准,给予小鼠皮损处红斑(erythema)、鳞屑(scales)及浸润增厚程度(thickness) 0~4的积分,将三者积分相加得到总积分。PAIS评分标准如下:0,无;1,轻度;2,中度;3,重度;4,极重度。对各组小鼠积分取平均值后绘制趋势线,观察各组小鼠皮损的变化情况。
4.2小鼠皮损病理学检测 采用HE染色观察。每组4只小鼠脱颈处死后,按照九格法各组剪取相对应皮损处组织,固定于10%甲醛中,经脱水、石蜡包埋、切片、HE染色,每个标本选4张染色切片进行观察并照相。
4.3小鼠皮损及血清细胞因子芯片检测 小鼠血清及组织中细胞因子的定性检测采用Raybiotech公司细胞因子抗体芯片进行测定,该芯片可同时测定20余种细胞因子。具体操作严格按试剂盒的说明书进行,X射线胶片曝光后,将胶片上的图像用扫描仪扫描并转换为灰度TIFF格式的图片文件保存。运行ScanAlyze软件,将灰度TIFF格式图片的点阵转化为数字型数据,将此原始数据储存为Microsoft Excel文件。
4.4小鼠血清细胞因子定量检测 采用CBA定量检测小鼠血清细胞因子的浓度。测定方法如下:按试剂盒要求将标准品稀释成不同浓度,在待测管中加入不同细胞因子抗体的混合微珠,然后加入不同浓度标准品或待测血清样本,再分别加入PE标记的检测抗体,充分摇匀后室温避光孵育3 h后,上机检测。
4.5小鼠外周血细胞CD4+T细胞、CD8+T 细胞、CD11c+细胞数量检测 取小鼠抗凝血0.1 mL×2管,分别加入CD3-FITC、CD4-PE、CD8-APC单克隆抗体、混合液和CD11c-PE单克隆抗体,避光放置30 min。加入Lysis Buffer裂解红细胞后离心洗涤,PBS重悬,进行流式细胞术检测。
4.6小鼠脾脏变化观察 小鼠称重后处死,取脾脏称重,计算脾指数(脾指数=脾重量/体重),反映动态小鼠全身反应改变。
4.7小鼠脾脏免疫细胞成分检测 (1)常规分离各组小鼠脾细胞,获得脾细胞悬液。分别加入CD3-FITC、CD4-PE、CD8-APC单克隆抗体混合液和CD11c-PE单克隆抗体,避光30 min后,离心洗涤重悬,进行流式细胞术检测分析CD4+T细胞、CD8+T 细胞和CD11c+细胞比例变化。(2)调整脾细胞悬液浓度,加入PMA及ionomycin培养1 h后,再加入蛋白转运抑制剂Brefeldin A继续培养4 h。分别加入anti-mouse CD4-FITC抗体或CD4-FITC抗体与CD25-PE抗体的混合液,室温避光30 min,PBS洗涤重悬,细胞经固定、破膜后,进行胞内细胞因子检测。分别加入PE标记的anti-mouse IL-17抗体、APC标记的anti-mouse IFN-γ抗体、APC标记的anti-mouse IL-4抗体和PE标记的anti-mouse Foxp3抗体,避光30 min,PBS洗涤后重悬细胞,流式细胞仪检测分析Th17细胞(CD4+IL-17+)、Th1细胞(CD4+IFN-γ+)、Th2细胞(CD4+IL-4+)和Treg(CD4+CD25+Foxp3+)细胞比例变化。
4.8实时荧光定量PCR检测 用超纯RNA提取试剂盒提取组织样本中总RNA。用HiFi-MMLVcDNA第一链合成试剂盒进行反转录,实验操作按产品说明书进行。采用实时荧光定量PCR仪(ABI 7300)进行扩增,引物序列如下:IL-23 上游引物5’-GACTCAGCCAACTCCTCCAGCCAG-3’,下游引物5’-TTGGCACTAAGGGCTCAGTCAGA-3’;IL-17A 上游引物5’-CAGACTACCTCAACCGTTCCA-3’,下游引物5’-ACAATCGAGGCCACGCAGGTGCAGC-3’;IL-17F 上游引物5’-TGCTACTGTTGATGTTGGGAC-3’,下游引物5’-AATGCCCTGGTTTTGGTTGAA-3’;IL-22 上游引物5’-CGTCAACCGCACCTTTAT-3’,下游引物5’-AGGGCTGGAACCTGTCTG-3’;TNF-α 上游引物5’-GAGAAGTTCCCAAATGGC-3’,下游引物5’-ACTTGGTGGTTTGCTACG-3’;IFN-γ 上游引物5’-TAACTCAAGTGGCATAGATGTGGAAG-3’,下游引物5’-GACGCTTATGTTGTTGCTGATGG-3’;IL-10 上游引物5’-CTGGACAACATACTGCTAACCGACTC-3’,下游引物5’-AACTGGATCATTTCCGATAAGGC-3’;IL-4上游引物5’-TCGTCTGTAGGGCTTCCAAGGTGCT-3’,下游引物5’-GTGGACTTGGACTCATTCATGGTGC-3’;用荧光染料UltraSYBR Mixture嵌合荧光法进行PCR扩增。扩增程序为:95 ℃ 10 min,(95 ℃ 15 s,60 ℃ 60 s)×50个循环。采用2-ΔΔCt法进行数据的相对定量分析。
4.9蛋白质提取及Western blotting分析 常规提取皮损组织蛋白,BCA蛋白定量试剂盒对提取的细胞总蛋白进行蛋白定量。各组取20 μg样品蛋白进行SDS-聚丙烯酰胺凝胶电泳并转移到PVDF膜上,封闭液室温封闭1 h。加入特异性识别抗体,4 ℃封闭过夜。TBS振荡洗膜后,加入荧光Ⅱ抗(1∶10 000),避光孵育1 h,Odssey双色红外成像仪扫描分析。
5统计学处理
数据以均数±标准差(mean±SD)表示。使用SPSS 15.0软件对数据进行分析,两组间均数比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1IMQ诱导的小鼠银屑病样动物模型皮损的形态学变化
图1可见,正常对照组小鼠皮肤较薄,无鳞屑,无增厚改变。IMQ组小鼠在IMQ涂抹1 d后皮肤即出现点状红斑,2~3 d后出现细小鳞屑,皮肤褶皱。随着时间的延长,IMQ组小鼠皮损日益严重:红斑由少量淡粉色变为大面积深红色;鳞屑增多增厚,由少量细屑过渡至布满全暴露皮肤的层状鳞屑,易脱落,脱落后可见点状出血;皮肤增厚明显,逐渐隆起、皱折,几乎占暴露皮肤的2/3以上。皮损在涂药后7和8 d症状最为严重,此后红斑缓缓消退,鳞屑快速脱落,仅残留部分细小碎屑,但颜色依然偏红,增厚情况减退缓慢。直到14 d后,红斑及鳞屑都已消退,增厚缓解不明显。依据PASI评分标准绘制趋势线可观察到,皮损变化过程与趋势线相似:正常对照组小鼠红斑、鳞屑及增厚程度趋势线始终平稳在0左右;IMQ组小鼠红斑积分持续增加,至8 d左右可达高峰,此后积分较快降低,至13 d后可达平稳,降低减缓,但仍高于正常值;IMQ组鳞屑积分前期增加迅速,5~6 d后达到平稳,9 d后逐渐减低;IMQ组增厚趋势前期呈现稳步上升局势,到8 d左右达顶峰,此后,较缓慢降低,但始终明显高于正常,见图2。

Figure 1. The gross observation of mouse lesional skin induced by IMQ. BALB/c mice were treated with IMQ or vehicle (control,CTRL) once a day for 14 d, and the morphology of skin was examined at different time points.
图1IMQ诱导的小鼠背部皮损的大体观察

Figure 2. The PASI scores of mouse lesional skin induced by IMQ.Erythema, scales, and thickness of the back skin were scored daily on a scale from 0 to 4,and the cumulative score (erythema+scales+thickness) was calculated. Mean±SD.n=6.
图2IMQ诱导的小鼠背部皮损PASI积分的变化
2IMQ诱导的银屑病样动物模型皮损的组织学变化
HE染色显示,正常对照组小鼠皮肤表皮层菲薄,仅2~3层,细胞形态正常。与正常对照组比较,IMQ组小鼠皮肤表皮层2 d即有明显增厚,出现角化不全,棘细胞数量增加。随着时间的延长,表皮层逐渐增厚,伴随Munro微脓肿的出现,内有炎症细胞及表皮细胞碎片,角化不全严重,角质层内残留有固缩的细胞核,真皮炎症细胞浸润明显,血管增生、扩张尤其在真皮浅层。炎症反应至8 d为顶峰,此后表皮厚度降低,角化不全减少,炎症细胞浸润及血管增生扩张减轻,但14 d时仍高于正常,见图3。

Figure 3. The histological changes of mouse lesional skin induced by IMQ (HE staining).
图3IMQ诱导的小鼠皮损的组织学改变
3IMQ诱导的银屑病样皮损动物模型血清细胞因子谱的变化
细胞因子抗体芯片扫描结果显示,与正常对照组比较,IMQ组小鼠第6天的血清中升高的细胞因子主要有:粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)、干扰素γ(interferon γ,IFN-γ)、IL-9、IL-10和IL-17。其中升高大于2倍的因子有GM-CSF、IFN-γ和IL-17,其中IL-17的升高尤为显著,见图4和表1。CBA定量检测结果显示,与正常小鼠对比,IMQ组小鼠血清中IL-17、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、IFN-γ、IL-4和IL-10浓度均显著升高(P<0.01或P<0.05),见表2。

Figure 4. The cytokine scanning of the serum from IMQ-treated mice determined by cytokine protein array.
图4IMQ诱导的小鼠血清中细胞因子的扫描结果
表1IMQ组小鼠血清与正常对照组相比上调≥1.3倍的细胞因子列表
Table 1. The serum cytokines whose indexes were more than or equal to 1.3 times of IMQ/CTRL
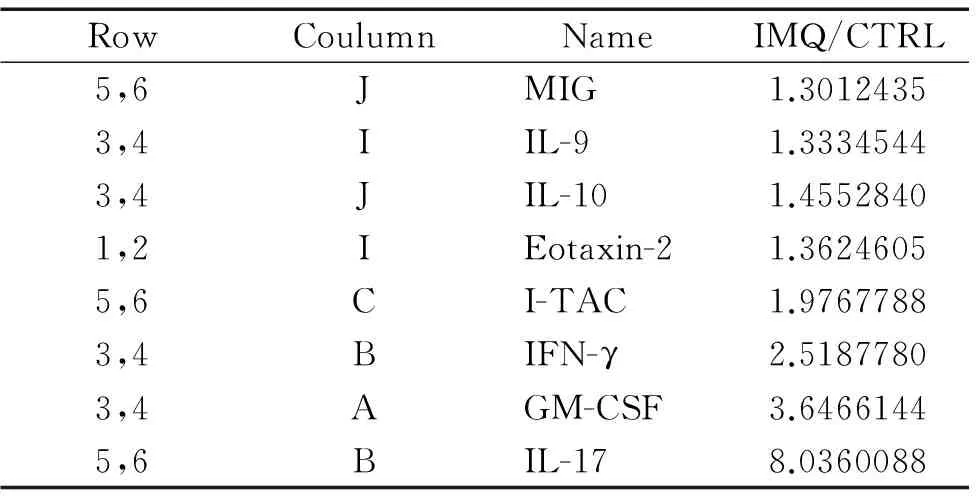
RowCoulumnNameIMQ/CTRL5,6JMIG1.30124353,4IIL-91.33345443,4JIL-101.45528401,2IEotaxin-21.36246055,6CI-TAC1.97677883,4BIFN-γ2.51877803,4AGM-CSF3.64661445,6BIL-178.0360088
表2IMQ诱导的小鼠血清中细胞因子浓度的变化
Table 2. The serum concentrations of the cytokines in IMQ-treated mice (ng/L.Mean±SD.n=6)

GroupIL-17TNF-αIFN-γIL-4IL-10CTRL2.62±0.396.67±1.593.90±0.923.12±0.514.71±0.52IMQ5.85±0.41**30.74±5.18**30.54±11.20*6.08±0.60**46.97±3.92**
*P<0.05,**P<0.01vsCTRL.
4IMQ诱导的银屑病样皮损动物模型皮损细胞因子谱的变化
与正常小鼠对比,IMQ组小鼠第6天的皮肤组织中升高的细胞因子主要有:角质形成细胞源性趋化因子(keratinocyte-derived chemokine,KC;又称CXCL1)、粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)、GM-CSF、IL-10、IL-12 p40/p70和IL-17,见图5和表3。Western blotting结果显示,IMQ组小鼠皮损组织中IL-17和IL-23表达较正常对照小鼠显著升高,见图6和表4。

Figure 5. The cytokine scanning of the lesional skin from IMQ-treated mice determined by cytokine protein array.
图5IMQ诱导的小鼠皮损组织中细胞因子的扫描结果
5IMQ诱导的银屑病样皮损动物模型皮损细胞因子mRNA的异常表达
与正常小鼠对比,IMQ组小鼠第4天的皮损组织中除了Th1类细胞因子(IFN-γ)、IL-23及Th17类细胞因子(IL-17A、IL-17F、IL-22)mRNA水平显著升高外,Th2类细胞因子IL-4及Treg细胞因子IL-10 mRNA水平也显著升高,见图7。
表3IMQ诱导的小鼠皮损组织上调≥1.3倍的细胞因子列表
Table 3. The lesional skin cytokines whose indexes were more than or equal to 1.3 times of IMQ/CTRL
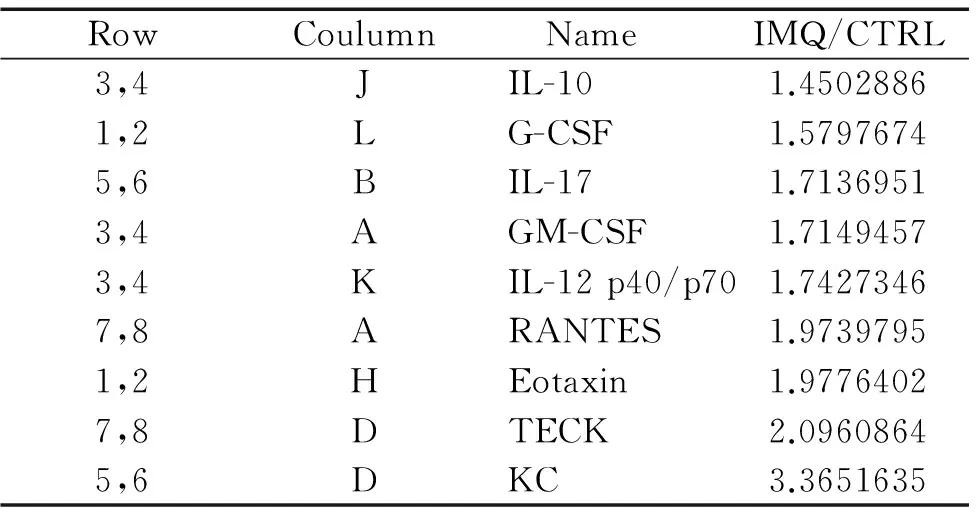
RowCoulumn NameIMQ/CTRL3,4JIL-101.45028861,2LG-CSF1.57976745,6BIL-171.71369513,4AGM-CSF1.71494573,4KIL-12p40/p701.74273467,8ARANTES1.97397951,2HEotaxin1.97764027,8DTECK2.09608645,6DKC3.3651635

Figure 6. IL-17 and IL-23 protein expression in lesional skin of mice induced by IMQ.
图6IMQ诱导小鼠皮损组织中IL-17和IL-23蛋白的表达
表4IMQ诱导的小鼠皮损组织IL-17和IL-23蛋白的相对表达量
Table 4. The relative protein expression of IL-17 and IL-23 in mice lesional skin induced by IMQ(Mean±SD.n=6)

GroupIL-23/GAPDHIL-17/GAPDHCTRL0.21±0.030.28±0.03IMQ0.59±0.08**0.55±0.07**
**P<0.01vsCTRL.
6IMQ诱导的小鼠银屑病样皮损中IL-23/IL-17轴相关细胞因子mRNA表达的变化规律
收集IMQ组小鼠0、2、4、6和8 d的皮损组织,采用实时荧光定量PCR的方法检测皮损组织中IL-23/IL-17轴相关细胞因子mRNA表达的变化,结果显示,IL-23和IL-17A mRNA水平在IMQ给药后5~6 d达到高峰,随后开始下降,IL-17A mRNA水平下降幅度明显。TNF-α和IL-17F mRNA水平在第3~4 d达到高峰后开始下降。IMQ诱导后,小鼠皮损中IL-23/IL-17轴相关细胞因子mRNA表达水平呈现先升高后降低的动态变化规律,见图8。

Figure 7. The mRNA expression of the cytokines in lesional skin from IMQ-treated mice determined by real-time PCR.Mean±SD.n=4.*P<0.05,**P<0.01vsCTRL.
图7IMQ诱导的小鼠皮损组织中细胞因子mRNA的表达
7IMQ诱导的银屑病样皮损小鼠外周血细胞成分的变化
流式细胞术结果显示,与正常对照组小鼠相比,IMQ作用于小鼠皮肤8 d后,小鼠外周血中CD11c+树突状细胞比例显著增高(P<0.01),CD4+T细胞与CD8+T细胞比例相对下降,见表5。
8IMQ诱导的银屑病样皮损小鼠脾重及细胞成分的变化
IMQ作用于刺激小鼠皮肤8 d后,IMQ组小鼠脾重约为正常对照组2倍,脾指数也明显高于正常对照组(P<0.01),见表6。对脾细胞成分进行流式细胞术检测发现,与正常对照组小鼠相比,IMQ组小鼠脾细胞中CD11c+树突状细胞比例显著增高(P<0.01),CD4+T细胞与CD8+T细胞比例相对下降,见表7。为进一步检测CD4+T细胞中Th1(CD4+IFN-γ+)细胞、Th17(CD4+IL-17+)细胞及Treg(CD4+CD25+Foxp3+)细胞的比例,各组脾细胞经PMA 和 ionomycin刺激5 h后,流式细胞术检测显示IMQ组小鼠脾细胞中Th17细胞比例较正常对照组显著升高(P<0.05),约为正常对照小鼠的3~4倍;Th1和Th2细胞比例与正常对照组相比没有明显的变化。IMQ组脾细胞中Treg细胞比例也显著升高(P<0.01),约为正常对照小鼠的2倍,见表8。

Figure 8. The cytokine mRNA dynamic expression in lesional skin from IMQ-treated mice determined by real-time PCR.Mean±SD.n=4.
图8IMQ诱导的小鼠皮损组织中细胞因子mRNA表达的动态变化
表5IMQ诱导的小鼠外周血中CD4+T、CD8+T和CD11c+细胞比例的变化
Table 5. The proportion of CD4+T, CD8+T and CD11c+cells in peripheral blood of mice induced by IMQ (%.Mean±SD.n=5)

GroupCD11c+CD3+CD4+CD3+CD8+CTRL1.27±0.4225.94±4.817.58±1.92IMQ6.76±1.23**20.71±3.62*5.44±1.04
*P<0.05,**P<0.01vsCTRL.
表6IMQ诱导的小鼠脾重及脾指数的变化
Table 6. The spleen mass and index changes of mice induced by IMQ(Mean±SD.n=6)

GroupSpleenmass(g)Spleenindex(mg/g)CTRL0.080±0.0104.51±0.37IMQ1.721±0.033**10.20±2.03**
*P<0.05,**P<0.01vsCTRL.
表7IMQ诱导的小鼠脾脏中CD4+T、CD8+T和CD11c+细胞比例的变化
Table 7. The proportion of CD4+T,CD8+T and CD11c+cells in spleen of mice induced by IMQ(%.Mean±SD.n=5)

GroupCD11c+CD3+CD4+CD3+CD8+CTRL9.89±3.0018.15±4.0811.06±2.28IMQ24.44±4.94**8.24±1.92**4.17±1.19**
*P<0.05,**P<0.01vsCTRL.
表8IMQ诱导的小鼠脾脏中CD4+IL-17+、CD4+IFN-γ+、CD4+IL-4+和CD4+CD25+Foxp3+细胞比例的变化
Table 8. The proprtion of CD4+IL-17+, CD4+IFN-γ+, CD4+IL-4+and CD4+CD25+Foxp3+cells in spleen of mice induced by IMQ (%. Mean±SD.n=5)

GroupCD4+IL-17+CD4+IFN-γ+CD4+IL-4+CD4+CD25+Foxp3+CTRL0.52±0.154.50±1.390.67±0.3811.51±0.51IMQ2.12±0.63**3.65±1.040.63±0.2621.68±0.79**
**P<0.01vsCTRL.
讨 论
目前针对IMQ诱导小鼠银屑病样皮损的研究多集中在给药后第5~8天的观察[9-10]。我们的研究对此模型进行了0~14 d的观察,发现IMQ诱导的小鼠银屑病样皮损随着时间的延长呈现一个抛物线型的动态变化:在IMQ涂抹1~3 d后小鼠皮肤即出现红斑、细小鳞屑和褶皱。第7~8 d银屑病样症状最为严重,此后随着IMQ给药时间的延长,红斑不再继续加重且有消退的趋势,鳞屑脱落,但皮肤增厚依然严重。从小鼠银屑病样皮损PASI评分趋势图上可以明显看出这一动态变化过程。IMQ作用后小鼠皮损组织病理学动态改变也与皮损形态变化一致,典型的银屑病样病理学改变均在第8天表现最为明显,然后逐渐改善。同时,我们观察了第8天IMQ停止给药后小鼠皮损的变化,PASI评分及病理学表现也出现了上述同样的下降规律[11],但下降幅度明显大于IMQ连续给药组。
根据以上结果推测,IMQ外用诱导的是一个暂时的炎症爆发,该模型在IMQ持续作用下可能发生药物适应、耐受情况,致使皮损出现自限性倾向,类似银屑病临床急性期的自愈现象。因此,IMQ诱导的小鼠银屑病样动物模型有时间窗的限制,可以认为前8 d为疾病的发生、发展阶段,可应用于银屑病发病机制探索、药物筛选及干预作用机制研究。
在实验中,我们发现随着IMQ给药时间的延长,小鼠出现精神萎靡、食欲降低、体重下降等全身反应症状,并且脾脏显著增大,第8天时,脾重约为正常对照组2倍,脾指数也明显高于正常对照组,提示IMQ局部外用刺激可引起小鼠免疫系统的亢进、紊乱等全身反应。这也解释了为何临床应用IMQ局部治疗会导致患者出现流感样症状及诱发银屑病等副作用。
为深入了解参与IMQ诱导的小鼠银屑病样皮损形成的细胞免疫应答类型,我们采用细胞因子抗体芯片检测技术对该模型小鼠血清及皮损组织中24种细胞因子进行了筛选和分析。经IMQ刺激后,小鼠皮肤及血清中Th1类细胞因子如IFN-γ、Th17类细胞因子如IL-17和粒细胞类的集落刺激因子(GM-CSF)等及Treg类细胞因子(IL-10)均显著升高,提示Th1、Th17和Treg细胞介导的免疫反应参与了该模型皮损的形成。
由于细胞因子抗体芯片是一种定性的分析工具,只能反映样本之间相关细胞因子相对表达丰度的高低,为进一步明确各组小鼠皮肤及血清中细胞因子谱的变化,我们分别采用CBA、实时荧光定量PCR、蛋白免疫印迹等定量及半定量分析技术对小鼠血清中细胞因子的含量及皮肤组织中细胞因子mRNA、蛋白表达水平进行了检测。与细胞因子抗体芯片检测结果一致,无论在IMQ诱导的小鼠模型血清还是皮损组织中,Th17类细胞因子(IL-17、IL-22)、Th1类细胞因子(IFN-γ)和Treg类细胞因子(IL-10)的表达均显著高于正常小鼠。此外,Th2类细胞因子IL-4的表达在此模型中也显著升高,这与细胞因子抗体芯片检测结果是不同的,可能与不同检测方法间的差异及灵敏度有关。以上结果明确了Th17类细胞因子在此模型中的作用,这与van der Fits等[8]的报道一致。并且我们发现另外一类具有促炎作用的Th1类细胞因子在此模型中也存在异常高表达,与临床银屑病患者的细胞因子表达谱相符合[12],Shibata等[13]也有类似的研究结果。
值得注意的是,与Quaglino等[14]的临床研究结果不同,具有抑炎效应的Th2细胞因子和具有免疫调节作用的Treg细胞因子在该银屑病样模型中也显著升高,并且脾细胞中Treg细胞(CD4+CD25+Foxp3+)比例升高,约为正常对照小鼠的2倍,这与Zhang等[15]的研究结果一致。Treg细胞、Th2细胞与Th1、Th17细胞之间的相互作用对维持免疫反应与病理损伤之间的平衡是很重要的。我们推测在银屑病发病过程中由于Th17或Th1细胞的大量浸润,打破了这个免疫平衡,Treg细胞或Th2细胞代偿性地募集至皮损区域,作为一种反馈机制抑制IL-17或IFN-γ所诱导的炎症反应,尽管如此,Th17和Th1细胞因子仍处于优势地位,使银屑病呈现出炎症爆发的表现。因此在皮损组织及血清中存在IL-4及IL-10等细胞因子水平的升高,这只是Th1和Th17细胞免疫应答爆发的反馈效应,而不是IMQ的直接诱导作用所致。综合以上资料,Th17 及Th1细胞介导的免疫反应在IMQ诱导的银屑病样模型中起着主导作用。
通过对脾细胞成分进行流式细胞术检测发现,与正常对照组小鼠相比,IMQ组小鼠脾细胞中CD11c+树突状细胞比例显著增高,外周血中细胞成分也发生了相似的变化,并且之前的研究我们已证实在IMQ诱导的小鼠皮损组织中有树突状细胞的大量浸润[7],由此可见IMQ外用可诱导小鼠外周及皮损区树突状细胞的增殖及募集。树突状细胞是分泌IL-23的主要细胞[16],IMQ组小鼠皮损区IL-23mRNA及IL-23蛋白的高表达可能是由于浸润的树突状细胞分泌所致。IL-23是Th17细胞增殖及活化的上游分子,该模型中Th17细胞因子的高表达可能是IL-23高表达的结果。在脾细胞中我们也发现Th17(CD4+IL-17+)细胞的比例的显著升高,约为正常对照小鼠的3~4倍;而Th1细胞比例与正常对照组相比没有明显的变化。由此提示,Th17细胞及其细胞因子在IMQ诱导的动物模型中可能发挥着更为重要的作用。
浆细胞样树突状细胞和巨噬细胞是表达TLR7/8的主体细胞,IMQ与TLR7/8结合后可启动IFN-α的大量分泌[17],IFN-α诱导树突状细胞成熟活化[18]并分泌IL-23,后者作用于Th17细胞,介导Th17细胞免疫反应。这可能是IMQ诱发小鼠皮损组织及血清中IL-23/IL-17轴相关细胞因子大量表达的原因。
实验中我们也发现,IMQ外涂于皮肤后,IL-23 mRNA和Th17类细胞因子mRNA表达均呈一个动态变化的过程。在第4~6天,这些因子的mRNA表达水平达到高峰,随后表达水平开始下降。IMQ作用后IL-23/IL-17轴相关细胞因子 mRNA先升后降的动态变化规律导致Th17细胞介导的炎症反应不能持续存在,从而出现皮损的动态变化。但是该模型皮损的表现在第7~8天最为严重,可能由于mRNA转录、蛋白翻译表达等时间的延迟所致。目前尚不清楚究竟是何种耐受机制使IMQ不能引发持续的炎症反应,也未见IMQ在临床使用出现药物耐受的报道。
综合以上结果,IMQ诱导小鼠产生的皮损症状、病理学特征及细胞因子改变都与银屑病相似,是进行银屑病研究可行的动物模型。该模型操作简单,消耗较少,易于推广。此模型的前8 d可模拟疾病的发展阶段,第6~8天为变化高峰。Th17细胞活化及IL-23/IL-17轴参与了IMQ诱导的小鼠银屑病样皮损的形成,并呈现一个先升高后降低的动态变化过程。Th1细胞介导的炎症反应也参与了该模型皮损的形成,并且伴随Treg 和Th2类细胞因子的反馈性升高。
[1] Gaspari AA. Innate and adaptive immunity and the pathophysiology of psoriasis[J]. J Am Acad Dermatol,2006,54(3 Suppl 2):S67-S80.
[2] Blauvelt A. T-helper 17 cells in psoriatic plaques and additional genetic links between IL-23 and psoriasis[J]. J Invest Dermatol,2008,128(5):1064-1067.
[3] Di Cesare A,Di Meglio P,Nestle FO.The IL-23/Th17 axis in the immunopathogenesis of psoriasis[J]. J Invest Dermatol,2009,129(6):1339-1350.
[4] 周宏斌,陈志华,李 雯.Th17细胞及白细胞介素17A在慢性气道炎症性疾病中的作用[J].中国病理生理杂志,2012,28(3): 560-564
[5] Rajan N, Langtry JA. Generalized exacerbation of psoriasis associated with imiquimod cream treatment of superficial basal cell carcinomas[J]. Clin Exp Dermatol,2006,31(1): 140-141.
[6] Palamara F, Meindl S, Holcmann M, et al. Identification and characterization of pDC-like cells in normal mouse skin and melanomas treated with imiquimod[J]. J Immunol, 2004,173(5): 3051-3061.
[7] 底婷婷,赵京霞, 王 燕,等.凉血活血胶囊对咪喹莫特诱导小鼠银屑病样皮损的干预作用[J].中国病理生理杂志,2012,28(4):718-722.
[8] van der Fits L, Mourits S,Voerman JS, et al. Imiquimod-induced psoriasis-like skin Inflammation in mice is mediated via the IL-23/IL-17 axis [J].J Immunol, 2009, 182(9):5836-5849.
[9] Pantelyushin S, Haak S, Ingold B, et al. Rorγt+innate lymphocytes and γδ T cells initiate psoriasiform plaque formation in mice[J]. J Clin Invest,2012,122(6):2252-2256.
[10] El Malki K, Karbach SH, Huppert J,et al. An alternative pathway of imiquimod-induced psoriasis-like skin inflammation in the absence of interleukin-17 receptor A signaling[J]. J Invest Dermatol, 2013, 133(2):441-451.
[11] 底婷婷.凉血活血胶囊对咪喹莫特诱导银屑病样小鼠模型的干预作用[D].北京:首都医科大学,2012.
[12] Lowes MA, Kikuchi T, Fuentes-Duculan J, et al. Psoriasis vulgaris lesions contain discrete populations of Th1 and Th17 T cells[J]. J Invest Dermatol,2008,128(5):1207-1211.
[13] Shibata S, Tada Y, Asano Y,et al. IL-27 activates Th1-mediated responses in imiquimod-induced psoriasis-like skin lesions[J].J Invest Dermatol,2013,133(2):479-488.
[14] Quaglino P,Bergallo M,Ponti R,et al. Th1, Th2, Th17 and regulatory T cell pattern in psoriatic patients: modulation of cytokines and gene targets induced by etanercept treatment and correlation with clinical response[J]. Dermatology,2011,223(1):57-67.
[15] Zhang L, Yang XQ, Cheng J, et al. Increased Th17 cells are accompanied by FoxP3+Treg cell accumulation and correlated with psoriasis disease severity[J]. Clin Immunol,2010,135(1):108-117.
[16] 谢 华,何韶衡. IL-17, 18, 23, 25 在变态反应性疾病中的作用[J]. 中国病理生理杂志,2004, 20(10): 1942-1946.
[17] Ito T, Amakawa R, Inaba M, et al. Differential regulation of human blood dendritic cell subsets by IFNs[J]. J Immunol,2001,166(5):2961-2969.
[18] Häcker H, Redecke V, Blagoev B, et a1. Specificity in Toll-like receptor signaling through distinct effector functions of TRAF3 and TRAF6[J]. Nature,2006,439 (7073):204-207.
RoleofIL-23/IL-17inflammatoryaxisinthepathogenesisofpsoriasis-likelesionsinducedbyimiquimodinmice
ZHAO Jing-xia1,2, DI Ting-ting2, WANG Yan2, LIU Xin2,LIANG Dai-ying2,LI Ping1,2
(1SchoolofPreclinicalMedicine,BeijingUniversityofChineseMedicine,Beijing100029,China;2BeijingInstituteofTraditionalChineseMedicine,BeijingHospitalofTraditionalChineseMedicineAffiliatedtoCapitalMedicalUniversity,Beijing100010,China.E-mail:liping411@yahoo.com.cn)
AIM: To observe the dynamic changes of IL-23/IL-17 inflammatory axis in psoriasis-like lesions of mice induced by imiquimod (IMQ).METHODSBALB/c female mice were randomly divided into control group and IMQ group. The morphological changes of lesional skin in mice were evaluated according to the psoriasis area and severity index (PASI) and HE staining. cytokine antibody chips were used to determine the cytokine changes in serum and lesions. The mRNA and protein expression of cytokines were analyzed by cytometric bead array, real-time PCR and Western blotting. Moreover, the changes of cellular constituents in the peripheral blood and splenic cells of mice were detected by flow cytometry.RESULTSTypical psoriasis-like skin lesions, such as red scaly skin plaques, caused by topical IMQ showed a parabolic dynamic change. There was a dynamic increase in proinflammatory cytokines of the IL-23/IL-17 axis in IMQ-treated skin. IMQ application resulted in elevated expression of cytokines related with IL-23/IL-17 inflammatory axis,Th1-type cytokines,Th2-type cytokines and Treg-type cytokines at day 4. IMQ-treated BALB/c mice showed an increased pericentage of dentric cells in peripheral blood and spleen compared with control animals. Percentages of Th17 and Treg in IMQ-treated mice were increased by 3~4 times and twice as compared with control mice, respectively.CONCLUSIONThe skin lesions, histopathological features and cytokine changes in mice induced by IMQ are similar to human psoriasis, which are suitable for investigating the pathogenesis of psoriasis as a psoriasis-like model. IL-23/IL-17 axis is involved in the formation of psoriasis-like skin lesions in mice induced by IMQ and presents a dynamic change. Besides, Th1 cell-mediated inflammatory response is also activated in the formation of lesional skin, accompanied by the increase expression of Th2 and Treg cytokines in a feedback mechanism.
Psoriasis; Imiquimod; Interleukin-23/interleukin-17 axis; Th17
R392
A
10.3969/j.issn.1000- 4718.2013.06.023
1000- 4718(2013)06- 1086- 09
2013- 03- 15
2013- 04- 24
国家自然科学基金资助项目(No.81072810)
△通讯作者 Tel: 010-52176679; E-mail: liping411@yahoo.com.cn

