PIG7与丙戊酸促进人白血病细胞SKNO-1的分化和凋亡*
邢海燕, 陈一瑞, 刘家卓, 唐克晶, 田 征, 饶 青, 王 敏, 王建祥
(中国医学科学院,北京协和医学院血液学研究所,血液病医院,实验血液学国家重点实验室,天津 300020)
PIG7与丙戊酸促进人白血病细胞SKNO-1的分化和凋亡*
邢海燕▲, 陈一瑞▲, 刘家卓#, 唐克晶, 田 征, 饶 青, 王 敏, 王建祥△
(中国医学科学院,北京协和医学院血液学研究所,血液病医院,实验血液学国家重点实验室,天津 300020)
目的研究p53诱导基因 7(PIG7)对人白血病细胞SKNO-1的作用及组蛋白脱乙酰酶抑制剂丙戊酸(VPA)的协同效应。方法SKNO-1细胞经不同浓度的VPA(1~10 mmol/L)分别作用后,用MTT法检测VPA对SKNO-1细胞增殖的影响。通过病毒包装及感染系统分别将带有PIG7开放读码框和反义寡核苷酸片段的慢病毒载体导入SKNO-1细胞,用RT-PCR及Western blotting检测SKNO-1细胞中PIG7 的mRNA及蛋白表达情况;用流式细胞术检测VPA作用于病毒感染后SKNO-1细胞的凋亡率和分化抗原CD11b的表达; DNA ladder实验分析细胞的凋亡。结果VPA可明显抑制SKNO-1细胞增殖,且具有时间、剂量依赖性。过表达PIG7促进SKNO-1细胞的凋亡和分化, 联合VPA作用后细胞分化抗原CD11b的表达水平和细胞凋亡率明显高于空载体组(P<0.05),并出现典型的DNA梯状条带。结论VPA具有抑制SKNO-1细胞增殖和诱导其分化及凋亡的作用。过表达PIG7可促进SKNO-1细胞的凋亡和分化,并增加SKNO-1细胞对VPA的敏感性。过表达PIG7联合VPA有望成为白血病治疗的新策略。
p53诱导基因7; 丙戊酸; 组蛋白脱乙酰酶; 白血病; 细胞凋亡
p53介导的凋亡是DNA受损细胞的重要凋亡途径,对于维持细胞基因组的稳定性起重要作用。p53诱导基因7 (p53-inducible gene 7,PIG7)是p53诱导细胞凋亡过程中涉及的关键基因之一,在乳腺癌、B细胞淋巴瘤、黑色素瘤及急性白血病中表达明显下调[1-4]。应用蛋氨酸诱导黑色素瘤细胞凋亡、全反式维甲酸诱导NB4细胞分化及苯丁酸钠诱导Kasumi-1细胞凋亡的过程中,PIG7表达上调。因而,PIG7的异常在白血病和肿瘤的发生发展中可能起到重要作用。组蛋白脱乙酰酶(histone deacetylase, HDAC)水平与多种肿瘤的发生发展相关,而HDAC抑制剂(histone deacetylase inhibitor, HDACi)可通过促进组蛋白乙酰化,上调相关抑癌基因表达,发挥抑制肿瘤细胞增殖、诱导分化或促进凋亡的作用。丙戊酸(valproic acid,VPA)是目前临床应用广泛的抗癫痫药物,因其也具有很强的HDACi活性,近来在白血病及多种实体瘤中显现出较好的抗肿瘤效应,但其具体作用机制尚未明了[5]。本研究利用慢病毒感染系统将PIG7导入携带有AML1-ETO融合基因的人白血病细胞系SKNO-1中,研究VPA与PIG7对细胞凋亡和分化的作用。
材 料 和 方 法
1材料
293T细胞为本室保存,SKNO-1细胞由上海交通大学医学院陈国强教授惠赠。带有PIG7开放读码框慢病毒表达载体pCDH-PIG7和PIG7反义RNA慢病毒载体pCDH-anti-PIG7 为本室构建,包装质粒为本室保存。VPA购自Sigma,小鼠抗人PIG7抗体购自Abcam和小鼠抗人β-actin抗体购自Sigma。
2方法
2.1细胞培养 293T和SKNO-1细胞分别培养于含10%胎牛血清的DMEM和15%胎牛血清的RPMI-1640(Gibco)完全培养基,其中SKNO-1细胞需补充10 μg/L 人粒细胞-巨噬细胞集落刺激因子(human granulocyte-macrophage colong-stimulating factor,hGM-CSF),置于37 ℃、5%CO2培养箱中培养。
2.2细胞对药物敏感性的MTT测定 SKNO-1细胞用培养基调整细胞密度为5×108/L,接种于96孔培养板,每孔100 μL,每组设3个平行孔,VPA浓度分别为0、0.15、0.3、0.6、1.25、2.5、5和10 mmol/L,处理24 h、48 h和72 h后,每孔加5 g/L MTT 10 μL,继续培养4 h,每孔加入50 μL 10% SDS (含5 mmol/L HCl),振荡混匀,37 ℃孵育过夜。用酶标仪检测各孔吸光度,根据吸光度计算细胞生长抑制率,根据线性回归方程求出VPA的半数抑制浓度(IC50),选择合适的VPA浓度进行细胞凋亡和分化的检测。
2.3细胞转染和病毒制备 转染前24 h将5×106293T细胞接种于10 cm培养板中,培养至50%~70%汇合度时进行磷酸钙沉淀法转染。分别于转染后48 h、60 h和72 h 收集培养上清于50 mL 离心管中,室温1 000 r/min离心10 min,收集上清;使用0.45 μm滤器过滤病毒上清后,置于50 mL超速离心管中,4 ℃、50 000×g离心90 min,弃上清;以培养上清1/50体积加入无血清DMEM,重悬病毒沉淀,分装后置-80 ℃冰箱保存。
2.4慢病毒感染及VPA处理SKNO-1细胞 将对数生长期的SKNO-1细胞以2×105/well接种于24孔板中,加入以无血清DMEM稀释至500 μL 的病毒液及6 mg/L polybrene,6 h后换新鲜的含10% FBS的 RPMI-1640培养液继续培养。
后续实验分为pCDH空病毒感染组、pCDH-PIG7感染组、pCDH-anti-PIG7感染组、pCDH+VPA(1或2 mmol/L)处理组、pCDH-PIG7+VPA处理组和pCDH-anti-PIG7+VPA处理组。
2.5PIG7 mRNA及蛋白表达检测 收集各组细胞分别进行RT-PCR及Western blotting分析PIG7的 mRNA及蛋白表达。PIG7引物序列: 5’-GCAGTACGGTCTACGTGCAG-3’,5’-CTTGTAGGTGCCCAGGAGAG-3’,扩增片段长251 bp。GAPDH引物序列:5’-GAAGGTGAAGGTCGGAGTC-3’, 5’-GAAGATGGTGATGGGATTTC-3’,扩增片段长度225 bp。
细胞经RIPA细胞裂解液裂解后,进行聚丙烯酰胺-SDS凝胶电泳,用半干电转仪将蛋白转移到硝酸纤维素膜上,5%脱脂牛奶封闭2 h,1∶2 000稀释的小鼠抗人PIG7抗体和小鼠抗人β-actin抗体室温孵育1 h后,置于4 ℃过夜,1∶2 000稀释的辣根过氧化物酶标记的羊抗小鼠Ⅱ抗室温孵育1 h,化学发光法显影。
2.6Annexin-V/7-AAD检测细胞凋亡 收集各组细胞,重悬于1×binding buffer并调节细胞浓度为1×109cells/L。取100 μL细胞悬液于流式管中,加入5 μL annexin-V/PE和(或)5 μL 7-AAD, 混匀后室温避光孵育15 min,在反应管中补加200 μL 1×binding buffer,流式细胞仪检测,比较pCDH-PIG7组及pCDH-anti-PIG7单独或联合VPA组(1或2 mmol/L)细胞凋亡率的变化。
2.7DNA梯形片段电泳分析 离心收集2×106细胞,用1 mL裂解液吹打混匀,加入10 g/L RNase A 2 μL,37 ℃孵育2 h。再加入20 g/L蛋白酶K 5 μL,37 ℃消化3 h。Tris 饱和酚抽提1次,氯仿/异戊醇抽提2次,无水乙醇沉淀。将沉淀溶于TE 缓冲液,置于4 ℃ 24 h 以上,使其充分溶解,2%琼脂糖凝胶电泳,照相。
2.8细胞分化抗原检测 取1×106细胞,用含0.1% NaN3的PBS洗涤2次,加入5 μL PE标记的人CD11b单克隆抗体,常温避光孵育30 min,PBS洗涤,加入1%多聚甲醛PBS 300 μL固定,在2 h内进行流式细胞术检测。
3统计学处理
采用SPSS 10.0软件进行统计学分析,计量资料用均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1慢病毒感染及VPA处理后SKNO-1细胞PIG7的表达
pCDH-PIG7感染组及pCDH-PIG7+VPA处理组的PIG7 mRNA和蛋白表达水平显著上调,感染pCDH-anti-PIG7病毒的SKNO-1细胞PIG7 mRNA和蛋白的表达明显受到抑制,见图1。

Figure 1. The expression of PIG7 induced by lentivirus infection and VPA treatment. High levels of PIG7 product were detected in pCDH-PIG7 group, pCDH+VPA group and pCDH-PIG7+VPA group by RT-PCR (A) and Western blotting (B) after infected with lentivirus for 48 h. The up-regulated PIG7 expression was significantly abrogated by pCDH-anti-PIG7.
图1病毒感染和VPA处理SKNO-1后PIG7的表达
2PIG7及VPA对SKNO-1细胞分化的影响
分别用0、0.15、0.30、0.60、1.25、2.50、5和10 mmol/L VPA处理SKNO-1细胞24 h、48 h和72 h,MTT结果显示,VPA显著抑制SKNO-1细胞的生长,并且有时间和剂量依赖性。pCDH-PIG7感染组CD11b阳性率 (17.1%) 较pCDH感染组 (8.2%) 明显升高 (P<0.05)。经1 mmol/L和2 mmol/L VPA处理后,pCDH-PIG7组CD11b分别升高到30.4%和42.4%,显著高于pCDH+VPA组(P<0.05)。而转染pCDH-anti-PIG7的SKNO-1细胞经VPA处理前后CD11b阳性率均显著低于pCDH-PIG7组 (P<0.05),见图2。
3PIG7及VPA对SKNO-1细胞凋亡的影响
3.1Annexin-V/7-AAD检测 pCDH-PIG7组细胞凋亡比例为20.3%,较pCDH组(6.8%)明显升高(P<0.05)。经1 mmol/L 和 2 mmol/L VPA处理后pCDH-PIG7组凋亡细胞分别升高至29.9%和61.4%,显著高于pCDH组的12.4%和40.5%(P<0.05)。转染pCDH-anti-PIG7的SKNO-1细胞经VPA处理前后细胞凋亡率均比pCDH-PIG7组明显降低 (P<0.05),见图3。

Figure 2. The differentiation of SKNO-1 cells after lentivirus infection and VPA treatment.Mean±SD.n=3.*P<0.05vspCDH alone;#P<0.05vspCDH-PIG7 with the same concentration of VPA.
图2病毒感染和VPA处理SKNO-1前后细胞分化抗原CD11b的表达

Figure 3. The apoptosis of SKNO-1 cells after lentivirus infection and VPA treatment.Mean±SD.n=3.*P<0.05,**P<0.01vspCDH alone;#P<0.05vspCDH-PIG7 with the same concentration of VPA.
图3病毒感染和VPA处理对SKNO-1细胞凋亡的影响
3.2DNA梯形片段电泳分析 转导pCHD-PIG7的SKNO-1细胞出现凋亡的典型梯形条带,经VPA处理后,pCDH-PIG7感染组的梯形条带比pCDH组及pCDH-anti-PIG7组更为明显,见图4。
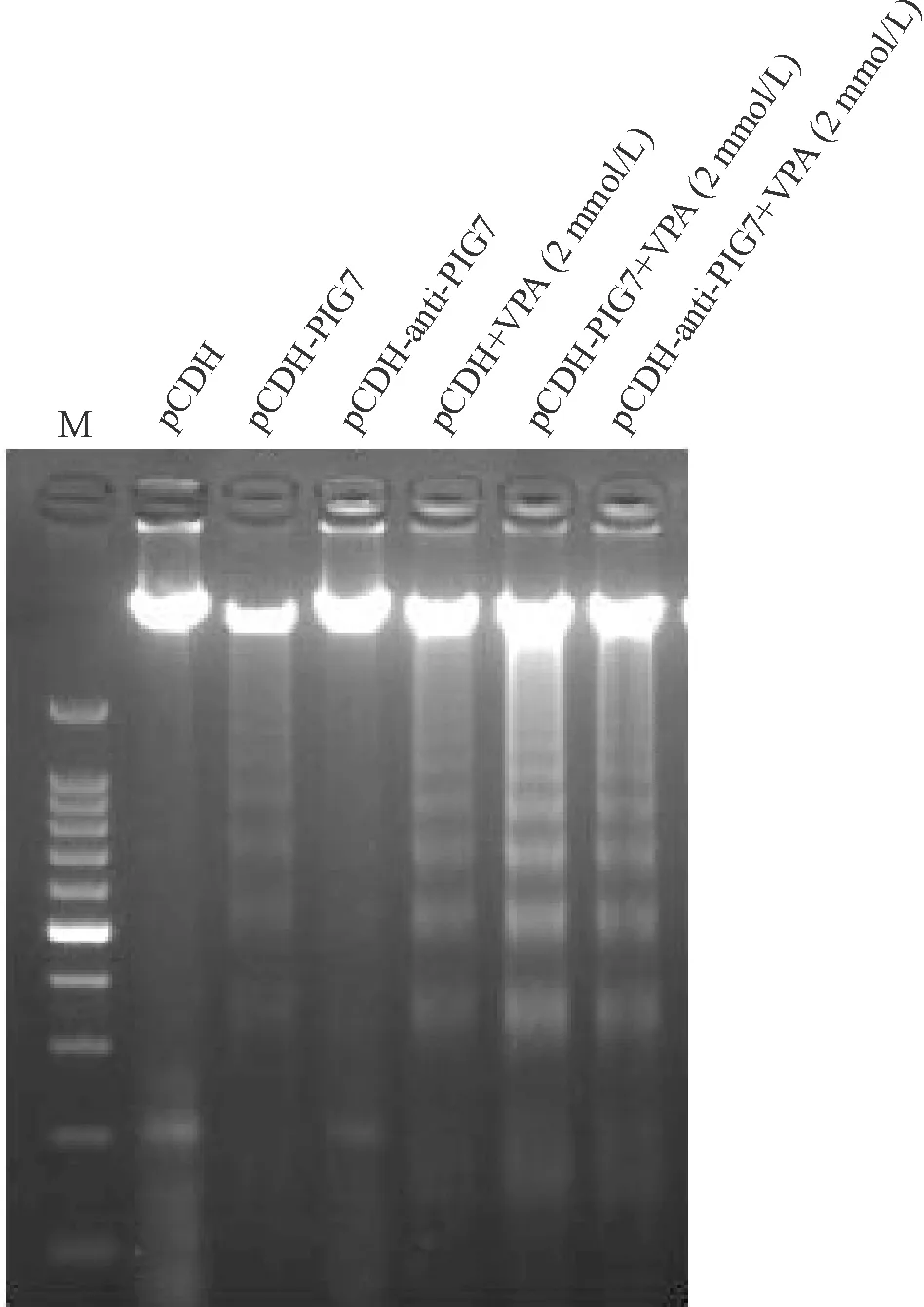
Figure 4. Typical DNA ladder was observed after lentivirus infection and VPA treatment in pCDH-PIG7 group and VPA group, especially in pCDH-PIG7+VPA group. No DNA ladder was observed in pCDH group and pCDH-anti-PIG7 group.M: marker.
图4病毒感染和VPA处理SKNO-1细胞后细胞凋亡的DNA梯形条带
讨 论
PIG7,又称脂多糖诱导的肿瘤坏死因子α因子(lipopolysaccharide-induced tumor necrosis factor-alpha factor,LITAF) 或 溶酶体/晚期内体小膜内在蛋白(small integral membrane protein of the lysosome/late endosome, SIMPLE),其羧基端含有高度保守的SIMPLE-样结构域,氨基端含有2个PPXY元件介导蛋白之间的相互作用。尽管其细胞定位和作用在不同细胞中并不一致,但大多研究认为其在LPS诱导的TNF-α表达过程中起转录激活作用,定位于晚期内体/溶酶体、高尔基体或细胞膜,参与蛋白分泌和降解途径[6-8]。
转录因子AML1在胚胎形成初期即已出现并广泛表达于所有造血细胞,它与抑癌因子核心结合因子β形成异二聚体,通过调节多种造血相关基因来促进造血干细胞的发育和分化。t(8;21)易位形成的特异性融合蛋白AML1-ETO作为转录抑制因子,异常募集核辅助抑制复合物N-CoR/mSin3/HDAC,使组蛋白脱乙酰化而抑制AML1靶基因的转录,干扰AML1的正常功能,抑制造血干/祖细胞分化成熟,是t(8;21) 急性髓系白血病发生的重要机制。HDACi通过抑制HDAC活性使组蛋白乙酰化,重新激活受抑制的基因,诱导多种肿瘤细胞生长阻滞、分化及凋亡。
研究发现VPA可有效地抑制肝癌细胞HepG2的增殖并诱导其发生线粒体依赖的凋亡,与地西他滨联合应用可显著促进胃癌细胞MGC-803的凋亡和G0/G1期的阻滞[9-10]。VPA已在临床用于治疗急性髓系白血病和骨髓增殖性疾病[11-12]。VPA可抑制P糖蛋白(P-gP) 和多药耐药相关蛋白(MRP1)高表达的白血病细胞增殖,并诱导其凋亡,但对Bcl-2高表达的白血病细胞却无能为力[13]。当VPA与Bcl-2的小分子配体HAl4-1联合应用时可促进高表达Bcl-2的人急性B细胞白血病BALL-1的凋亡,并明显延长接种了BALL-1细胞的NOD/SCID小鼠的生存期[14]。因而,对多种耐药白血病应探索新的联合用药方案。
我们的前期研究发现,作为一种HDACi,苯丁酸钠可以诱导t(8;21)白血病细胞系Kasumi-1分化、凋亡,同时伴有PIG7基因表达显著上调[4]。AML1能够与PIG7的启动子区结合并促进PIG7的转录和表达,AML1-ETO竞争性拮抗这种活化作用,过表达PIG7能够促进部分白血病细胞的分化和凋亡[15]。SKNO-1细胞来源于t(8;21)白血病患者,携带有特征性AML1-ETO融合蛋白。在SKNO-1细胞中过表达PIG7并加入VPA,SKNO-1细胞的分化和凋亡水平均比单纯转染PIG7或单用VPA显著升高,表明PIG7的过表达和VPA联合应用对带有AML1-ETO融合蛋白的白血病细胞的分化和凋亡具有协同效应,对于临床联合用药具有新的指导意义。推测PIG7和VPA联合应用可能通过PIG7部分封闭AML1-ETO的作用, 加上VPA抑制HDAC活性, 重新激活因AML1-ETO募集核辅助抑制复合物而表达受阻的基因,诱导白血病细胞的分化凋亡,二者具体作用机制还需更深入的研究。
[1] Abba MC, Drake JA, Hawkins KA, et al. Transcriptomic changes in human breast cancer progression as determined by serial analysis of gene expression [J]. Breast Cancer Res, 2004, 6(5):R499-R513.
[2] Mestre-Escorihuela C, Rubio-Moscardo F, Richter JA, et al. Homozygous deletions localize novel tumor suppressor genes in B-cell lymphomas [J]. Blood, 2007, 109(1):271-280.
[3] Kokkinakis DM, Brickner AG, Kirkwood JM, et al. Mitotic arrest, apoptosis, and sensitization to chemotherapy of melanomas by methionine deprivation stress [J]. Mol Cancer Res, 2006, 4(8):575-589.
[4] Wang D, Liu J, Tang K, et al. Expression ofpig7 gene in acute leukemia and its potential to modulate the chemosensitivity of leukemic cells [J]. Leuk Res, 2009, 33(1):28-38.
[5] Mottet D, Castronovo V. Histone deacetylases: target enzymes for cancer therapy [J]. Clin Exp Metastasis, 2008, 25(2):183-189.
[6] Moriwaki Y, Begum NA, Kobayashi M, et al.MycobacteriumbovisBacillus Calmette-Guerin and its cell wall complex induce a novel lysosomal membrane protein, SIMPLE, that bridges the missing link between lipopolysaccharide and p53-inducible gene,LITAF(PIG7), and estrogen-inducible gene,EET-1 [J]. J Biol Chem, 2001, 276(25):23065-23076.
[7] Eaton HE, Desrochers G, Drory SB, et al. SIMPLE/LITAF expression induces the translocation of the ubiquitin ligase itch towards the lysosomal compartments [J]. PLoS One, 2011, 6(2):e16873.
[8] Eaton HE, Metcalf J, Lacerda AF, et al. Accumulation of endogenous LITAF in aggresomes [J]. PLoS One, 2012, 7(1):e30003.
[9] Wang W, Liao XL, Chen JH, et al. Sodium valproate induces mitochondria-dependent apoptosis in human hepatoblastoma cells [J]. Chin Med J (Engl), 2011, 124(14):2167-2172.
[10] 张国强, 彭敏霞, 王晔恺, 等. 地西他滨联合丙戊酸钠促进胃癌MGC-803细胞凋亡和G0/G1期阻滞的机制研究[J]. 中国病理生理杂志,2012,28(10):1856-1860.
[11] Kuendgen A, Schmid M, Schlenk R, et al. The histone deacetylase (HDAC) inhibitor valproic acid as monotherapy or in combination with all-transretinoic acid in patients with acute myeloid leuke-mia [J]. Cancer, 2006, 106(1):112-119.
[12] Voso MT, Santini V, Finelli C, et al. Valproic acid at therapeutic plasma levels may increase 5-azacytidine efficacy in higher risk myelodysplastic syndromes [J]. Clin Cancer Res, 2009, 15(15):5002-5007.
[13] Tang R, Faussat AM, Majdak P, et al. Valproic acid inhibits proliferation and induces apoptosis in acute myeloid leukemia cells expressing P-gp and MRP1 [J]. Leukemia, 2004, 18(7):1246-1251.
[14] 薛红漫, 陈 纯, 张建瑜, 等. VPA联合HA14-1对Bcl-2高表达的BALL-1 细胞作用的实验研究[J]. 中国病理生理杂志, 2006, 22(11):2227-2230.
[15] Liu J, Xing H, Chen Y, et al. PIG7, transactivated by AML1, promotes apoptosis and differentiation of leukemia cells withAML1-ETOfusion gene [J]. Leukemia, 2012, 26(1):117-126.
PIG7andvalproicacidpromotedifferentiationandapoptosisofhumanleukemiaSKNO-1cells
XING Hai-yan, CHEN Yi-rui, LIU Jia-zhuo, TANG Ke-jing, TIAN Zheng, RAO Qing, WANG Min, WANG Jian-xiang
(StateKeyLaboratoryofExperimentalHematology,InstituteofHematology&BloodDiseaseHospital,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Tianjin300020,China.E-mail:wangjx@ihcams.ac.cn)
AIM: To investigate the synergistic effect of p53-inducible gene 7 (PIG7) and histone deacetylase (HDAC) inhibitor valproic acid (VPA) on the differentiation and apoptosis of human leukemia SKNO-1 cells.METHODSThe DNA fragments containingPIG7 open reading frame or antisense oligonucleotides were subcloned into lentiviral vector. SKNO-1 cells were transduced with prepared lentivirus. Transgene expression was detected by semi-quantitative RT-PCR and Western blotting. The expression of myeloid cell differentiation antigen CD11b and the apoptotic cells were analyzed by flow cytometry. DNA fragmentation analysis was also used to observe the apoptosis of SKNO-1 cells.RESULTSVPA inhibited the proliferation of SKNO-1 cells in a dose- and time-dependent manner. Compared with control group, the differentiation and apoptosis of SKNO-1 cells were significantly induced by ectopically expressed PIG7 (P<0.05). The apoptosis induced by ectopically expressed PIG7 was further enhanced by VPA treatment (P<0.05), and the typical DNA ladders were also observed. The proportion of CD11b+SKNO-1 cells notably increased after infection with lentivirus containingPIG7 as compared with empty vector group (P<0.05). Up-regulation of PIG7 also enhanced the susceptibility of the cells to the induction of differentiation by VPA.CONCLUSIONVPA inhibits the proliferation and induces the differentiation and apoptosis of SKNO-1 cells. Enforced expression of PIG7 enhances the differentiation and apoptosis of SKNO-1 cells and promotes the sensitivity of SKNO-1 cells to VPA. Over-expression of PIG7 combined with VPA may provide a new strategy for treatment of leukemia.
p53-inducible gene 7; Valproic acid; Histone deacetylase; Leukemia; Apoptosis
R733.7
A
10.3969/j.issn.1000- 4718.2013.06.009
1000- 4718(2013)06- 1009- 05
2012- 12- 05
2013- 05- 02
国家自然科学基金资助项目(No.30971290;No.81270635)
△通讯作者 Tel: 022-23909120; E-mail: wangjx@ihcams.ac.cn
▲共同第一作者
#现工作单位: 四川大学华西医院血液科, 四川 成都 610041

