骨髓间充质干细胞移植对心衰大鼠心肌组织中MMP-2、MMP-9和TIMP-1的影响*
吴志勇, 漆红梅, 罗 骏, 刘诗英, 万 勇, 周裔忠, 盛国太, 李华泰
(1江西省人民医院心内科, 2江西省心血管病研究所, 3南昌大学第一附属医院心内科, 4江西省高血压病研究所,5江西省人民医院神经内科, 6江西省神经病学研究所, 7江西省人民医院病理科, 江西 南昌330006)
骨髓间充质干细胞移植对心衰大鼠心肌组织中MMP-2、MMP-9和TIMP-1的影响*
吴志勇1,2△, 漆红梅3,4, 罗 骏1,2, 刘诗英5,6, 万 勇7, 周裔忠1,2, 盛国太1,2, 李华泰1,2
(1江西省人民医院心内科,2江西省心血管病研究所,3南昌大学第一附属医院心内科,4江西省高血压病研究所,5江西省人民医院神经内科,6江西省神经病学研究所,7江西省人民医院病理科, 江西 南昌330006)
目的探讨骨髓间充质干细胞(BMSCs)移植对心衰大鼠心肌组织中基质金属蛋白酶2(MMP-2)、MMP-9和金属蛋白酶组织抑制剂1(TIMP-1)的影响及机制。方法采用异丙肾上腺素(ISO)皮下注射的方法建立大鼠的心力衰竭模型,随机分成3组,每组8只,心肌内分别注射BMSCs(BMSCs组)、BMSCs条件培养液(BMSCs-CM组)及生理盐水(NS组)。RT-PCR检测3组心肌组织MMP-2、MMP-9和TIMP-1 mRNA的表达,Western blotting检测心肌组织MMP-2、MMP-9和TIMP-1蛋白,胞浆和胞核内核因子κB(NF-κB)的p65和p50,以及总蛋白中NF-κB抑制物(I-κB)和磷酸化NF-κB抑制物(p-IκB)蛋白表达水平。结果和NS组比较,BMSCs组和BMSCs-CM组MMP-2和MMP-9 mRNA和蛋白表达明显减弱(P<0.05),TIMP-1 mRNA和蛋白表达明显增强(P<0.05);而与BMSCs-CM组比较,BMSCs组MMP-2和MMP-9 mRNA和蛋白表达明显减弱(P<0.05),TIMP-1 mRNA和蛋白表达明显增强(P<0.05)。胞核中p65和p50蛋白表达,NS组明显多于BMSCs组和BMSCs-CM组(P<0.05);而胞浆中p65和p50蛋白表达,NS组明显少于BMSCs组和BMSCs-CM组(P<0.05)。和BMSCs-CM组比较,BMSCs组胞核中p65和p50蛋白表达明显升高(P<0.05);而胞浆中p65和p50蛋白表达,BMSCs组明显少于BMSCs-CM组(P<0.05)。NS组心肌组织总蛋白中p-IκB/IκB最高,明显多于BMSCs组和BMSCs-CM组(P<0.05),BMSCs组最低(P<0.05)。结论BMSCs及其在缺氧条件下的培养液均可通过改变NF-κB的抑制蛋白IκB的活性,从而改变心衰心肌细胞胞核中NF-κB含量,影响有关基因的转录,使得MMPs水平升高和TIMPs水平降低。
骨髓间充质干细胞; 条件培养液; 基质金属蛋白酶类; 金属蛋白酶组织抑制剂; 心力衰竭
心室重构是心力衰竭发生的主要机制,其中最重要的是在神经-内分泌因素的作用下细胞外基质重构,从而发生心肌纤维化和进行性心室扩张,最终导致心力衰竭[1]。其中心肌组织中的基质金属蛋白酶(matrix metalloproteinases,MMPs)及其组织抑制剂(tissue inhibitor of metalloproteinases,TIMPs)活性及表达失衡是影响心室重构的重要因素之一[2-3]。同时研究发现骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)可分化为心肌细胞及影响细胞外基质代谢,从而逆转心室重构、改善心脏功能[4-5]。但BMSCs移植对MMPs和TIMPs的影响由于研究方法不同导致结论不一致。本研究采用异丙肾上腺素(isoproterenol,ISO)皮下注射的方法建立大鼠的心力衰竭模型,通过心肌内分别注射BMSCs以及在缺氧条件下的BMSCs培养液(BMSCs-conditioned medium,BMSCs-CM)对比观察心肌组织中基质金属蛋白酶 9(matrix metalloproteinase-9,MMP-9)、MMP-2及金属蛋白酶组织抑制剂 1(tissue inhibitor of metalloproteinase-1,TIMP-1)的变化,进一步探讨BMSCs移植对细胞外基质重构影响的可能机制。
材 料 和 方 法
1材料与试剂
100~150 g雄性Wistar大鼠购自南昌大学实验动物中心,10%胎牛血清(fetal bovine serum,FBS)、DMEM培养液、Percoll’s液(密度1 073 g/L)、裂解液(0.5 mol/L Tris-HCl, 0.2 mol/L NaCl, 10 mmol/L CaCl2, 1% Triton X-100, 100 mg/L PMSF)均购自南京维森特生物技术(中国)有限公司,全蛋白抽提试剂盒和胞浆蛋白抽提试剂盒、胞核蛋白抽提试剂盒均购自南京凯基生物公司, 低糖DMEM培养基、 Wistar大鼠成骨诱导完全培养基和Wistar大鼠成脂诱导完全培养基均购自广州赛业生物科技公司,β-actin、MMP-2、MMP-9、TIMP-1Ⅰ抗和Ⅱ抗均购自北京博奥森生物技术有限公司,NF-κB p65、NF-κB抑制物(inhibitor of κB, IκB)、磷酸化NF-κB抑制物(phosphorylated IκB, p-IκB)Ⅰ抗和Ⅱ抗均购自南京凯基生物有限公司,NF-κB p50Ⅰ抗和Ⅱ抗购自上海超研生物科技有限公司,辣根过氧化物酶标记Ⅱ抗,BCIP/NBT碱性磷酸酶显色液购自上海碧云天生物公司,Bio-Rad凝胶成像系统(Kodak),流式细胞仪(FACSCalibar, BD)。
2方法
2.1模型建立及分组 取100~150 g雄性Wistar大鼠采用异丙肾上腺素皮下注射方法建立心力衰竭模型,实验处置符合动物伦理学标准。建模具体方法参考文献[6-7]。异丙肾上腺素用生理盐水稀释成浓度为85 mg/L,按170 mg·kg-1·d-1的剂量连续给药4 d。4 d后行超声心动图的测定,左心室射血分数<70%的大鼠定义为心衰建模成功。
建模成功者随机分成3组,每组8只,分别心肌内注射BMSCs(BMSCs组)、BMSCs条件培养液(BMSCs-CM组)及生理盐水(normal saline,NS组)。
2.2BMSCs的分离、纯化、扩增及培养和BMSCs-CM的制备
2.2.1BMSCs的分离、纯化、扩增及培养 取80 g雄性Wistar大鼠,经麻醉处死,消毒后无菌条件下采集双侧股骨、胫骨,去除周围肌肉组织后放入35 mm无菌塑料培养皿,切除两侧骨端部,用吸有10% FBS的DMEM培养液的注射器冲洗骨髓腔,200目不锈钢滤网过滤骨髓液,用Percoll’s液梯度离心(2 400 r/min,离心10 min)。将上述单个核细胞层用含10%胎牛血清的低糖DMEM培养基重新悬浮细胞,调整细胞密度以5×108/L密度接种于50 mL的培养瓶中,置37 ℃、5%CO2培养箱中培养。24 h后换液,弃去未贴壁细胞,以后每3 d换液1次,细胞增殖值接近融合80%时用0.25%胰蛋白酶消化传代,反复传代纯化细胞。分别以形态学和功能学指标鉴定BMSCs,方法如下:(1)倒置显微镜下观察细胞生长及形态特征。(2)成骨诱导培养:将BMSCs置于6孔板中培养至80%~90%融合后,弃旧培养基,加入2 mL/well的成骨诱导完全培养基继续培养。每3 d换液,连续观察,诱导3周后,茜素红染色,甲醛固定,拍照。(3)成脂诱导培养:将BMSCs置于六孔板中培养至80%-90%融合后,弃旧培养基,加入2 mL/well的成脂诱导完全培养基A继续培养。3 d后更换为成脂诱导完全培养基B,维持24 h后,再次更换为成脂诱导完全培养基A,如此进行3个循环。油红O染色,甲醛固定,拍照。(4)取接近融合的第4代BMSCs, 用0.25%胰酶消化后,用pH 7.2 PBS 洗涤2次,然后用流式细胞仪检测细胞表面标志(按试剂操作说明完成)。
2.2.2BMSCs-CM的制备 培养第2~5代BMSCs用PBS漂洗2次,去除残留的完全培养基,加入不含胎牛血清的DMEM培养液,然后将细胞置于可调氧浓度的培养箱,2% O2、无菌条件下收集6 h的培养液,置-70 ℃冻存备用。
2.2.3BMSCs、BMSCs-CM和NS心肌内注射 3%戊巴比妥钠(30 mg/kg)经腹腔注射麻醉、气管插管连接呼吸机机械通气。无菌条件下在胸骨左缘胸肋关节处剪断第2~4肋骨开胸,剪开心包膜,用小拉钩将心包膜固定于胸壁,充分暴露心脏。3组心衰大鼠分别在左室前壁按“米”形用微量注射器注射BMSCs、BMSCs-CM及生理盐水,每点分别注射25 μL,共200 μL。注射结束后,关胸,维持辅助呼吸至自主呼吸恢复,腹腔注射青霉素1周,预防感染。送饲养笼中饲养6周。
2.3RT-PCR检测心肌组织MMP-2、MMP-9和TIMP-1 mRNA的表达 引物序列及反应条件见表1。取5 μL PCR产物于1 μL 6× loading buffer中,点样于1.5%琼脂糖凝胶电泳,80 V、50 min。紫外灯下观察,凝胶成像系统(Kodak)拍照,进行吸光度扫描读数,计算目的基因mRNA与β-actin mRNA的比值。

表1 引物序列及反应条件
2.4Western blotting检测心肌组织MMP-2、MMP-9和TIMP-1蛋白的表达 取相同部位的左心室组织于液氮中研磨,加入裂解液(0.5 mol/L Tris-HCl, 0.2 mol/L NaCl, 10 mmol/L CaCl2, 1%Triton X-100,100 mg/L PMSF),4 ℃下作用30 min,离心、提取蛋白。取含50 μg总蛋白的样品进行非连续SDS-PAGE电泳分离蛋白,将凝胶上的蛋白转移到PVDF膜上,封闭,Ⅰ抗孵育、漂洗;Ⅱ抗孵育(β-actin和MMP-2为兔抗IgG, MMP-9为羊抗鼠IgG)、漂洗。BCIP/NBT碱性磷酸酶显色液进行显色。Bio-Rad凝胶成像系统照相,测定条带的吸光度,计算目的条带与β-actin比值。
2.5Western blotting检测心肌组织中NF-κB活性 取3组大鼠注射部位周边区心肌组织100 mg,剪成2 mm×2 mm×2 mm大小的碎块,放入冰预冷的玻璃匀浆器匀浆后,分别按照总蛋白、胞浆蛋白和胞核蛋白试剂盒的操作方法提取, BCA法测定蛋白,分装并置于-80 ℃保存备用。分取3种蛋白10 μL,常规电泳,转膜,封闭后分别加入NF-κB p65、NF-κB p50、IκB和p-IκB的Ⅰ抗,4 ℃轻摇过夜,洗膜,加入辣根过氧化物酶标记Ⅱ抗,化学发光试剂增强反应,X线压片曝光,用GSDS000密度扫描分析系统分析图像,计算胞浆内及胞核内p65和p50以及总蛋白中IκB、p-IκB蛋白表达水平。
3统计学处理
采用SPSS 13.0统计软件进行统计学处理,计量资料以均数±标准差(mean±SD)表示。各组数据进行正态性检验和方差齐性检验,组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1BMSCs形态观察和流式细胞术检测
分离获得的BMSCs形态较为均一,呈圆形、三角形。培养细胞形态均匀,与成纤维细胞形态相似,大部分呈长梭形,排列规则,见图1A、B。BMSCs经成骨诱导3周后可见钙结节明显形成,茜素红染色阳性,见图1C。BMSCs经成脂诱导3周后可见脂滴聚集,油红O染色阳性,见图1D。
Figure 1. Morphological indentification of BMSCs. A: BMSCs cultured for 24 h were roughly spherical or triangle (inverted microscope,×200); B: the 3rd generation of BMSCs were of spindle shape, and showed circinate or interlaced arrangement(inverted microscope,×200); C: BMSCs were positive for alizarin red staining (×40); D: BMSCs were positive for oil red O staining (×200).
图1BMSCs形态学鉴定
流式细胞术检测传代BMSCs中CD44阳性细胞为96.96%,CD34阳性细胞为0.23%,CD45阳性细胞为0.24%,结合形态学观察证实本实验分离培养的细胞为BMSCs,见图2。

Figure 2. Antigen expression of rat BMSCs tested by flow cyto-metry.A: CD45; B: CD44 and CD34.
图2流式细胞术检测大鼠BMSCs抗原的表达
2心肌组织MMP-9、MMP-2和TIMP-1mRNA测定
RT-PCR分析结果显示,和NS组比较,BMSCs组和BMSCs-CM组MMP-2和MMP-9 mRNA表达明显减弱(P<0.05),TIMP-1 mRNA表达明显增强(P<0.05);与BMSCs-CM组比较,BMSCs组MMP-2和MMP-9 mRNA表达明显减弱(P<0.05),TIMP-1 mRNA表达明显增强(P<0.05),见图3。
3心肌组织MMP-9、MMP-2和TIMP-1蛋白表达
Western blotting分析结果显示,和NS组比较,BMSCs组和BMSCs-CM组MMP-2和MMP-9蛋白的表达明显减弱(P<0.05),TIMP-1蛋白的表达明显增强(P<0.05);与BMSCs-CM组比较,BMSCs组MMP-2和MMP-9蛋白的表达明显减弱(P<0.05),TIMP-1蛋白的表达明显增强(P<0.05),见图4。
4心肌组织NF-κB活性及p-IκB/IκB比值变化
4.1心肌细胞胞浆、胞核内NF-κB p65和p50蛋白表达水平比较 通过检测胞浆和胞核蛋白中NF-κB 2个亚基p65和p50,了解心肌组织NF-κB活性变化,见图5、6。胞核中p65和p50蛋白表达,NS组明显多于BMSCs组和BMSCs-CM组(P<0.05);而胞浆中p65和p50蛋白表达,NS组明显少于BMSCs组和BMSCs-CM组(P<0.05)。BMSCs组和BMSCs-CM组比较,BMSCs组胞核中p65和p50蛋白表达明显高于BMSCs-CM组(P<0.05);而胞浆中p65和p50蛋白表达,BMSCs组明显少于BMSCs-CM组(P<0.05)。

Figure 3. The mRNA expression of MMP-9, MMP-2 and TIMP-1 in the 3 groups detected by RT-PCR.1: BMSCs group; 2: BMSCs-CM group; 3: NS group.Mean±SD.n=8.*P<0.05vsNS group;#P<0.05vsBMSCs-CM group.
图3RT-PCR检测心肌组织MMP-9、MMP-2及TIMP-1mRNA的表达
4.2心肌细胞中p-IκB/IκB比值变化 3组心肌组织总蛋白中p-IκB/IκB比值各不相同,其中NS组最高,明显多于BMSCs组和BMSCs-CM组(P<0.05);BMSCs组最低(P<0.05),见图7。
讨 论
研究发现MMPs/TIMPs系统的改变在心力衰竭心室重构中发挥重要的作用。MMPs作为一种内源性锌依赖性酶家族,不仅在间质成分的降解中起重要作用,同时还参与胶原的合成。而TIMPs作为MMPs的内源性特异性抑制剂,其底物广泛,其作用与MMPs构成一动态平衡系统共同维持心血管基质的分解与重塑。临床研究发现如扩张性心肌病、致心律失常型右室心肌病等心力衰竭患者心肌MMPs/TIMPs比值增加,具体表现为MMPs水平的升高和TIMPs水平的降低[8],而给予与左室辅助泵等治疗措施后心肌MMPs/TIMPs比值趋于正常[9]。因此,MMPs/TIMPs比值的改变与心室重构和心功能改变存在因果关系。本研究中的大鼠模型中也同样表现为MMPs水平的升高和TIMPs水平的降低,与既往的研究报道相一致[10]。
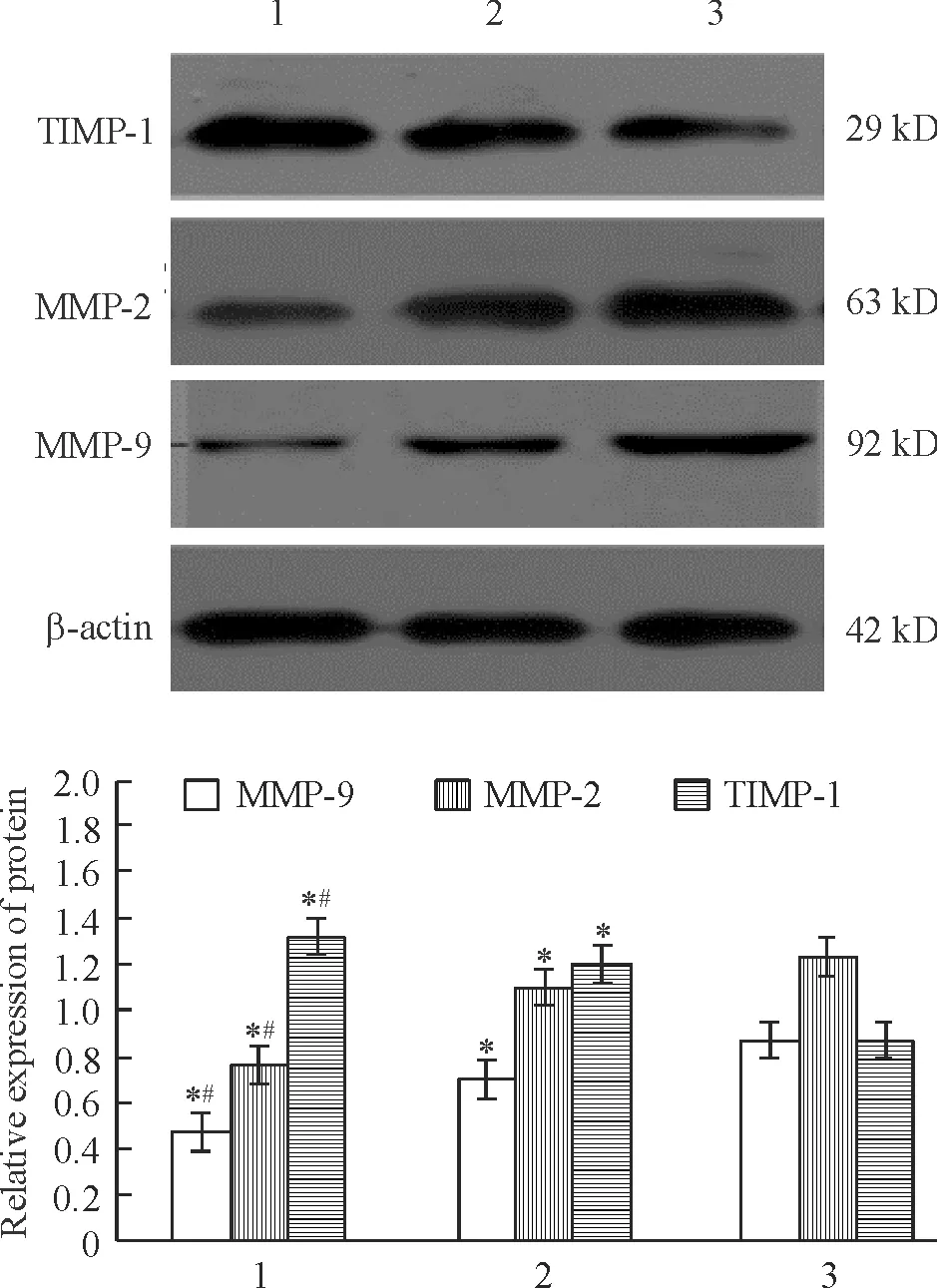
Figure 4. The protein expression of MMP-9, MMP-2 and TIMP-1 in the 3 groups measured by Western blotting.1: BMSCs group; 2: BMSCs-CM group; 3: NS group.Mean±SD.n=8.*P<0.05vsNS group;#P<0.05vsBMSCs-CM group.
图4Westernblotting检测心肌组织MMP-9、MMP-2及TIMP-1蛋白的表达

Figure 5. The protein expression of NF-κB p65 and p50 in nuclear extraction(NE) of cardiomyocytes in the 3 group. Mean±SD.n=8.*P<0.05vsNS group;#P<0.05vsBMSCs-CM group.
图5心肌细胞胞核内NF-κBp65和p50蛋白的表达
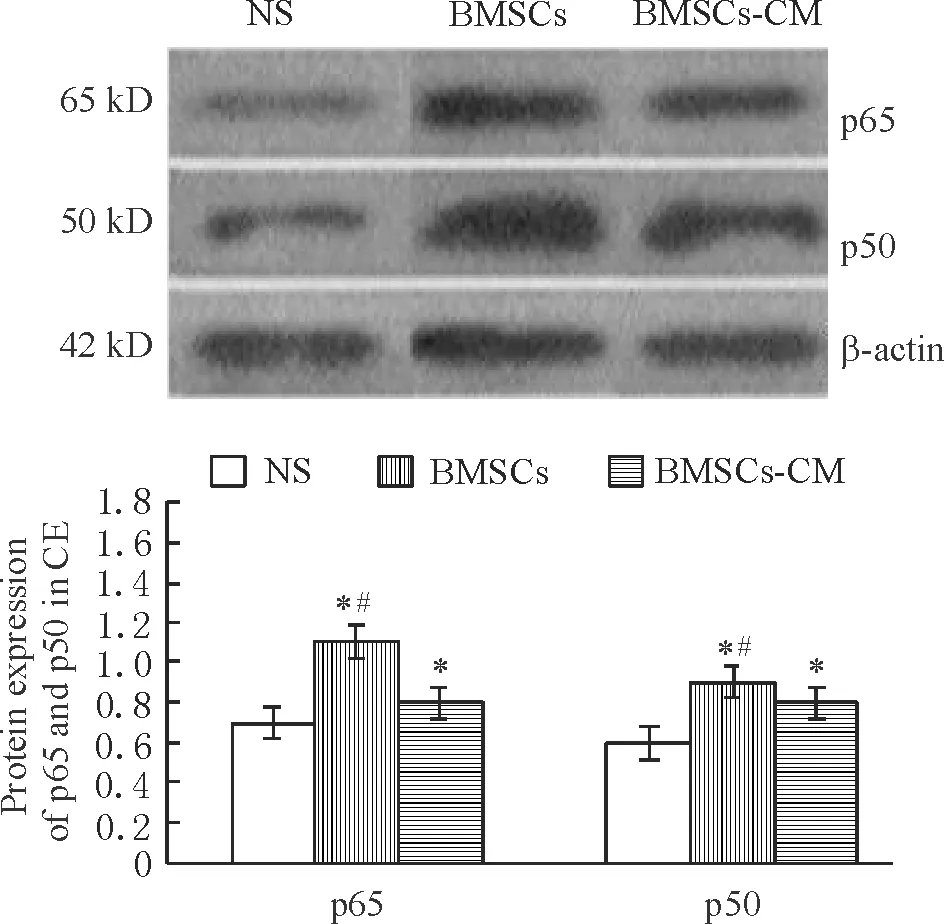
Figure 6. The protein expression of NF-κB p65 and p50 in cytosol extraction(CE) of cardiomyocytes in the 3 groups. Mean±SD.n=8.*P<0.05vsNS group;#P<0.05vsBMSCs-CM group.
图6心肌细胞胞浆内NF-κBp65和p50蛋白的表达

Figure 7. p-IκB/IκB in total myocardium protein in the 3 groups. Mean±SD.n=8.*P<0.05vsNS group;#P<0.05vsBMSCs-CM group.
图7心肌细胞p-IκB/IκB比值的变化
BMSCs治疗心力衰竭的研究已经成为当今研究的热点,推测其可能通过直接向心肌细胞分化或通过旁分泌等机制抑制心室扩张和心室重构,改善心功能。但关于BMSCs对心衰过程中细胞外基质影响的确切机制有待进一步明确。
本研究结果首先证实,不管是BMSCs本身,还是其在离体状态、特定条件下分泌的生物活性物质,对心衰大鼠模型的心肌组织中的MMPs/TIMPs系统均可产生影响。BMSCs-CM是间充质干细胞对生存环境的反映。BMSCs离体培养环境的不同,BMSCs-CM所含有成分及量可能不同。BMSCs-CM可能是通过含有多种生物活性物质的聚集体发挥作用的[11]。有研究报道真核细胞在激活或者凋亡过程中可衍生膜微粒[12-13],其可通过携带的生物活性物质和表面受体、细胞因子以及信号蛋白、mRNA、miRNA等传递遗传信息[14-15]。其可作为一种细胞应激信号,调节旁细胞或远处靶细胞的功能如:调节炎症与凝血的发生、免疫反应、组织修复及细胞间信息的转导[16]。
同时,本研究结果也证实BMSCs或其特定的条件培养液对心室重构这一的病理生理过程中细胞外基质代谢的影响是通过NF-κB的信号转导途径影响MMPs/TIMPs系统而发挥作用。过去的研究已经证实对于在静息状态的心肌细胞,NF-κB与抑制蛋白IκB结合,以非活化形式存在于细胞浆中[17]。而心衰的病理进程中的心肌细胞受到活化信号刺激作用,IκB发生磷酸化,与NF-κB分离,随后NF-κB转移到核内,因此胞核蛋白中NF-κB的2个亚基p65和p50明显增多,而胞浆中p65和p50蛋白减少。本研究结果也证实了这一点。本研究中NS组的心肌细胞总蛋白中p-IκB/IκB比值、胞核蛋白中p65和p50蛋白表达均明显多于BMSCs组和BMSCs-CM组。而从BMSCs组和BMSCs-CM组的结果推测BMSCs及由其分泌的生物活性物质改变NF-κB的抑制蛋白IκB的活性,使对NF-κB的抑制作用解除,在胞核、胞浆里重新发生分布,改变心肌细胞胞核中NF-κB含量,影响细胞核内靶基因启动区或增强子上的NF-κB的结合位点,从而调控有关基因的转录。在本研究中在BMSCs组和BMSCs-CM组MMP-2和MMP-9的mRNA及相应的蛋白表达明显减弱,TIMP-1 mRNA及相应的蛋白表达明显增强,也就证实这点。
此外,本研究结果也提示BMSCs移植比单纯的BMSCs-CM移植对心衰大鼠模型心肌组织中的NF-κB信号转导途径和MMPs/TIMPs系统影响更为明显,其中原因可能与下列因素有关:(1)由于与NF-κB的信号转导途径、MMPs/TIMPs系统之间可能存在正反馈机制,因此即使MSCs移植后直接分化为心肌细胞的量据研究报道非常微小,但对最终影响还是非常明显。(2)体外研究也证实心肌微环境中的心肌细胞分泌的细胞因子以及间质细胞所产生的某些生长因子或配体,可能通过细胞内的信号转导途径控制着BMSCs的分化和成熟,但具体机制和途径不确定[18]。本研究证实在心力衰竭的心肌微环境下,BMSCs可分泌与在缺氧状态下的BMSCs-CM相类似的生物活性物质,而且可通过NF-κB的信号转导途径促使MMPs/TIMPs系统向改善心室重构的方向进行。(3)与此同时,本研究中也发现在心力衰竭的心肌微环境下,BMSCs分泌的生物活性物质在成分或质量方面较在缺氧状态下的BMSCs-CM更有利MMPs/TIMPs系统向改善心室重构的方向进行。
但目前有关BMSCs-CM的成分非常复杂,如果能获取一种间充质干细胞释放膜微粒稳定方法,明确其含有成分及作用,便使一种间充质干细胞新的治疗方法成为现实。
[1] Ouzounian M, Lee DS, Liu PP. Diastolic heart failure: mechanisms and controversies[J]. Nat Clin Pract Cardiovasc Med, 2008, 5(7):375-386.
[2] Nagase H, Visse R, Murphy G. Structure and function of matrixmetall-proteinases and TIMPs[J]. Cardiovasc Res, 2006, 69(3): 562-573.
[3] 曾 山, 周 欣, 胡海鹰, 等.基质金属蛋白酶及其组织型抑制剂活性及表达失衡与高血压性左心室重塑的关系[J]. 中国病理生理杂志,2008, 24(12): 2333-2338.
[4] Ohnishi S, Yanagewa B, Tanaa K, et al. Transplantation of mesenchymal stem cells attenuates myocardial injury and dysfunction in a rat model of acute myocarditis[J].Mol Cell Cardiol, 2007, 42(1):88-97.
[5] Hu X, Wang J, Chen J, et al. Optimal temporal delivery of bone marrow mesenchymal stem cells in rats with myocardial infarction[J].Eur J Cardiothorac Surg, 2007,31(3):438-443.
[6] Teerlink JR,Pfeffer JM,Pfeffer MA. Progressive ventricular remodeling in response to diffuse isoproterenol-induced myocardial necrosis in rats[J].Circ Res,1994,75(1):105-113.
[7] Brooks WW, Conrad CH. Isoproterenol-induced myocardial injury and diastolic dysfunction in mice: structural and functional correlates[J]. Comp Med,2009, 59(4):339-343.
[8] Spinale FG, Coker ML, Heung LJ, et al. A matrix metalloproteinase induction/activation system exists in the human left ventricular myocardium and is upregulated in heart failure[J]. Circulation, 2000, 102(16): 1944-1949.
[9] Klotz S, Foronjy RF, Dickstein ML , et al. Mechanical unloading during left ventricular assist device support in creases left ventricular collagen cross-linking and myocardial stiffness[J]. Circulation, 2005,112 (3): 364-374.
[10] Dai W, Hale SL, Martin BJ, et al. Allogeneic mesenchymal stem cell transplantation in post infarcted rat myocardium: short- and long-term effects[J].Circulation, 2005,112(2): 214-223.
[11] Kinnaird T, Stabile E, Burnett MS,et al. Marrow-derived stromal cells express genes encoding a broad spectrum of arteriogenic cytokines and promoteinvitroandinvivoarteriogenesis through paracrine mechanisms[J].Circ Res,2004,94(5):678-685.
[12] Zwaal RF, Comfurius P, Bevers EM. Surface exposure of phosphatidylserine in pathological cells[J]. Cell Mol Life Sci, 2005, 62(9): 971-988.
[13] Distler JH, Huber LC, Hucerber LC, et al. The release of microparticles by apoptotic cells and their effects on macrophages [J].Apoptosis, 2005, 10(4):731-741.
[14] Hunter MP, Ismail N, Zhang X, et al. Detection of microRNA expression in human peripheral blood microvesicles [J].PLoS One, 2008, 3(11):e3694.
[15] Mause SF, Weber C. Microparticles: protagonists of a novel communication network for intercellular information exchange[J].Circ Res, 2010,107(9):1047-1057.
[16] Shai E, Varon D. Development, cell differentiation, angiogenesis: microparticles and their roles in angiogenesis[J]. Arterioscler Thromb Vasc Biol,2011,31(1):10-14.
[17] Finco TS, Baldwin AS. Mechanistic aspects of NF-κB re-gulation: the emerging role of phosphorylation and proteolysis[J]. Immunity,1995, 3(3):263-272.
[18] 董红燕,周中新,张中明. 内皮素- 1促进兔骨髓间质干细胞诱导分化为心肌样细胞[J]. 中国病理生理杂志,2004, 20(12): 2213-2218.
EffectsofbonemarrowmesenchymalstemcelltransplantationonexpressionofMMP-2,MMP-9andTIMP-1inmyocardiumofheartfailurerats
WU Zhi-yong1, 2, QI Hong-mei3, 4, LUO Jun1, 2, LIU Shi-ying5, 6, WAN Yong7, ZHOU Yi-zhong1, 2, SHENG Guo-tai1, 2, LI Hua-tai1, 2
(1DepartmentofCardiology,People’sHospitalofJiangxiProvince,2InstituteofCardiovascularMedicineofJiangxiPro-vince,3DepartmentofCardiology,TheFirstAffiliatedHospitalofNanchangUniversity,4HypertensionInstituteofJiangxiProvince,5DepartmentofNeurology,People’sHospitalofJiangxiProvince,6InstituteofNeurologicMedicineofJiangxiPro-vince,7DepartmentofPathology,People’sHospitalofJiangxiProvince,Nanchang330006,China.E-mail:wuzhiyong76@163.com)
AIM: To study the effects of bone marrow mesenchymal stem cell (BMSC) transplantation on matrix metalloproteinase-2 (MMP-2), matrix metalloproteinase-9 (MMP-9) and tissue inhibitor of metalloproteinase-1 (TIMP-1) in the myocardium of heart failure rats.METHODSHeart failure model was established by subcutaneous injection of isoproterenol consecutively in Wistar rats. The rats were randomly divided into 3 groups (8 rats each group) and were implanted with BMSCs (BMSCs group), BMSCs-conditioned medium (BMSCs-CM group) and normal saline (NS group), respectively. Six weeks after transplantation, RT-PCR and Western blotting analysis were used to observe the expression of MMP-2, MMP-9 and TIMP-1 in the myocardium at mRNA and protein levels. Western blotting was also used to determine the protein levels of NF-κB p65 and p50 in nuclear extraction (NE) and cytosol extraction (CE), and the protein levels of IκB and p-IκB in the myocardium.RESULTSCompared with saline group, the expression of MMP-2 and MMP-9 was decreased significantly, and the expression of TIMP-1 was increased obviously in BMSCs group and BMSCs-CM group at mRNA and protein levels. The expression of MMP-2 and MMP-9 at mRNA and protein levels in BMSCs group were significantly lower than that in BMSCs-CM group, but the expression of TIMP-1 at mRNA and protein levels in BMSCs group was obviously higher than that in BMSCs-CM group. Compared with BMSCs group and BMSCs-CM group, the expression of NF-κB p65 and p50 in NE in NS group was significantly higher.However, the expression of NF-κB p65 and p50 in CE in NS group was lower than that in BMSCs group and BMSCs-CM group. Compared with BMSCs-CM group, the protein levels of NF-κB p65 and p50 in NE in BMSCs group were increased, but the protein levels of NF-κB p65 and p50 in CE in BMSCs group were decreased. The value of p-IκB/IκB in NS group was the highest, and that in BMSCs group was the lowest in the 4 groups.CONCLUSIONThe transplantations of BMSCs and BMSCs-CM both increase the levels of MMP-2 and MMP-9, and decrease the level of TIMP-1 in the myocardium of heart failure rats. BMSCs and BMSCs-CM can change the level of NF-κB in NE by inhibiting the activity of IκB to influence the gene transcription.
Bone marrow mesenchymal stem cells; Conditioned medium; Matrix metalloproteinases; Tissue inhibitor of metalloproteinases; Heart failure
R361.1
A
10.3969/j.issn.1000- 4718.2013.06.003
1000- 4718(2013)06- 0975- 07
2012- 11- 08
2013- 04- 28
江西省卫生厅科技计划课题(No. 20113012)
△通讯作者 Tel: 0791-86892180; E-mail: wuzhiyong76@163.com

