甜菜碱对老龄db/db小鼠脂肪性肝损害的影响*
刘光洁, 刘光泽, 兰 丹, 陈媚娟, 廖汉雄, 刘海霞, 邹清雁△
(1长春师范学院计算机科学与技术学院,吉林 长春 130032; 2解放军第四五八医院全军肝病中心,广东 广州 510602;3广州诺金制药有限公司,广东 广州 511356; 4广州赛吉生物科技有限公司,广东 广州 510663)
·短篇论著·
甜菜碱对老龄db/db小鼠脂肪性肝损害的影响*
刘光洁1, 刘光泽2, 兰 丹4, 陈媚娟2, 廖汉雄3, 刘海霞4, 邹清雁4△
(1长春师范学院计算机科学与技术学院,吉林 长春 130032;2解放军第四五八医院全军肝病中心,广东 广州 510602;3广州诺金制药有限公司,广东 广州 511356;4广州赛吉生物科技有限公司,广东 广州 510663)
目的通过高脂饮食诱发db/db小鼠非酒精性脂肪性肝病(NAFLD)模型,探索甜菜碱对遗传性小鼠脂肪肝脂质代谢的影响。方法50只7月龄db/db鼠随机分为低、中、高剂量组、生理盐水对照组和阳性药物组。所有小鼠均饲以高脂饲料, 以诱发NAFLD 模型。 小鼠分别以200 mg/kg(低剂量组)、400 mg/kg(中剂量组)和800 mg/kg(高剂量组)甜菜碱溶液灌胃,连续6周。测定血清丙氨酸氨基转移酶(ALT)、甘油三酯(TG)、总胆固醇(TC)和低密度脂蛋白(LDL)水平,并行葡萄糖耐量测定和肝组织病理学观察。结果甜菜碱可显著降低血清ALT、TC和LDL的水平(P<0.05或P<0.01)。组织学结果表明甜菜碱可显著减少小鼠肝细胞的脂肪样变性。结论甜菜碱可以显著改善老龄db/db小鼠的脂类代谢紊乱和肝功能,明显降低脂肪在肝细胞中的积蓄。
甜菜碱; 非酒精性脂肪性肝病;db/db小鼠
非酒精性脂肪肝(nonalcoholic fatty liver,NAFL) 又称非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD),是发病率和复发率均较高的常见病,其确切的病因和发病机制仍不完全明了。随着社会经济的发展和人们饮食结构、生活方式的变化,与脂代谢异常密切相关的非酒精性脂肪性肝病的发病率大幅度上升。虽然认为NAFLD是无痛性的良性病变,但确有相当一部分病例具有隐匿地向肝纤维化、肝硬化发展的特点,因此NAFLD的防治工作受到国内外的广泛重视[1-4],目前还缺乏统一有效的药物治疗方案。
甜菜碱(betaine)作为一种高效甲基供体,在弥补人类甲基化功能不足方面(如甲基四氢叶酸还原酶缺失)起着重要的作用。有关文献研究发现甜菜碱可增加S-腺苷甲硫氨酸水平,具有改善NAFL的作用[5-9]。众多学者认为NAFLD是一种遗传性疾病,但甜菜碱能否对人类遗传性脂肪肝有效及治疗效果还缺乏相关动物实验研究。
db/db小鼠是国内外最常用的遗传性脂肪肝模型,由小鼠瘦素受体基因的自然突变所诱发。这种小鼠不能产生饱感,即对饱感物质(瘦素)缺乏反应, 易多食,引起脂肪堆积而肥胖;逐渐可导致过度摄食、肥胖、高脂血症和脂肪肝。本研究以老龄(7月龄)db/db小鼠为模型,观察甜菜碱对遗传性小鼠脂肪肝的影响,旨在探索甜菜碱作为药物治疗有遗传背景NAFLD的可能性。
材 料 和 方 法
1材料
1.1动物db/db小鼠和正常db/m小鼠,由中国人民解放军第四五八医院全军肝病研究中心转基因动物实验室提供。
1.2材料 甜菜碱由广州赛吉生物科技有限公司提供;地奥脂必妥片由成都地奥九泓制药厂生产;哺乳动物组织蛋白质抽提试剂 LY005 MT-Cel-Lytics和BCA-100 蛋白质定量测定试剂盒由上海博彩生物科技有限公司提供;游离脂肪酸测定试剂盒(南京建成生物科技有限公司);高脂饲料(D12331, Research diets生产)。
2方法
2.1动物模型及分组 50只db/db小鼠,饲喂高脂饲料1个月后,以肥胖、血清总胆固醇(total cholesterol,TC)≥3.0 mmol/L和丙氨酸氨基转移酶(alanine aminotransferase,ALT)≥120 U/L的db/db小鼠入选。随机分为低剂量组(灌胃甜菜碱200 mg/kg)、中剂量组(灌胃甜菜碱400 mg/kg)、高剂量组(灌胃甜菜碱800 mg/kg)、生理盐水组(灌胃等体积的生理盐水)和阳性药物组(灌胃等脂必妥水剂400 mg/kg);每组10只,持续饲养实验周期为6周。
2.2检测指标
2.2.1体重和肝脏指数 每周称重,喂养6周后,禁食12 h后收集血清,肝脏称重。肝脏指数(%)=肝脏质量/体重×100%。
2.2.2眼眶采血,离心收集血清做生化分析,测定血清谷ALT、TC、甘油三酯(triglyceride,TG)和低密度脂蛋白(low-density lipoprotein,LDL)等生化指标。
2.2.3葡萄糖水平和静脉葡萄糖耐量试验(intravenous glucose tolerance test,IGTT) 安乐死前2周,实验动物禁食过夜,采血检测血浆葡萄糖水平,最后1周进行IGTT检测。
2.2.4组织形态学检测 对肝脏组织进行冰冻切片和油红O染色以观察肝脏细胞中脂质的累积情况;另取一部分肝脏组织固定,HE染色,以观察肝组织形态学的变化。
3统计学处理
采用SPSS 13.0软件包进行统计学分析,数据以均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1甜菜碱对db/db小鼠体重和肝脏指数的影响
db/db小鼠经甜菜碱药物灌胃6周时,每周称取体重1次。各组老龄实验鼠体重虽均呈下降趋势,但经统计分析,组间各个时点体重比较均无显著差异。甜菜碱低、中、高剂量组小鼠的体重与对照组相比无显著差异,表明甜菜碱对老龄实验鼠体重无明显影响(P>0.05),见表1。
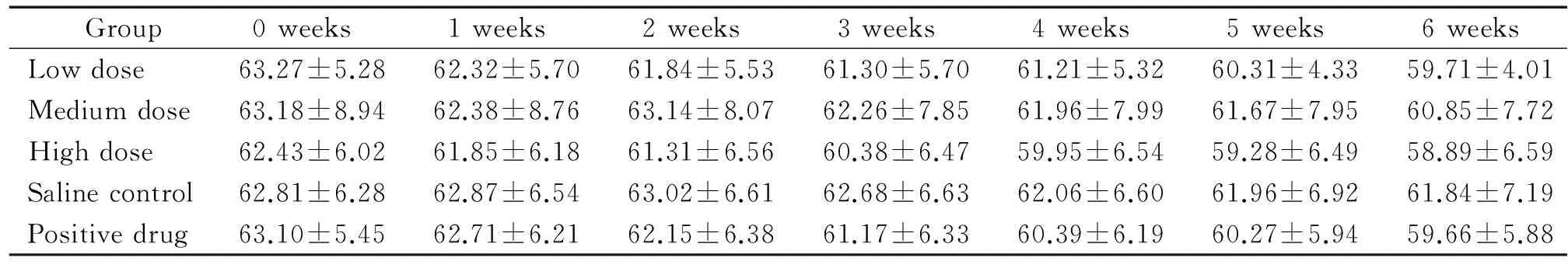
表1 各组小鼠体重的变化
The weight of normaldb/mmice was (21.80±1.19) g.
给药6周后,甜菜碱各剂量组小鼠的肝脏指数与对照组相比差异均不显著(P>0.05),见表2。
2甜菜碱对db/db小鼠血清脂类生化指标和肝功能的影响
2.1TC 实验前各组血清TC水平无显著差异。在实验后甜菜碱中、高剂量组和阳性药物组血清TC水平均低于生理盐水组(P<0.01), 甜菜碱高剂量组降低35.41%。甜菜碱低剂量组与生理盐水组差异不明显;第3周时仅阳性药物组与生理盐水组有差异。这表明中、高剂量甜菜碱具有降低血清胆固醇的作用,而脂必妥降胆固醇的效果最明显,见表3。
表2甜菜碱对肝脏指数的影响
Table 2. The effect of betaine on liver index (%. Mean±SD.n=10)

GroupLiverindexLowdose4.50±1.08Mediumdose3.88±0.84Highdose3.96±0.66Salinecontrol3.78±0.67Positivedrug3.69±1.22
表3甜菜碱对db/db小鼠血清TC水平的影响
Table 3. The effect of betaine on serum TC level indb/dbmice (mmol/L. Mean±SD.n=10)
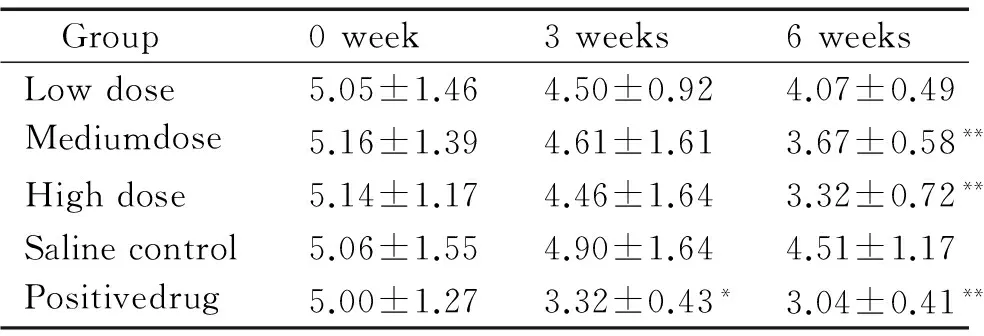
Group0week3weeks6weeksLowdose5.05±1.464.50±0.924.07±0.49Mediumdose5.16±1.394.61±1.613.67±0.58**Highdose5.14±1.174.46±1.643.32±0.72**Salinecontrol5.06±1.554.90±1.644.51±1.17Positivedrug5.00±1.273.32±0.43*3.04±0.41**
Serum TC level in normal db/m mice was (2.14±0.22) mmol/L.*P<0.05,**P<0.01vssaline control.
2.2TG 与生理盐水组比较,甜菜碱各剂量组和阳性药物组血清TG水平差异均不明显,见表4。
表4甜菜碱对db/db小鼠血清TG水平的影响
Table 4. The effect of betaine on serum TG level indb/dbmice (mmol/L. Mean±SD.n=10)
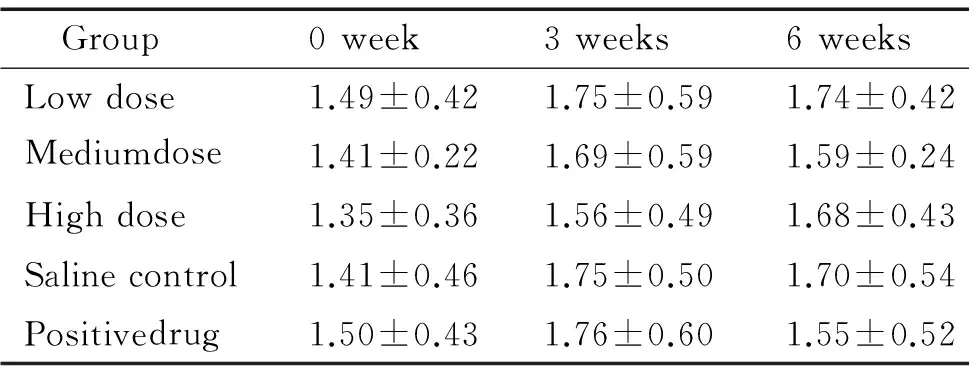
Group0week3weeks6weeksLowdose1.49±0.421.75±0.591.74±0.42Mediumdose1.41±0.221.69±0.591.59±0.24Highdose1.35±0.361.56±0.491.68±0.43Salinecontrol1.41±0.461.75±0.501.70±0.54Positivedrug1.50±0.431.76±0.601.55±0.52
Serum TG level in normaldb/mmice was (1.75±0.18) mmol/L.
2.3LDL 与正常db/m小鼠相比,老龄db/db小鼠血清LDL水平显著升高,仍维持高脂血症;实验6周后,用药组血清LDL水平与生理盐水组相比显著降低(P<0.01),表明甜菜碱和脂必妥均能降低血清LDL水平,具有明显的降血脂效果,见表5。
表5甜菜碱对db/db小鼠血清LDL水平的影响
Table 5. The effect of betaine on serum LDL level indb/dbmice (mmol/L. Mean±SD.n=10)
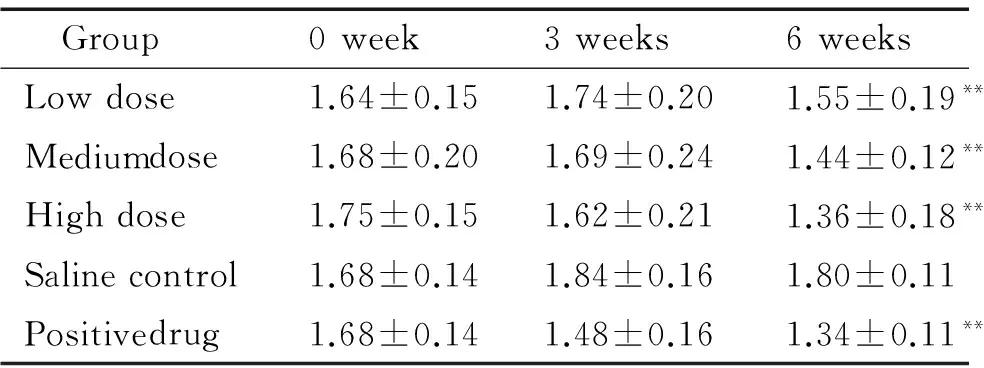
Group0week3weeks6weeksLowdose1.64±0.151.74±0.201.55±0.19**Mediumdose1.68±0.201.69±0.241.44±0.12**Highdose1.75±0.151.62±0.211.36±0.18**Salinecontrol1.68±0.141.84±0.161.80±0.11Positivedrug1.68±0.141.48±0.161.34±0.11**
Serum LDL level in normaldb/mmice was (0.46±0.15) mmol/L.**P<0.01vssaline control.
2.4ALT 实验前各组小鼠血清ALT水平均较高。治疗6周后,甜菜碱各剂量组和阳性药物组小鼠血清ALT水平均显著减低,与生理盐水组比较差异有统计意义(P<0.05)。这表明脂必妥和甜菜碱均能明显改善肝功能,见表6。
表6甜菜碱对db/db小鼠血清ALT水平的影响
Table 6. The effect of betaine on serum ALT level indb/dbmice (U/L. Mean±SD.n=10)
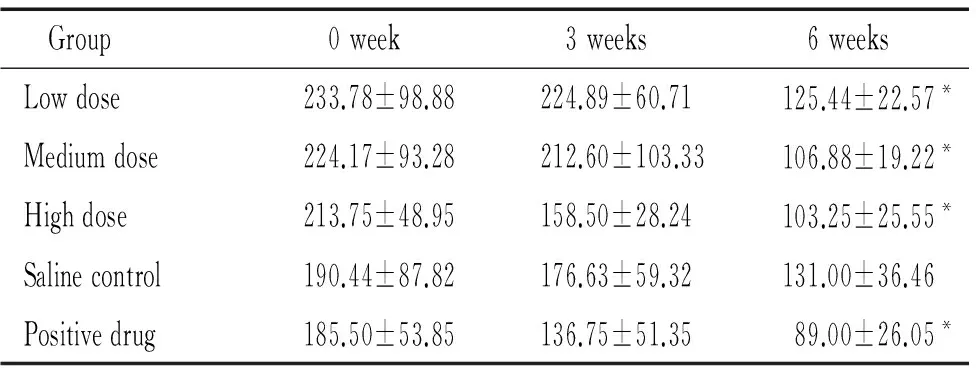
Group0week3weeks6weeksLowdose233.78±98.88224.89±60.71125.44±22.57*Mediumdose224.17±93.28212.60±103.33106.88±19.22*Highdose213.75±48.95158.50±28.24103.25±25.55*Salinecontrol190.44±87.82176.63±59.32131.00±36.46Positivedrug185.50±53.85136.75±51.3589.00±26.05*
Serum ALT level in normaldb/mmice was (34.17±4.26) U/L.*P<0.05vssaline control.
3甜菜碱对db/db小鼠葡萄糖耐量的影响
给药6周后的IGTT结果表明,各组血糖水平均于30 min升至最高,后又逐渐降低。与生理盐水组相比,甜菜碱各剂量组和阳性药物组小鼠葡萄糖耐量在各时间点未见明显差异,见表7。
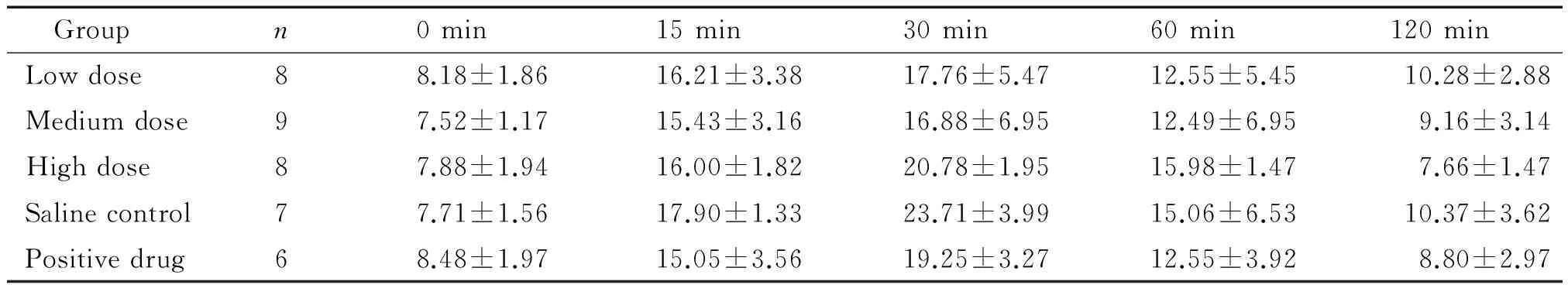
表7 各组小鼠6周后IGTT结果
4肝组织形态学观察
小鼠经甜菜碱药物灌胃6周时,肝组织HE染色结果显示,生理盐水组肝脏小叶结构消失,中度至重度脂肪变,肝窦被挤压变窄,肝细胞形态不规则,肝细胞内胞浆空泡较多,细胞核位于中间,伴浊肿样变性及轻度的肝细胞点状坏死,气球样变的细胞占肝组织的50%以上,提示有重度脂肪肝的表现。甜菜碱处理组和阳性药物脂必妥处理组小鼠肝组织中空泡样变细胞较生理盐水组明显减少。甜菜碱处理组肝脏病理表现以轻度至中度脂肪变为主,伴有一定程度浊肿样变性,肝细胞形态大致正常,肝细胞内脂肪滴减少,散在分布,核圆位于细胞中央,炎症细胞浸润减轻,偶见细胞坏死。但水样变性各实验组普遍存在,见图1和表8。
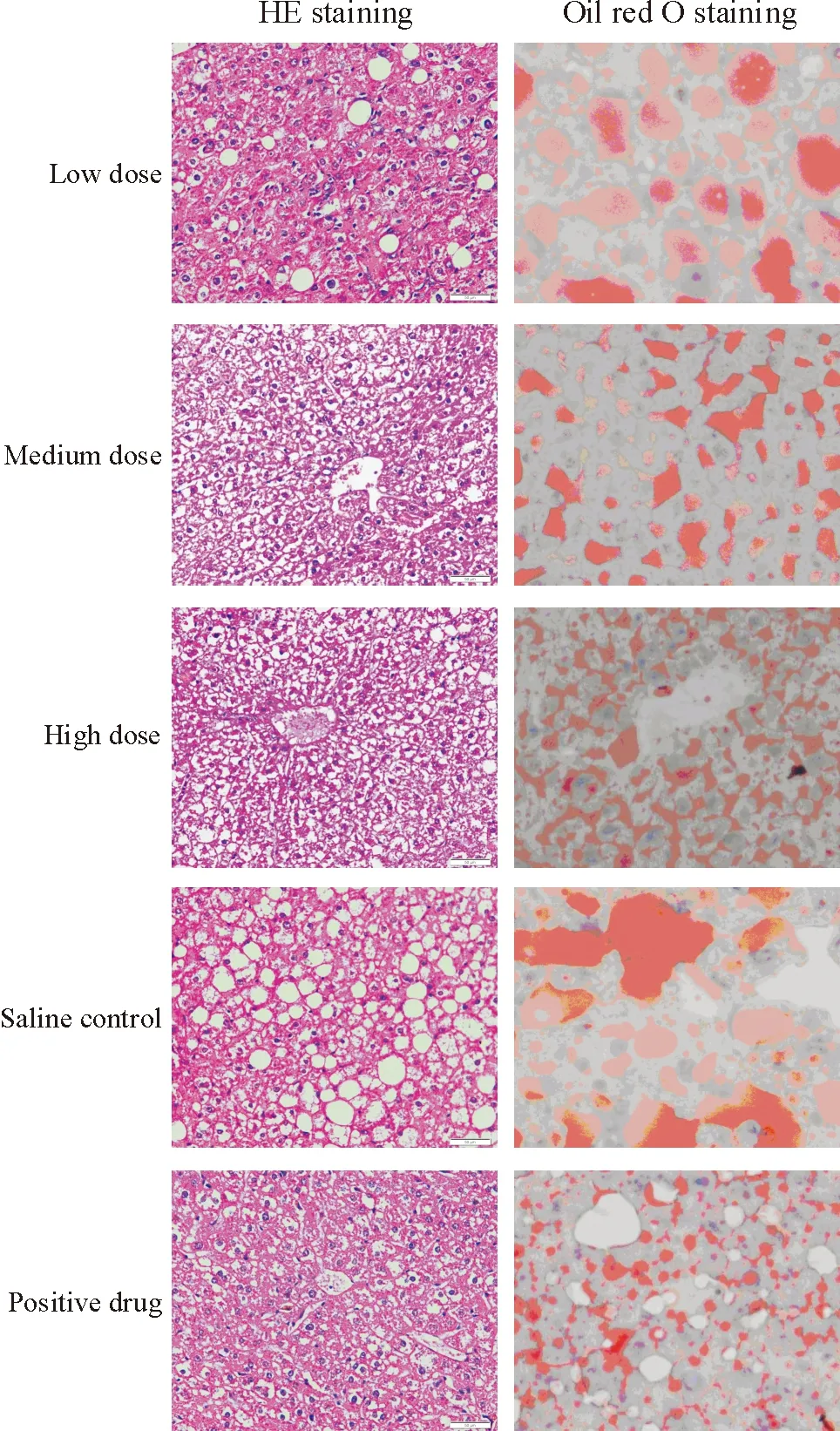
Figure 1. The histological observation and lipid accumulation of the liver tissues in the mice (×400).
图1各组肝组织HE和油红O染色图
表8肝组织形态学观察结果
Table 8. The morphological changes of the hepatic tissues of the mice (n=10)
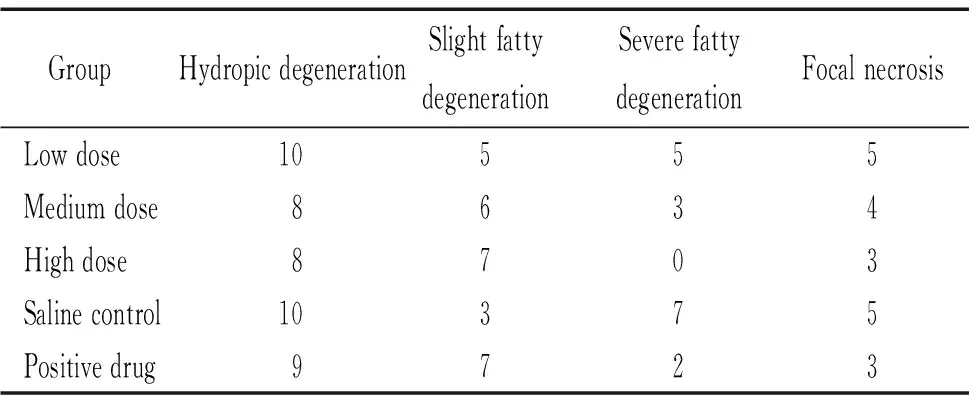
GroupHydropicdegenerationSlightfattydegenerationSeverefattydegenerationFocalnecrosisLowdose10555Mediumdose8634Highdose8703Salinecontrol10375Positivedrug9723
小鼠经甜菜碱药物灌胃6周时,肝组织油红O染色结果显示,生理盐水组肝细胞内充满红色粗大块状物,表明肝细胞脂肪变性明显。甜菜碱和阳性药物脂必妥处理组小鼠肝细胞内红色粗大颗粒减少,脂肪变性范围减小、程度减轻。脂必妥组肝细胞中水样变性较明显,空泡较多,原因不清楚,可能与脂必妥为中草药有关,见图1。这表明甜菜碱和阳性药物脂必妥处理组小鼠肝细胞中脂质累积水平较生理盐水组显著降低。
讨 论
甜菜碱治疗NAFL的药效学动物模型一般均采用正常实验鼠进行高脂饮食诱导[6]获得,缺乏遗传背景因素,而人类NAFL一般均具有遗传背景影响,因此众多学者怀疑动物实验结果的可靠性[10]。我们利用遗传性脂肪肝小鼠模型,进一步研究了甜菜碱对脂肪肝的保护作用,为甜菜碱治疗人类NAFL的药效学实验提供了新的证据。
db/db小鼠是国内外目前最常用的肥胖症和脂肪肝模型。由于db/db小鼠脑细胞表面不能产生瘦素受体,瘦素刺激不能传达到脑,不能产生饱感,即对饱感物质(瘦素)缺乏反应。多食后,合成代谢大于分解代谢,引起脂肪堆积而肥胖,逐渐可致过度摄食、肥胖、高脂血症和转氨酶升高等表现。这种小鼠出生10 d后即表现多食、肥胖及血糖升高,4周后由于体重增加明显,肥胖显著,很容易分辨,从6周开始体重出现显著差异。高脂饮食饲养1个月即可诱发3月龄db/db小鼠出现非酒精性脂肪肝。
面对发病日益增多的肥胖人群及其导致的相关疾病,体重是相关实验重要的观察指标之一。本实验观察结果提示甜菜碱对小鼠体重没有明显的影响,不能抑制小鼠的食欲,不会改变其食量和增加能量的消耗。
脂质代谢紊乱是NAFLD 发病的重要因素之一。脂肪代谢失衡, 肝脏内脂肪积聚, 这是脂肪肝的主要动因。而在肝脏脂肪沉积基础上所发生的氧化应激和脂质过氧化又可进一步干扰肝内脂类代谢, 使脂质沉积增多, TC和TG 增加, 而脂质沉积的增多又能加重脂质过氧化反应,加重细胞损伤,导致恶性循环[11-12]。
甜菜碱的主要功能是提供甲基,参与机体内的甲基转移。所谓甲基转移就是指甲基供体的去甲基反应、甲基碳离子的转移及甲基受体的甲基吸附作用。研究显示,S-腺苷蛋氨酸水平的降低可导致脂肪性肝病的发生。甜菜碱能增加S-腺苷蛋氨酸水平,使酒精性肝病动物模型脂肪肝的发生明显降低,尤其是S-腺苷蛋氨酸能保护肝脏免遭TG沉积和肝损伤的发生。也有不少实验证实S-腺苷蛋氨酸、蛋氨酸和胆碱可直接对非酒精性肝损伤有保护作用[6]。
本实验结果表明,甜菜碱与脂必妥均可降低db/db小鼠的血清TC和LDL水平,而降低血清TG的效果均不明显。脂必妥能抑制肝内VLDL 和LDL 的生物合成,或增加VLDL 和LDL 的降解速度,降低胆固醇的效果比甜菜碱明显。
甜菜碱作为甲基供应体的一种,能促进肉碱的合成,从而抑制胆固醇在肝脏堆积,促进长链脂肪酸的β-氧化,加速脂质代谢,保护线粒体电子偶联呼吸系统,减轻了脂质过氧化对肝脏的损伤[13-14]。转氨酶可作为反映肝脏损伤的灵敏指标,实验结果显示高脂组与正常组比较,ALT 显著升高;而甜菜碱组与高脂组比较则明显降低,表明甜菜碱能显著抑制脂肪肝造成的血清转氨酶水平的升高。ALT 下降可能与肝内脂肪水平相关,原因可能是甜菜碱促进肝内脂肪向肝外转移,降低了肝中脂肪,减轻了脂肪与脂质过氧化作用对肝脏的损伤,从而降低了血清中转氨酶水平。
肝组织HE染色观察表明,生理盐水对照组肝细胞空泡样变明显,占肝组织的50%以上,提示有中、重度脂肪肝。甜菜碱组肝细胞形态大致正常,以轻度至中度脂肪变为主,伴有一定程度水样变性; 肝组织脂肪油红O染色结果表明:生理盐水组小鼠肝组织中脂肪的比例占80%以上,说明油红O染色对脂肪肝的诊断更敏感,中、高剂量甜菜碱和脂必妥组中肝脏细胞中脂质累积水平较生理盐水对照组小鼠显著降低,表明在维持NAFLD小鼠肝组织完整性和抑制肝中脂肪堆积方面,甜菜碱可降低肝中脂肪蓄积。
甜菜碱对肝脏指数影响不明显的原因不清。理论上甜菜碱能促进载脂蛋白的合成,促进肝内脂肪向肝外转移。甜菜碱在促进肝内脂肪向肝外转移的同时也可能促进了肝细胞的蛋白合成,从而使肝组织比重增加。
甜菜碱对IGTT影响不明显,即甜菜碱的降血糖效果不显著,提示今后利用甜菜碱治疗代谢紊乱综合征时要注意患者血糖的控制,至于甜菜碱能否促进胰岛素和二甲双胍类药物的降血糖作用还有待深入研究。
综上所述,甜菜碱可以改善老龄db/db小鼠肝损伤, 减轻脂质过氧化反应, 降低高脂血症和肝中脂肪蓄积,表明甜菜碱具有较好的降血脂、保护肝脏和减轻脂肪肝形成的作用。甜菜碱源自植物,安全无害,是降血脂、保护肝脏的天然药物。
[1] 中华医学会肝病学分会脂肪肝和酒精性肝病学组. 非酒精性脂肪性肝病诊疗指南(2010年修订版)[J]. 中华肝脏病学杂志,2010, 18(3): 163-166.
[2] Ratziu V, Bellentani S, Cortez-Pinto H, et al. A position statement on NAFLD/NASH based on the EASL 2009 special conference[J]. J Hepatol, 2010, 53(2): 372-384.
[3] 郭秀丽,任 莉,梁丕霞,等. 非酒精性脂肪肝发病机制[J]. 医师进修杂志,2005,28(9A):53-55.
[4] O’Shea RS, Dasarathy S, McCullough AJ.Alcoholic liver disease[J]. Hepatology, 2010, 51(1): 307-328.
[5] Comar KM,Sterling RK. Drug therapy for non-alcoholic fatty liver disease[J].Aliment Pharmacal Ther,2006,23(2):207-215.
[6] Kathirvel E, Morgan K, Nandgiri G,et al. Betaine improves nonalcoholic fatty liver and associated hepatic insulin resistance: a potential mechanism for hepatoprotection by betaine[J]. Am J Physiol Gastrointest Liver Physiol,2010,299(5):G1068-G1077.
[7] Patrick L. Nonalcoholic fatty liver disease: relationship to insulin sensitivity and oxidative stress. Treatment approaches using vitamin E, magnesium, and betaine[J]. Altern Med Rev, 2002, 7(4):276-291.
[8] 王淑芳,张 巍,周 凤,等. 甜菜碱对非酒精性脂肪性肝炎大鼠胰岛素抵抗的影响[J].中西医结合肝病杂志,2010,20(6):358-359.
[9] Duvnjak M, Tomasic V, Gomercic M, et al. Therapy of nonalcoholic fatty liver disease: current status[J]. J Phy-siol Pharmacol, 2009, 60(Suppl 7): 57-66.
[10] Mukherjee S.Betaine and nonalcoholic steatohepatitis: back to the future?[J]. World J Gastroenterol, 2011,17(32):3663-3664.
[11] Larter CZ, Yeh MM. Animal models of NASH: getting both pathology and metabolic context right[J]. J Gastroenterol Hepatol, 2008,23(11):1635-1648.
[12] Shen L, Fan JG, Shao Y, et al. Prevalence of nonalcoho-lic fatty liver among administrative officers in Shanghai: an epidemiological survey[J]. World J Gastroenterol, 2003, 9(5): 1106-1110.
[13] Peluso G, Barbarisi A, Savica V,et al. Carnitine: an osmolyte that plays a metabolic role[J]. J Cell Biochem, 2000,80(1):1-10.
[14] Shin OH, Mar MH, Albright CD, et al . Methyl-group donors cannot prevent apoptotic death of rat hepatocytes induced by choline-deficiency[J]. J Cell Biochem,1997,64(2):196-208.
Effectofbetaineonliverinjuriesinagingdb/dbmiceinducedbylipids
LIU Guang-jie1, LIU Guang-ze2, LAN Dan4, CHEN Mei-juan2, LIAO Han-xiong3, LIU Hai-xia4, ZOU Qing-yan4
(1CollegeofComputerScienceandTechnology,ChangchunNormalUniversity,Changchun130032,China;2CenterofHepatopathy, 458thHospitalofPLA,Guangzhou510602,China;3GuangzhouKnockimPharmacyCo.Ltd.,Guangzhou511356,China;4GuangzhouCell-GeneBiotechCo.Ltd.,Guangzhou510663,China.E-mail:zqy966@126.com)
AIM: To evaluate the effect of betaine on lipid metabolism disorder in inheriteddb/dbmice with long-term nonalcoholic fatty liver disease (NAFLD).METHODSExperimental NAFLD models were established by feeding thedb/dbmice with high-fat diet. Fifty 7-month-olddb/dbmice were randomly divided into 5 groups: the mice in low, medium and high dose groups were given betaine by intragastric administration at doses of 200 mg/kg, 400 mg/kg and 800 mg/kg for 6 weeks, respectively,while the mice in saline control group and positive drug group were given normal saline and positive control drug,respctively. All the animals were killed, and serum alanine aminotransferase (ALT), triglyceride (TG), total cholesterol (TC), low-density lipoprotein (LDL) and glucose tolerance were detected. The pathological changes of the liver tissues were also observed.RESULTSBetaine significantly decreased the levels of ALT, TC and LDL (P<0.05 orP<0.01). The pathological changes of the liver tissues indicated that the content of lipid in the hepatocytes of betaine treatment groups was less than that in saline control group.CONCLUSIONBetaine significantly improves the lipid metabolism and the liver function in the agingdb/dbmice, and reduces the accumulation of lipid in the hepatocytes.
Betaine; Nonalcoholic fatty liver disease;db/dbmice
R363
A
10.3969/j.issn.1000- 4718.2013.06.026
1000- 4718(2013)06- 1114- 05
2013- 01- 03
2013- 04- 10
国家重大新药创制项目(No.2011ZX09401-307);广州高新技术开发区项目(No.2011Q-P033)
△通讯作者 Tel: 020-87796965; E-mail: zqy966@126.com

