细胞凋亡途径中HIPPI的潜在调节作用*
朱兰卉, 李冯锐,2, 周懿舒, 崔洪刚, 庞 灏△
(1中国医科大学法医学院,辽宁 沈阳 110001; 2包头医学院法医学系,内蒙古 包头 014060)
·综述·
细胞凋亡途径中HIPPI的潜在调节作用*
朱兰卉1, 李冯锐1,2, 周懿舒1, 崔洪刚1, 庞 灏1△
(1中国医科大学法医学院,辽宁 沈阳 110001;2包头医学院法医学系,内蒙古 包头 014060)
亨廷顿蛋白相互作用蛋白1相互作用因子(huntingtin-interacting protein 1 protein interactor, HIPPI) 也称为雌激素相关受体β样蛋白1(estrogen-related receptor beta-like protein 1, ESRRBL1)或者鞭毛内转运蛋白57同系物(intraflagellar transport 57 homolog, IFT57)。2002年,Gervais等[1]在研究亨廷顿病(Huntington disease, HD)的发病机制时,发现了一种新的与享廷顿蛋白相互作用蛋白1(huntingtin-interacting protein 1,HIP-1)相互作用的蛋白,进而克隆了该蛋白的基因,并命名这个新的蛋白为HIPPI。进一步深入研究发现HIPPI参与细胞凋亡的发生,并推测其在神经变性疾病HD的发病机制中起重要作用。随后,研究者们发现IFT57/HIPPI也参与排列在纤毛和鞭毛轴丝微管中大的蛋白复合物的双向运动,影响着细胞内基本的蛋白转运[2]。也有研究指出HIPPI在胚胎发育初级阶段有着重要功能。最新的研究显示HIPPI作为一个重要的转录因子,参与包括与凋亡相关的多种基因的调节,进而影响不同的信号转导通道。鉴于HIPPI表现出的生理病理学重要性,本文对HIPPI基因与蛋白质结构、分布特征、生物学功能及病理生理学意义等进行综述,重点探讨HIPPI在凋亡过程中的潜在调节作用。
1 HIPPI基因与蛋白特性
为了探查与HD发病相关的HIP-1的潜在作用因子,Gervais等[1]利用HIP-1所含有的伪死亡效应区(pseudo-death effector domain, pDED)序列为作用靶点,采用酵母双杂交技术鉴定出了与HIP-1相互作用的蛋白HIPPI(OMIM#606621),进一步克隆出了HIPPI基因(基因库通道号:AF245220)。人类的HIPPI基因位于染色体3q13.12~q13.13,基因组序列跨度约62 kb,由11个外显子和10个内含子组成;人类的HIPPI基因序列与黑猩猩、狗、母牛、小鼠、鸡、斑马鱼、果蝇等动物存在着高度的同源性;人类HIPPI基因的开放阅读框由1 287个核苷酸组成,目前为止,在人类HIPPI基因编码区共发现60个突变(http://www.ncbi.nlm.nih.gov/projects/SNP/),其中错义突变30个,产生框架漂移的突变3个,同义突变17个。
人类HIPPI蛋白由429个氨基酸组成,蛋白分子量为55 kD[3]。人类HIPPI蛋白的第44位氨基酸至第402位氨基酸之间形成一段高度保守的序列,与其它IFT家族成员表现出较高的相似性;氨基酸序列分析显示HIPPI蛋白的第126位至C端区域,与秀丽隐杆线虫的同源蛋白有37%的同源性,有高达67%的相似性;除了pDED独特的序列区域外,HIPPI蛋白的C端也显示出与诸如小分子鸟甘酸结合蛋白Rho(Ras homologue)相关的激酶2(Rho-associated coiled-coil-containing protein kinase 2,ROCK2)、着丝粒蛋白E及肌凝蛋白重链等细胞骨架蛋白的弱相似性。
2 HIPPI在组织和细胞中的表达
采用Northern blotting方法检测成人人体组织中的总RNA,经HIPPI探针杂交后显示,一个约1.8 kb的特异性转录子发现于脑、心脏、骨骼肌、大肠、胸腺、脾脏、肾脏、肝脏、小肠、胰腺和肺脏等大部分人体组织中,其中以脑、心脏、肾脏和肺脏的表达最为丰富。进一步对脑组织的不同部位进行了检测,发现壳核、颞叶、额叶、枕极、大脑皮层和小脑均有HIPPI mRNA表达,尤以枕极表达最为丰富,但同为神经组织的脊髓只有微弱的表达[1]。采用Western blotting方法分析成人人体组织中的总蛋白,经多克隆的抗HIPPI抗体进行免疫反应后,一个约55 kD的特异性蛋白被发现于脑、胸腺、肺脏、肝脏、皮肤和肾脏等人体组织中,其中以肺脏的表达量最为丰富,而且在肺脏中可能不仅仅只存在着一种单体的HIPPI蛋白类型,提示与其它组织比较,肺脏中的HIPPI可能有不同的作用途径和功能。需要指出的是,所有表达HIPPI蛋白的组织中也表达相当量的HIP-1,特别是在纹状体的苍白球投射区域中,同样也检测到了HIPPI和HIP-1的共同表达。HIPPI和HIP-1存在着相似的组织表达型,符合二者之间功能上的关联特性,也暗示其在与纹状体相关的神经系统病变中的潜在作用。
免疫组化研究显示HIPPI存在于小鼠整个脑组织的神经元和神经纤维网内,但是不同脑区的细胞内HIPPI的免疫反应性呈现出不均一性,既有在神经元细胞核外的分布,也有细胞核内的分布,其中细胞核外的HIPPI呈现核周的散片状分布特征[1]。借助电子显微镜观察HIPPI的亚细胞定位,结果显示在大多数神经元中HIPPI主要与高尔基器相关,也可见到HIPPI游离在胞浆、存在于相关的囊泡中或浆膜上。此外,也有学者对人类神经元NT2细胞进行了免疫荧光实验,进一步证明了HIPPI存在于高尔基器内,而双荧光分别标记的HIPPI和HIP-1尽管显示出共同定位于高尔基器中,但是也同样观察到了显著的双荧光非重叠区域,暗示二者可能存在着其它生物学功能。
3 HIPPI蛋白的结构与功能
HIPPI蛋白的结构按其功能特性可大致分为3个主要区域,即N端、肌球蛋白样区域(myosin-like domain, MLD)和C端。N端包括HIPPI的第1~240个氨基酸,目前为止尚未发现已知的特殊结构区域定位在N端。MLD包括第241~335个氨基酸,紧邻pDED的N端,其序列与大多数细胞骨架蛋白相似,尽管不能排除其与HIP-1存在直接相互作用,但是推测其影响着HIPPI的亚细胞定位,以使HIPPI有机会接近HIP-1,然后借助两者的pDED相互作用[4]。研究也发现HIPPI的MLD能够结合环指1和阴阳1结合蛋白(Ring1 and YY1 binding protein, RYBP),进而协同增加HIPPI的caspase-8介导的凋亡。
pDED为第336~429个氨基酸的残基组成,因其含有与死亡效应区(death effector domain,DED)相似的氨基酸序列而得名。DED是蛋白之间互相作用的区域,可以促进蛋白的聚集,导致激活多条凋亡通路。HIPPI与HIP-1的pDED氨基酸序列存在39.2%相似性,其中的26.6%相同;而与其它已知的DED氨基酸序列仅存在34.9%的相似性和21.0%的相同性。在HIPPI和HIP-1的pDED螺旋5这一区域(409 kD)上存在赖氨酸,有别于其它已知DED的序列,故以此定义HIPPI和HIP-1为DED的一个新的亚类。最初的研究发现就是以HIP-1的pDED为相互作用因子,鉴定了与其特异性相互作用的、同样含有pDED序列的HIPPI。两者通过该区域的相互作用,可以促进HIP-1诱导的细胞毒性作用,也促进了细胞凋亡的发生。此外,HIPPI与HIP-1的结合,不仅可以启动细胞中受体介导的凋亡途径,而且有助于HIPPI进入细胞核,在细胞的转录层面起到调节的作用。
也有研究将近C端的MLD和pDED 2个功能区域命名为卷曲螺旋结构域[4],研究结果指出,HIPPI与鞭毛内转运蛋白家族20(IFT20)之间主要是借助卷曲螺旋结构相互作用,形成IFT复合物,其重要的特性表现在与纤毛和鞭毛的运动密切相关。
4 HIPPI与凋亡
4.1HIPPI参与的凋亡途径 Gervais等[1]最初研究发现,HIP-1与HIPPI结合形成HIP-1-HIPPI异源二聚体,这种结合构成的二聚体可以特异性地吸引caspase-8的前体,形成HIP-1-HIPPI-caspase-8前体复合物,进而启动外源性细胞凋亡途径。同时,因为caspase-8广泛分布在细胞内,活化后的caspase-8也可参与细胞内非受体介导的凋亡途径。然而,研究中采用内源性凋亡特异性抑制剂B细胞慢性淋巴细胞白血病/淋巴瘤2(B-cell CLL/lymphoma 2, Bcl-2),没有观察到其对HIPPI-HIP-1二聚体所产生的凋亡前效应的影响,说明HIPPI所引发的凋亡可能较弱地关联内源性途径。Majumder等[5]为了弄清HIPPI激活caspase-8后诱导凋亡的下游信号通路,建立了转染外源性HIPPI的HeLa细胞和Neuro2A细胞模型,发现GFP-HIPPI在上述过表达的细胞中细胞核片段化明显增加;研究也观察到了caspase-1、caspase-8、caspase-9及caspase-6和caspase-3的前体减少,以及对应的活性形式显著增加;此外,Bcl-2家族中促凋亡因子BH3相互作用结构域死亡激动剂(BH3-interacting domain death agonist,Bid)的裂解、源于线粒体的细胞色素C和凋亡诱导因子(apoptosis-inducing factor,AIF)在HIPPI过表达的情况下也显著增加。这些结果表明HIPPI的异常表达将影响到众多的caspase家族蛋白及与凋亡相关的因子,同时也进一步证明HIPPI诱导了细胞凋亡。
4.2HIPPI与其它因子的协同作用 目前为止,除了HIP-1与HIPPI相互作用外,还发现了鸡贫血病毒编码蛋白apoptin、突触后支架蛋白Homer 1c、RYBP、双功能凋亡调节因子(bifunctional apoptosis regulator, BAR)和溶酶体相关细胞器形成复合物1的亚单位2(biogenesis of lysosome-related organelles complex-1 subunit 2, BLOC1S2)等与HIPPI特异性相互作用的细胞内因子,特异性结合产生了相应的生理和病理变化。RYBP是一个小的碱性含锌指蛋白的环指1和阴阳1结合蛋白家族的成员,因其能与含有DED结构域的蛋白相互作用,故具有诱导凋亡的功能。一个探讨RYBP与HIPPI相互作用的研究显示[6],借助RYBP的羧基端与HIPPI的MLD特异性结合,使有着相同神经元表达的2种蛋白能够协同作用增加caspase-8介导的细胞凋亡。关于BLOC1S2的研究也显示其能与HIPPI特异性地相互作用[7],当两者在NCH89胶质母细胞瘤细胞系中共同表达时,尽管没有发现明显的凋亡现象,但能致敏细胞至十字孢碱诱导的内源性凋亡和死亡配体TRAIL诱导的外源性凋亡相似的程度,结果暗示两者在线粒体水平上调节凋亡的信号。关于Homer 1c,目前研究的结果显示其参与了多种神经信号的转导。Sakamoto等[8]的研究发现HIPPI特异地与Homer 1c相互作用,当两者共同表达在培养的纹状体神经元时,Homer 1c能有效阻止HIPPI-HIP-1对细胞凋亡的作用,因而Homer 1c在HIPPI诱导的纹状体神经元死亡发生机制中可能扮演着重要的角色。另外一种具有杀伤癌细胞潜能的、并能与HIPPI在体内外均存在相互作用的因子为apoptin[9]。借助观察HIPPI和apoptin的亚细胞定位,发现在正常人HEL细胞中两种因子共同定位在胞浆中;而在癌的HeLa细胞中,大部分apoptin和HIPPI则分别分布在细胞核和胞浆中。不同的分布和定位结果提示,两者的相互作用在抑制正常细胞凋亡和诱导癌细胞凋亡中起着一定的作用。BAR是定位于细胞内外源凋亡信号通路交叉点上的一个蛋白,最初发现其主要作用为抑制促凋亡因子Bcl-2相关X蛋白(Bcl-2-associated protein,Bax)诱导的细胞凋亡。BAR蛋白含有多个结构域,其中之一为与HIP-1的pDED相似的序列功能区[10],以此为依据将BAR和HIPPI共同表达于神经元进行免疫共沉淀及亚细胞定位研究,结果显示两者存在特异性相互作用和内质网的共同定位,共同的作用和定位调节神经元的死亡,主要体现在介导神经元的保护功能。综上所述,HIPPI与细胞内不同因子产生的相互作用可影响着细胞的凋亡过程。
4.3HIPPI对凋亡的调节作用 HIPPI对凋亡起相关调节作用的发现源于对转染HIPPI的HeLa细胞和Neuro2A细胞模型的研究[11]。Majumder等[11]发现,在HIPPI过表达的细胞中可见活性的caspase-1、-3、-8和-9均显著增加,但未检出活性的caspase-2;同时可见线粒体复合物I的NADH脱氢酶基因ND1和ND4(NADH dehydrogenase subunit 1 and 4)、线粒体复合物II的琥珀酸脱氢酶基因SDHA和SDHB(succinate dehydrogenase subunit A and B)以及抗凋亡基因bcl-2的表达减少;此外,也可观察到与细胞死亡刺激相关的线粒体黄素蛋白AIF向细胞核内的转移增加等。后续对caspase-1在此模型下活性增加的机制研究发现,HIPPI可以直接与推测的caspase-1基因的启动子区(-700到+17)的717 bp序列互相作用[12],以增加caspase-1的表达,也因此提出HIPPI可能作为一种转录调节因子而发挥作用。进一步详细分析caspase-1上游启动子区与HIPPI相互作用的序列发现,caspase-1基因上游的60 bp(-151到-92)序列特异地与HIPPI的C端pDED结合,其中包含的序列区AAAGACATG(-101到-93)被鉴定为特异性的结合序列[13]。研究也同时分析了caspase-8和10的上游相应区域,发现HIPPI也能与之相互作用而产生相应的表达改变,进一步研究证明了该序列区可作为HIPPI作用的靶点,发挥着调节细胞凋亡等重要的功能。
为了准确地确定HIPPI的C端pDED结构域中结合caspase-1等基因启动子区的特异氨基酸位点,Banerjee等[14]首先从结构模型中预测出HIPPI的R393位残基在结合序列区AAAGACATG的重要性。进一步的实验研究证实,在HeLa细胞中表达HIPPI-pDED结构域中的R393E突变,可使细胞凋亡进程减缓甚至抑制凋亡的发生。推测的机制是突变的HIPPI由于改变了局部表面和电荷的分布,不能与caspase-1启动子区结合,从而导致caspase-1的表达减少。
伴随着借助启动子区特异序列与HIPPI结合基因的发现,HIPPI调节不同细胞功能的研究也被探讨和揭示,与HIPPI特异性结合的9碱基序列被定义为HIPPI结合点(HIPPI binding site,HBS)。2011年,Datta等[15]继续应用GFP-HIPPI在HeLa细胞中表达的模型,借助基因芯片分析,在基因组范围内调查了HIPPI作为广谱转录调节因子的作用。研究结果显示HBS优势地定位于转录起始点(transcription start site,TSS)上游2 kb之内,与HBS相邻近的约100 bp范围内存在着众多已知转录因子,提示这些转录因子可能与HIPPI存在着共同执行转录调节的功能。基因组范围内搜索编码基因上游的HBS序列,其中7.9%的基因可发现在1 kb上游序列内;而在10 kb内则可发现61.8%。HeLa细胞中外源性转染HIPPI后,经基因芯片分析可观察到580个基因表达上调,457个基因表达下调,表达发生改变的基因涉及到多个信号通路,也反映出HIPPI对细胞功能影响的多样性(表1)。其中鉴定出的对细胞凋亡影响的因子包括甲基-CpG结合结构域蛋白4、共济失调性毛细血管扩张症突变因子、细胞周期监控点同系物等。同时从表中也可以看出,HIPPI的作用不局限于对凋亡的调节,还参与到细胞的诸多生物过程中而达到间接调控作用。对部分代表性基因进行半定量RT-PCR分析,大部分基因表达水平的变化得以验证。这种高通量研究有力地证明了HIPPI对包括凋亡在内的众多基因在转录水平上具有调节作用。
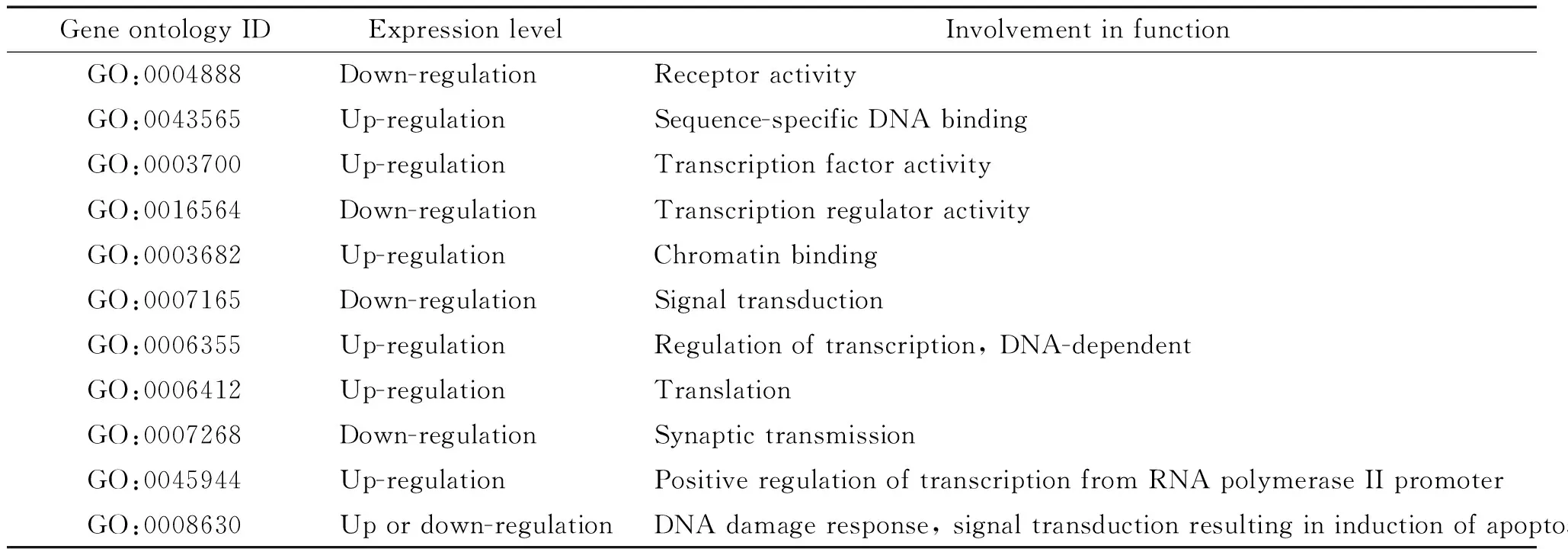
表1 HIPPI调节的基因的功能分类
随着研究的不断深入,更多与HIPPI相互作用的DNA序列将会揭示,其对基因的调控机制也会更明确。其次,现阶段的研究基本基于HeLa细胞和Neuro2A细胞模型,均为对离体细胞所进行的研究,而在人体内HIPPI究竟参与何种调控,如何介导凋亡,以哪种凋亡途径为主尚未揭示。再次,HIPPI在转录水平的调节已经不局限于对细胞凋亡的调节,其它的细胞生命过程中,它也一定起到了重要的调节作用。最后,基于HIPPI对以神经退行性病变为主的HD的研究,是否对于其它神经退行性病变发病机制的研究具有启示作用,无疑将体现出其重要的作用和潜在的价值。
5 HIPPI与HD
HD又称为亨廷顿舞蹈病,是一种进行性神经退行性病变。主要症状是进行性舞蹈症、强直和痴呆;在X线下的特征主要表现为脑尾状核萎缩。典型舞蹈病症状的前期阶段会有轻度精神症状和行为症状,且长达10年之久[16-17]。HD的发病年龄一般在30和40岁之间,家族性常染色体显性遗传方式是其遗传性病因[18],病程平均为17年。
HD的发病与亨廷顿蛋白(huntingtin, Htt)氨基末端的多聚谷氨酸的延伸超过36个氨基酸残基有关[19]。纹状体发生选择性神经元凋亡,而且在疾病的进展过程中,Htt从细胞质转入细胞核。Htt可以被caspase-3和caspase-6切割。在caspase-8依赖途径中,多聚谷氨酸重复片段的表达可以导致新生鼠神经元凋亡。研究发现,野生型Htt的N端可以与HIP-1产生较强的相互作用,使游离的HIP-1数量减少。当Htt发生突变时,结合HIP-1的能力下降,结果产生了更多游离的HIP-1,这些游离的HIP-1可以与其它蛋白互相作用而导致细胞凋亡的发生。HIPPI 作为HIP-1 的分子配体,在Htt突变的情况下,可以与HIP-1生成异源性二聚体,从而聚集更多的caspase-8前体,进而激活caspase-8,诱导纹状体神经元凋亡的发生,导致HD的发病[20]。
为了了解HIPPI蛋白在HD发病机制中的作用,Datta等[15]对HD患者死后的脑组织也进行了全基因组芯片分析。根据基因在HD患者与正常人脑中表达情况,筛选出表达差异的基因进行进一步研究。结果发现下调基因的上游启动子区有HBS 的存在,大多数存在于TSS的2 kb范围之内,随着与TSS距离的增长而显著减少;而上调基因的启动子区并未发现此现象,可能由于HIPPI是非保守的转录调控因子,是通过与其它转录因子的共同作用以实现其调控作用的。目前的研究结果显示HIPPI在HD发病过程中确实起到一定作用,这样也为探讨HIPPI与HD发病机制提供了一个良好的数据基础,然而真正完全弄清HD发病的分子调节机制有待后续深入的研究。
6 展望
综上所述,HIPPI 是一个由N端、MLD和pDED 3个主要功能结构域组成的蛋白,主要参与纤毛内部运输、凋亡过程及细胞内部分基因转录的调节。其中与HIP-1等蛋白结合诱导细胞启动凋亡途径,或进入细胞核对其它转录因子进行调节,对神经元的病理性凋亡及众多细胞的病理生理功能的调节均起到重要的作用。HIPPI在凋亡的诱导和转录调节方面的作用关联着HD的发病,与HD相似的其它类型的神经退行性病变(如帕金森病)在发病机制中是否也同样有HIPPI参与下的神经元凋亡,有待进一步深入的研究探索。此外,HIPPI作为一种非典型的转录调节因子,除了在以凋亡为主要发病机制的相关疾病研究中显示出其独特的作用外,也将会成为其它相关病理生理过程研究的潜在靶点。
[1] Gervais FG, Singaraja R, Xanthoudakis S, et al. Recruitment and activation of caspase-8 by the Huntingtin-interacting protein Hip-1 and a novel partner Hippi[J]. Nat Cell Biol, 2002, 4(2):95-105.
[2] Baker SA, Freeman K, Luby-Phelps K, et al. IFT20 links kinesin II with a mammalian intraflagellar transport complex that is conserved in motile flagella and sensory cilia[J]. J Biol Chem, 2003, 278(36):34211-34218.
[3] Banerjee M, Majumder P, Bhattacharyya NP, et al. Cloning, expression, purification, crystallization and preliminary crystallographic analysis of pseudo death-effector domain of HIPPI, a molecular partner of Huntingtin-interacting protein HIP-1[J]. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2006, 62(Pt 12):1247-1250.
[4] Niu Q, Ybe JA. Crystal structure at 2.8 Å of Huntingtin-interacting protein 1 (HIP1) coiled-coil domain reveals a charged surface suitable for HIP1 protein interactor (HIPPI) [J]. J Mol Biol, 2008, 375(5):1197-1205.
[5] Majumder P, Chattopadhyay B, Mazumder A, et al. Induction of apoptosis in cells expressing exogenous Hippi, a molecular partner of huntingtin-interacting protein Hip1[J]. Neurobiol Dis, 2006, 22(2):242-256.
[6] Stanton SE, Blanck JK, Locker J, et al. Rybp interacts with Hippi and enhances Hippi-mediated apoptosis[J]. Apoptosis, 2007, 12(12):2197-2206.
[7] Gdynia G, Lehmann-Koch J, Sieber S, et al. BLOC1S2 interacts with the HIPPI protein and sensitizes NCH89 glioblastoma cells to apoptosis[J]. Apoptosis, 2008, 13(3):437-447.
[8] Sakamoto K, Yoshida S, Ikegami K, et al. Homer1c interacts with Hippi and protects striatal neurons from apoptosis[J]. Biochem Biophys Res Commun, 2007, 352(1):1-5.
[9] Cheng CM, Huang SP, Chang YF, et al. The viral death protein Apoptin interacts with Hippi, the protein interactor of Huntingtin-interacting protein 1[J]. Biochem Biophys Res Commun, 2003, 305(2):359-364.
[10] Roth W, Kermer P, Krajewska M, et al. Bifunctional apoptosis inhibitor (BAR) protects neurons from diverse cell death pathways[J]. Cell Death Differ, 2003, 10(10):1178-1187.
[11] Majumder P, Chattopadhyay B, Sukanya S, et al. Interaction of HIPPI with putative promoter sequence of caspase-1invitroandinvivo[J]. Biochem Biophys Res Commun, 2007, 353(1):80-85.
[12] Majumder P, Choudhury A, Banerjee M, et al. Interactions of HIPPI, a molecular partner of Huntingtin interacting protein HIP1, with the specific motif present at the putative promoter sequence of the caspase-1, caspase-8 and caspase-10 genes[J]. FEBS J, 2007, 274(15):3886-3899.
[13] Datta M, Bhattacharyya NP. Regulation of RE1 protein silencing transcription factor (REST) expression by HIP1 protein interactor (HIPPI)[J]. J Biol Chem, 2011, 286(39):33759-33769.
[14] Banerjee M, Datta M, Majumder P, et al. Transcription regulation of caspase-1 by R393 of HIPPI and its molecular partner HIP-1[J]. Nucleic Acids Res, 2010, 38(3):878-892.
[15] Datta M, Choudhury A, Lahiri A, et al. Genome wide gene expression regulation by HIP1 Protein Interactor, HIPPI: prediction and validation[J]. BMC Genomics, 2011, 12:463.
[16] Duyao M, Ambrose C, Myers R, et al. Trinucleotide repeat length instability and age of onset in Huntington’s disease[J]. Nat Genet, 1993, 4(4):387-392.
[17] Walker FO. Huntington’s disease[J]. Lancet, 2007, 369(9557):218-228.
[18] Ramaswamy S, Kordower JH. Gene therapy for Huntington’s disease[J]. Neurobiol Dis, 2012, 48(2):243-254.
[19] 叶翠芳,李 和.R6/2型亨廷顿病转基因小鼠胰岛β细胞功能损伤[J]. 中国病理生理杂志, 2009, 25(7):1386-1389.
[20] Bhattacharyya NP, Banerjee M, Majumder P. Huntington’s disease: roles of huntingtin-interacting protein 1 (HIP-1) and its molecular partner HIPPI in the regulation of apoptosis and transcription[J]. FEBS J, 2008,275(17):4271-4279.
PotentialregulationofHIPPIincellapoptosis
ZHU Lan-hui1, LI Feng-rui1,2, ZHOU Yi-shu1, CUI Hong-gang1, PANG Hao1
(1SchoolofForensicMedicine,ChinaMedicalUniversity,Shenyang110001,China;2DepartmentofForensicMedicine,BaotouMedicalCollege,Baotou014060,China.E-mail:panghao8@gmail.com)
Huntingtin-interacting protein 1 protein interactor (HIPPI) shows a specific function of binding to free huntingtin-interacting protein 1 (HIP-1) to form pro-apoptotic HIPPI-HIP1 heterodimers. This heterodimer recruits procaspase-8 into a complex of HIPPI, HIP1 and procaspase-8, and launches apoptosis-through components of the extrinsic cell-death pathway. Exogenous expression of HIPPI in culture cell lines leads to the activation of several caspases and the release of cytochrome C and apoptosis-inducing factor (AIF) from mitochondria. In addition, HIPPI interacts with a speci-fic 9-bp sequence motif, which is defined as the HIPPI binding site (HBS), presents in the upstream promoters of caspase-1 and other genes, and regulates their expression. The extensive distribution of HIPPI in human tissues and the excessive content in the neurons of human brain suggest that HIPPI possesses important biological function and has associated with the mechanisms of neurodegeneration in Huntington’s disease. In the present review, we focus on the properties of HIPPI gene and HIPPI, the distribution and expression in human tissues, the biological functions and the pathological mechanism of the molecule.
细胞凋亡; 亨廷顿蛋白相互作用蛋白1相互作用因子; 转录调节; 亨廷顿病
Apoptosis; Huntingtin-interacting protein 1 protein interactor; Transcriptional regulation; Huntington disease
R363
A
10.3969/j.issn.1000- 4718.2013.06.031
1000- 4718(2013)06- 1136- 06
2012- 08- 01
2013- 04- 07
国家自然科学基金资助项目(No. 81172713)
△通讯作者 Tel: 024-23256666-5417; E-mail: panghao8@gmail.com

