姜黄素通过调控Notch通路促进大鼠脑缺血后神经干细胞增殖和迁移*
程建华, 刘 双, 韩 钊, 曹 红, 杨金龙
(温州医学院 1附属第一医院神经内科, 2附属第二医院麻醉科 , 浙江 温州 325000)
姜黄素通过调控Notch通路促进大鼠脑缺血后神经干细胞增殖和迁移*
程建华1△, 刘 双1, 韩 钊1, 曹 红2, 杨金龙1
(温州医学院1附属第一医院神经内科,2附属第二医院麻醉科 , 浙江 温州 325000)
目的观察姜黄素对大鼠局灶性脑缺血后室管膜下区(SVZ)神经干细胞(NSCs)增殖和迁移的影响,及其与Notch信号通路的相关性。方法采用线栓法制备大鼠大脑中动脉缺血再灌注损伤模型,随机分成假手术组(sham)、缺血再灌注组(I/R)及姜黄素治疗组(I/R+curcumin)。动物在模型成功后1 h连续腹腔注射姜黄素7 d后处死。免疫荧光法检测各组梗死侧SVZ BrdU及BrdU/DCX标记NSCs的数目及迁移趋势。Western blotting方法检测各组Notch通路的中间产物Notch 细胞内域(NICD)的表达。结果I/R+curcumin组的大鼠梗死侧SVZ BrdU及BrdU/DCX标记的NSC较I/R组显著增多(P<0.05),同时其较I/R组更广泛地分布在往病灶迁移的路径上。I/R+curcumin组较I/R组的NICD生成也增多(P<0.05)。结论姜黄素能促进缺血性大鼠脑SVZ NSCs增殖和迁移,其机制可能是通过激活Notch信号通路产生的。
姜黄素; 局灶性脑缺血; 神经干细胞; 神经再生; Notch通路
缺血性脑卒中是严重危害人类健康的疾病,存在高致残率。较多研究已经证实脑缺血能促进成年动物脑内神经干细胞(neural stem cells,NSCs)的增殖、迁移和分化,分化的新生神经元能部分地替代受损的神经元,从而在一定程度上改善神经功能缺损[1]。Notch信号通路是一条经典的保守途径,在生物发育中起重要的调控作用,属于干细胞分化的抑制性通路,可抑制NSCs向神经元和胶质细胞分化,由此间接维持干细胞的多能性和自新能力,Notch 细胞内域(Notch intracellular domain,NICD)是该通路的一个重要中间产物,有研究证实,缺血性脑卒中的大鼠NSCs的增殖、迁移和分化与Notch信号通路相关[2-3]。姜黄素(curcumin)是姜科姜黄属植物根茎的主要成分,有少量研究发现姜黄素能促进NSCs的再生[4-6]。据本研究者所知,姜黄素是否促进缺血性脑梗死NSCs再生及该影响是否与Notch通路相关,均还未见报道。本研究初步探讨姜黄素对成年大鼠局灶性脑缺血后室管膜下区(subventricular zone,SVZ)内源性NSCs增殖、迁移的影响,及通过测定NICD的变化,初步研究其与Notch信号通路的关系。
材 料 和 方 法
1试剂和仪器
激光共聚焦显微镜(Olympus FV1000,JAP);图像分析软件(ImageJ);姜黄素(Sigma)、5-溴脱氧尿嘧啶核苷(5-bromo-2’-deoxyuridine, BrdU)(Sigma)、玉米油(Sigma);绵羊抗大鼠BrdUⅠ抗(Abcam);双皮质素(doublecortin,DCX;Santa Cruz);TRITC荧光Ⅱ抗(Jackson ImmunoResearch);NICD (Santa Cruz);线栓(北京沙龙生物技术有限公司)。
2动物及分组
30只健康雄性SD大鼠,体重250~280 g,由温州医学院实验动物中心提供,合格证号为SCXK(沪)2007-0005。将大鼠随机分为假手术组(n=10)、脑缺血再灌注(cerebral ischemia/reperfusion,I/R)组(n=10)和姜黄素治疗(I/R+curcumin)组(n=10),大鼠于手术前自由饮水、饮食5 d,保持饲养环境安静,以日光采光,明暗周期各12 h,保持室温在18~22 ℃之间。大鼠在模型成功后1 h立即给予腹腔注射用药:姜黄素治疗组给予姜黄素(溶剂为玉米油)注射,其注射剂量为300 mg/kg,其余各组给予等剂量的注射用玉米油,连续给药7d。各组大鼠在处死前3 d每天腹腔注射50 mg/kg BrdU,每天2次。
3大鼠MCAO模型制作
参照Zea Longa线栓法再加以改进,以左侧大脑栓塞为例。大鼠术前禁食12 h,自由饮水。实验前腹腔注射10%水合氯醛(350 mg/kg)麻醉,颈部正中切口,分离左侧颈总动脉、颈内动脉、颈外动脉和迷走神经。颈总动脉打一活结,在颈外动脉离心端1cm处结扎颈外动脉,同时夹闭颈内动脉,然后在颈外动脉上切一小切口,将线栓插入后剪短颈外动脉,之后将线栓沿着颈内动脉入颅的方向插入,当插入约距颈总动脉分叉处18~20 mm左右时感到一轻微阻力时便立即停止插入,即表明已经阻塞住大脑中动脉。阻断120 min后,将线栓拔出,解除颈总动脉活结,贯通颈总动脉与颈内动脉通路。完成脑缺血再灌注损伤的模型。假手术组除将线栓插入深度不阻塞大脑中动脉外,其余均与上述手术步骤相同。
4免疫荧光法检测SVZ的BrdU及BrdU/DCX的标记
每组5只大鼠用于免疫荧光检测。 做厚度为4 μm的切片,利用免疫荧光检测方法检测大脑梗死侧SVZ的BrdU/DCX的表达。首先,石蜡切片脱蜡水化:在二甲苯中脱蜡30 min后放入梯度酒精中水化。其次,柠檬酸高压抗原修复3 min,自然降至室温。PBS冲洗后将切片置于2 mol/L HCl中冰上孵育10 min,室温下孵育10 min,37 ℃下孵育20 min后直接置于0.1 mol/L 硼酸中中和10 min。最后,PBS冲洗后滴加BrdUⅠ抗(1∶50)及DCX(1∶50),室温孵育1 h后4 ℃孵育过夜,12 h后滴加荧光Ⅱ抗,室温下放置30 min后利用激光共聚焦显微镜观察,拍照。阴性对照采用PBS代替Ⅰ抗的孵育,其它步骤与上述步骤相同。
5蛋白印迹法(Westernblotting)检测NICD
每组5只大鼠用于蛋白印迹检测。首先在蛋白裂解前,先将PMSF预先加入蛋白裂解液RIPA中,冰上裂解1 h,12 000×g离心15 min,取上清液。之后,利用酶标仪采用BCA法对蛋白浓度进行测定,根据画出的标准曲线算出各个蛋白样品的浓度。根据蛋白分子量大小配置10%分离胶与5%浓缩胶,根据各个样品的浓度定量吸取50 μg蛋白量,同上样缓冲液按照4∶1的比例混合,将各个样品定容到20 μL,不足体积的样品利用ddH2O补齐。在上样前首先将蛋白样品100 ℃变性5 min,再利用微量上样注射器进行上样。样品在浓缩胶及分离胶中设定的电泳电压分别为80V和100V,当溴酚蓝跑到分离胶底部时电泳完毕。之后利用湿转恒流0.3A的方式进行转膜1.5 h,蛋白样品转移到PVDF膜上后将膜取出,在5%脱脂牛奶中封闭2 h,封闭过后利用TBST轻轻冲洗即进行NICD(1∶200)Ⅰ抗4 ℃孵育过夜,16 h后将膜取出TBST摇床上冲洗3×5 min冲洗过后换成Ⅱ抗在摇床上摇晃1 h,TBST冲洗过后利用ECL显色液暗室底片曝光成像,最后利用UVI凝胶成像系统摄像后ImageJ软件进行NICD蛋白及β-actin蛋白灰度值的测定后按照其比值的大小进行最终相对表达量的比较。
6结果观察与统计学处理
各组5只大鼠,每只大鼠随机抽取6~10张不同的切片,在×400光学显微镜下,每张随机选取5个视野计数细胞。数据以均数±标准差(mean±SD)表示,采用SPSS 17.0进行统计学分析。单因素方差分析采用One-way ANOVA,方差齐性组间两两比较采用LSD检验,方差不齐组间比较采用Dunnett’s T3 法检验。检验标准为α=0.05,以P<0.05为差异有统计学意义。
结 果
图1显示,激光共聚焦显微镜下可见各组缺血侧SVZ的NSCs呈现不同程度的BrdU及BrdU/DCX抗体染色;BrdU和DCX荧光染色在镜下分别为红色和绿色,细胞呈神经元形态,BrdU分布于胞浆及胞核,DCX主要分布于胞浆。假手术组仅有少量的BrdU阳性细胞出现,而缺血再灌注组和姜黄素治疗组有大量的BrdU阳性细胞出现(P<0.01)。同缺血再灌注组相比,姜黄素治疗组的BrdU阳性细胞表达量也更多(P<0.05)。从图1A中还可以看出,姜黄素治疗组的BrdU/DCX双标阳性细胞较缺血再灌注组更广泛地分布在往病灶迁移的路径上。上述结果表明姜黄素提高了缺血性卒中后SVZ中NSCs的增殖及迁移能力。
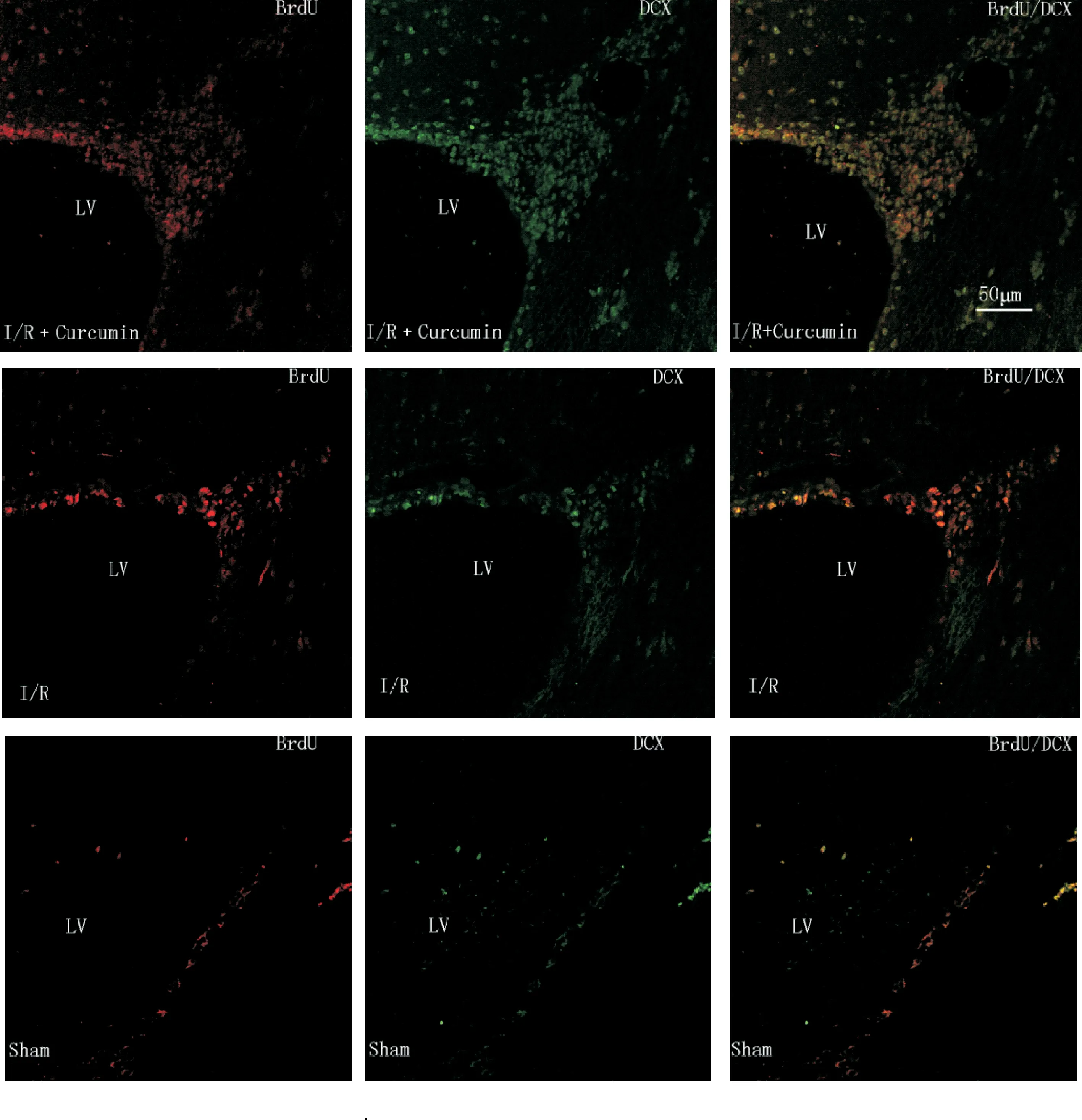
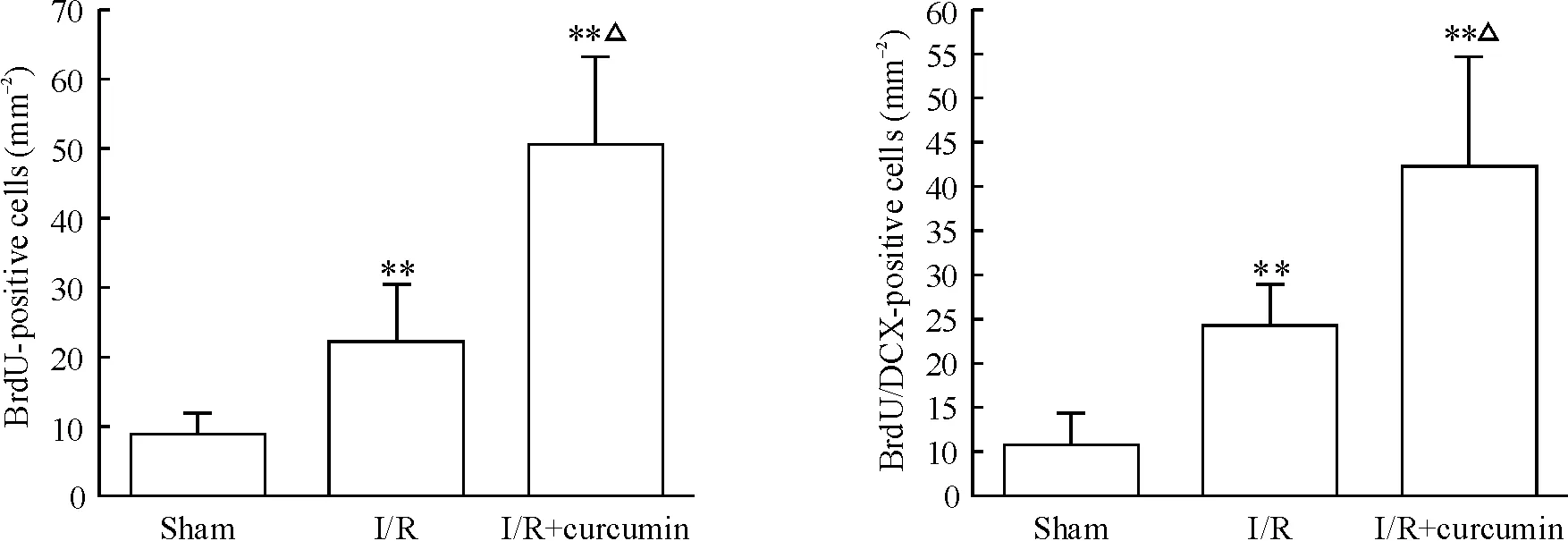
Figure 1. The 5-bromo-2'-deoxyuridine (BrdU) and doublecortin (DCX) immunofluorescent staining of ischemic lateral subventricular zone (SVZ) observed under confocal laser scanning microscope (×400) and quantitative analysis of BrdU-positive and BrdU/DCX double-positive cells. Mean±SD.n=5.**P<0.01vssham;△P<0.05vsI/R.
图1缺血侧SVZ的BrdU和DCX免疫荧光染色及BrdU阳性细胞和BrdU/DCX双标阳性细胞的定量分析
图2显示,各组大鼠缺血侧SVZ组织提取的蛋白均与NICD多抗特异性结合,在相对分子量约110 kD处出现阳性条带。与假手术组相比,姜黄素治疗组及缺血再灌注组的NICD明显增多(P<0.01),表明脑缺血能激活Notch通路。与缺血再灌注组相比,姜黄素治疗组的NICD表达更多(P<0.05),提示姜黄素治疗组较缺血再灌注组更多地激活Notch通路。
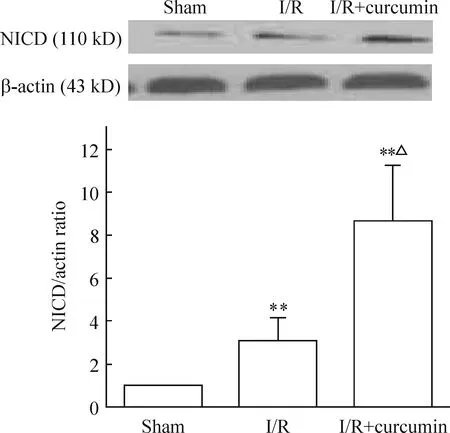
Figure 2. Western blotting analysis of NICD expression.Mean±SD.n=5.**P<0.01vssham;△P<0.05vsI/R.
图2Westernblotting分析NICD的表达
讨 论
缺血性卒中能激活脑内SVZ的内源性NSCs的增殖、迁移和分化,分化的新生神经元能部分地替代和修复受损的神经元,从而在一定程度上改善神经功能缺损[1]。本研究发现与假手术组比较,对照组SVZ BrdU阳性细胞及BrdU/DCX的阳性细胞明显增多(P<0.05),与文献报道结果一致。
有大量研究发现,缺血性卒中也能激活NSC的Notch通路[2-3]。Notch信号通路在诱导神经前体细胞选择继续增殖或向神经元分化上起着关键作用[7]。Notch受体是一个300 kD的单跨膜蛋白,当配体受体结合后,Notch蛋白相继发生2次蛋白水解,首先是被肿瘤坏死因子α转化酶(tumor necrosis factor alpha converting enzyme,TACE)酶解,然后被γ-分泌酶裂解,其胞内段被酶切,形成水溶性的NICD,并转移到胞核。NICD与胞核上的DNA结合蛋白CSL结合,形成转录因子,刺激靶因子Hes1、Hes3和Hes5等的转录,Hes1、Hes3和Hes5编码的核bHLH蛋白继而抑制其下游的某些靶点基因(其中促进神经元分化的基因有Mash-1、neurogenin、Shh等),从而抑制神经前体细胞向神经元方向分化,而保持神经前体细胞的增殖状态[7-8]。由此可见,NICD是反映Notch活性的一个重要指标,故本研究通过测定NICD来评估Notch通路的激活程度。
有研究发现,大鼠脑缺血4 h和24 h后SVZ的NICD、Hes1及Shh水平升高。给予Notch通路激动剂可以增加SVZ区的细胞增殖,而给予Notch通路的抑制剂(受体蛋白阻滞剂和γ-分泌酶抑制剂)则会减少由于缺血诱导的SVZ细胞增殖的数量[3]。国内也有报道大鼠局灶性脑缺血2 h再灌注1周、2周和3周后,额顶叶皮质Notch-1及Jagged1这2个Notch通路相关蛋白表达与假手术组相比明显增高[9]。本研究的假手术组与缺血再灌注组相比较中, Western blotting结果表明缺血再灌注组NICD水平增加明显(P<0.05),表明缺血再灌注组在此阶段激活了Notch通路,与相关研究结果相一致。
本实验重点研究了姜黄素对缺血性脑损伤后NSCs增殖及迁移的影响及其与Notch信号通路的相关性。有研究表明姜黄素可以促进神经元再生[4-6]和改善神经元的损伤[10]。通过细胞培养,姜黄素促进C17.2细胞(具有多能的神经前体细胞)及胚胎皮层神经干细胞增殖,也能促进正常成年大鼠海马的NSCs增殖。该实验还对成年海马齿状回处标记BrdU的新生神经元进行NeuN(成熟神经元标志物)染色,发现在齿状回处有大量BrdU和NeuN双染色的细胞,该实验表明姜黄素可以促进增殖的神经干细胞分化为成熟神经元[5]。从本研究的免疫荧光结果看出,在7 d与对照组相比,姜黄素在大鼠局灶性脑缺血后更能促进SVZ神经元的增殖和迁移。BrdU免疫荧光染色结果显示:在缺血后7d,姜黄素治疗组与缺血再灌注组比较,阳性细胞数更明显增多(P<0.05)。这说明了缺血性脑损伤后,姜黄素更能促进缺血诱导的NSCs增殖。DCX是一种促进微管聚合的蛋白,可代表迁移的神经细胞[11]。激光共聚焦结果显示,给予姜黄素后,BrdU/DCX双标阳性细胞数均较缺血再灌注组增多,且更广泛地分布在往病灶迁移的路径上,提示姜黄素除促进缺血后内源性NSCs的增殖外,也促进其迁移。结合Western blotting结果,姜黄素治疗组NICD的表达较缺血再灌注组增加,表明姜黄素可增加NICD的表达,并伴随BrdU/NeuN阳性细胞数的增多,从而证明姜黄素可促进局灶性脑缺血后SVZ的NSCs增殖和迁移,其作用机制可能是通过激活Notch信号通路实现的。至于姜黄素对缺血性卒中的内源性NSCs分化及与Notch通路的关系有待进一步研究。
综上所述,姜黄素可以促进大鼠局灶性脑缺血后SVZ的NSCs增殖和迁移,这一效应可能是通过激活Notch信号通路实现的。
[1] Shruster A, Ben-Zur T, Melamed E,et al. Wnt signaling enhances neurogenesis and improves neurological function after focal ischemic injury[J]. PLoS One, 2012,7(7):e40843.
[2] Zhang X, Huang G, Liu H, et al. Folic acid enhances Notch signaling, hippocampal neurogenesis, and cognitive function in a rat model of cerebral ischemia[J]. Nutr Neurosci, 2012,15(2):55-61.
[3] Wang X, Mao X, Xie L, et al. Involvement of Notch1 signaling in neurogenesis in the subventricular zone of normal and ischemic rat braininvivo[J]. J Cereb Blood Flow Metab, 2009,29(10):1644-1654.
[4] Dong S, Zeng Q, Mitchell ES, et al. Curcumin enhances neurogenesis and cognition in aged rats: implications for transcriptional interactions related to growth and synaptic plasticity[J] .PLoS One,2012,7(2):e31211.
[5] Kim SJ, Son TG, Park HR, et al.Curcumin stimulates proliferation of embryonic neural progenitor cells and neurogenesis in the adult hippocampus[J]. J Biol Chem, 2008 ,283(21):14497-14505.
[6] Xu Y, Ku B, Cui L, et al.Curcumin reverses impaired hippocampal neurogenesis and increases serotonin receptor 1A mRNA and brain-derived neurotrophic factor expression in chronically stressed rats[J]. Brain Res,2007,1162:9-18.
[7] Androutsellis-Theotokis A, Leker RR, Soldner F,et al. Notch signalling regulates stem cell numbersinvitroandinvivo[J].Nature, 2006,442(7104):823-826.
[8] Xiao MJ, Han Z, Shao B, et al. Notch signaling and neurogenesis in normal and stroke brain[J].Int J Physiol Pathophysiol Pharmacol,2009,1(2):192-202.
[9] 胡建鹏,周 会,王 键,等.益气活血方和补肾生髓方对局灶性脑缺血再灌注大鼠缺血半暗带Notch-1和Jagged1表达的影响[J].中国病理生理杂志,2010,26(3):483-486.
[10] 行妍妍,汪军兵,谢 赛,等.姜黄素对放线菌素D/TNF-α诱导的PC12细胞和大鼠海马神经元损伤的影响[J].中国病理生理杂志,2012,28(10):1746-1750.
[11] Filipovic R, Santhosh Kumar S, Fiondella C, et al. Increasing doublecortin expression promotes migration of human embryonic stem cell-derived neurons[J].Stem Cells,2012,30(9):1852-1862.
视网膜波在整个视觉系统发育过程中协调形成图案的活动
脊椎动物神经系统的形态与功能的发育最初由遗传因子支配,随后再由神经元的活动进行精细调节。然而,神经系统的基本特点在感官体验之前显现是有可能的。因此,在经验发生之前的功能依赖性神经系统发育必然是由自发性活动驱动的。为了验证这种体内自发性活动的起源和性质,美国耶鲁大学医学院Ackman等用视觉光学的研究方法检测新生小鼠,发现小鼠在睁眼之前就存在自发性的视网膜活动波,并在整个视觉系统播散。这种形成图案的活动(patterned activity)包括整个视野,依赖于胆碱能神经传递。这种活动优先起源于双眼视网膜,展示了两个半球之间的时空相互关联。视网膜活动波是中脑和初级视皮层活动的起始来源,但仅调节次级视觉区正在进行的活动。因此,这种视网膜的自发性活动可在整个视觉系统中传播,它所携带的组成图形的信息能够在视觉体验产生之前引导半球内及半球间复杂环路的活动依赖性发育。
Nature, 2012, 490(7419):219-227(罗小鹏)
CurcuminpromotesproliferationandmigrationofneuralstemcellsincerebralischemicratsbyregulatingNotchsignaling
CHENG Jian-hua1, LIU Shuang1, HAN Zhao1, CAO Hong2, YANG Jin-long1
(1DepartmentofNeurology,theFirstAffiliatedHospital,2DepatrtmentofAnesthesiology,theSecondAffiliatedHospital,WenzhouMedicalCollege,Wenzhou325000,China.E-mail:cjhua23@tom.com)
AIM: To investigate the proliferation and migration of neural stem cells (NSCs) in the subventricular zone (SVZ) on focal cerebral ischemia with curcumin treatment, and to explore the relationship between these effects and Notch signaling.METHODSThe animal model was established by an intraluminal suture method to induce middle cerebral artery occlusion in rats. The rats were randomly divided into sham group, cerebral ischemia/reperfusion (I/R) group, and I/R+curcumin group. The animals were given curcumin for 7 d intraperitoneally. One hour after the model was successfully established, the rats were sacrificed. Immunofluorescence was used to label the NSCs by BrdU and BrdU/DCX, and the migration tendency was observed. The expression of Notch intracellular domain (NICD, the Notch signaling pathway intermediate product) was detected by Western blotting.RESULTSCompared with I/R group, BrdU-positive and BrdU/DCX double positive cells in I/R+curcumin group were significantly higher than those in I/R group (P<0.05), and more positive cells were on the way of migration to the ischemic lesion zone. The expression level of NICD in I/R+curcumin group was significantly higher than that in I/R group (P<0.05).CONCLUSIONCurcumin promotes NSC proliferation and migration in SVZ after focal cerebral ischemia. The possible mechanism may be that curcumin activates Notch signaling.
Curcumin; Focal cerebral ischemia; Neural stem cells; Neurogenesis; Notch pathway
R743
A
10.3969/j.issn.1000- 4718.2013.05.019
1000- 4718(2013)05- 0878- 05
2012- 11- 05
2013- 01- 22
浙江省中医药管理局科研项目(No.2010ZB093)
△通讯作者 Tel: 0577-55579365; E-mail: cjhua23@tom.com

