STAT3介导了血小板源性生长因子BB诱导的大鼠血管平滑肌细胞Pim-1表达*
孙晓东, 王 燕, 王汉琴, 2, △, 黄铁柱
(湖北医药学院 1基础医学研究所, 2附属太和医院生命科学研究所, 3人体解剖学教研室,湖北 十堰 442000)
STAT3介导了血小板源性生长因子BB诱导的大鼠血管平滑肌细胞Pim-1表达*
孙晓东1, 王 燕1, 王汉琴1, 2, 3△, 黄铁柱3
(湖北医药学院1基础医学研究所,2附属太和医院生命科学研究所,3人体解剖学教研室,湖北 十堰 442000)
目的观察血小板源性生长因子BB(PDGF-BB)是否可以诱导大鼠血管平滑肌细胞(VSMCs)表达Pim-1及Pim-1对VSMCs增殖的影响,探讨STAT3信号分子在这一过程中的作用,为血管重建性疾病(VRD)的研究提供实验依据。方法不同浓度PDGF-BB作用不同时间刺激体外培养的VSMCs,用细胞计数法检测增殖;用real-time RT-PCR 检测Pim-1 mRNA表达水平;Western blotting 检测STAT3 的活性变化;用放线菌素D(actinomycin D)、AG490(JAK特异性抑制剂)及siRNA沉默Pim-1和STAT3进行干预。结果PDGF-BB(20 μg/L)作用VSMCs 24 h,可以诱导细胞增殖,Pim-1沉默抑制了这一过程;正常未经处理的VSMCs Pim-1 mRNA表达量较低,不同浓度PDGF-BB(10 μg/L~50 μg/L )作用VSMCs 1 h,Pim-1 mRNA表达明显增加,其中以20 μg/L最显著;用PDGF-BB(20 μg/L)作用VSMCs 不同时间(0.5 h~4 h),可显著上调Pim-1 mRNA表达,以0.5 h最显著。用actinomycin D及AG490预处理后Pim-1 mRNA表达随之降低。PDGF-BB可激活VSMCs中磷酸化STAT3水平,AG490和转染STAT3-siRNA可抑制 STAT3的磷酸化以及相应的Pim-1 mRNA表达。结论PDGF-BB可通过Pim-1调节VSMCs增殖;STAT3可能参与了PDGF-BB诱导的VSMCs Pim-1表达。
Pim-1蛋白; STAT3转录因子; 血管平滑肌细胞; RNA干扰; 血小板源性生长因子BB
血管平滑肌细胞(vascular smooth muscle cells, VSMCs)增殖是血管重建性疾病(vascular remodeling diseases, VRD),如高血压、动脉粥样硬化、血管成形术后再狭窄等共同的病理基础。多种生长因子和细胞因子可通过与细胞膜受体的相互作用,进而激活胞内相关信号通路,启动增殖相关基因的表达,引起 VSMCs 增殖而导致受损血管狭窄。因此,研究 VSMCs 增殖的关键基因及可能的信号转导机制,对探讨VRD血管重建的发生过程有重要意义。
Pim-1是一种丝/苏氨酸蛋白激酶,是Pim 激酶家族(现发现的有Pim-1、Pim-2和Pim-3)中的一员[1],与其它丝/苏氨酸蛋白激酶如丝氨酸苏氨酸蛋白激酶(serine/threonine-protein kinase,Akt)、丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)等类似,Pim-1能使在细胞生长通路中起关键作用的蛋白质分子内的丝/苏氨酸残基磷酸化,从而引起细胞增殖、分化、转化等生物学反应[2]。目前有关Pim-1功能的研究多集中在肿瘤细胞的增殖、凋亡及干细胞分化方面,而在非转化细胞中的研究尚少。研究证实,血小板源性生长因子BB(platelet-derived growth factor BB, PDGF-BB)能够通过上调Pim-1基因表达调节VSMCs增殖[3],但具体信号机制不明。新近的研究发现,肺动脉高压患者肺动脉平滑肌细胞高表达Pim-1可能和STAT3的激活有关[4]。本研究拟探讨PDGF-BB对体外培养的大鼠主动脉VSMCs Pim-1 mRNA表达的影响,以及可能参与信号转导的STAT3活性变化,为VRD研究提供实验依据。
材 料 和 方 法
1主要试剂和仪器
重组人PDGF-BB购自Prospec;DMEM、LipofectamineTM2000 转染试剂和Opti-MEM 培养基购自Invitrogen;胎牛血清购自Gibco;Trizol 购自Invitrogen;逆转录试剂盒购自Promega;SYBR-Green荧光定量PCR试剂盒购自Invitrogen; actinomycin D、AG490、wortmannin和rapamycin 均购自Sigma;兔抗p-STAT3和STAT3的多克隆抗体购自Cell Signaling Technology;碱性磷酸酶标记的山羊抗兔和马抗小鼠的Ⅱ抗购自北京中衫金桥生物技术有限公司。其它生化试剂均为进口分装或国产分析纯。所用引物由生工生物工程(上海)有限公司合成,干扰序列由上海吉玛制药技术有限公司设计、合成。
二氧化碳培养箱为Thermo 产品;倒置相差显微镜为Olympus 产品;ScepterTM手持式细胞计数器(PHCCOOOKIT)为Milipore 产品。680 型酶标分析仪和垂直凝胶电泳槽为Bio-Rad 产品;高速冷冻离心机为Heraeus Beckman 产品;Stepone plus Real-Time PCR System 为ABI 产品。
2方法
2.1大鼠VSMCs的培养 参照文献[5],选6~8周龄雄性SD大鼠,3%戊巴比妥钠麻醉后,无菌条件下取胸主动脉,眼科镊剥离外膜,纵行切开血管,消毒棉签擦去内膜层后,将中膜剪成1~2 mm2大小的组织块,均匀贴在培养皿底面上,加入适量含20%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的DMEM培养基,在37 ℃含5% CO2的恒温孵育箱中培养。3~4 d可见细胞从组织周边爬出,1周后用0.125%胰蛋白酶消化传代,倒置显微镜下见传代细胞呈典型的“峰-谷”样生长,免疫细胞化学染色见细胞内α-肌动蛋白呈阳性,确定为平滑肌细胞。实验所用细胞在4~8代。
2.2逆转录和实时定量PCR(real-time RT-PCR) 将细胞以1×105cells/well接种于6孔培养板中,待细胞长满孔底约70 %,换无血清DMEM饥饿同步24 h后分组进行实验。用500 μL Trizol裂解各组VSMCs,提取总RNA并用逆转录试剂盒逆转录为cDNA,以cDNA为模板进行real-time RT-PCR检测,以GAPDH为内参照调整模板的浓度。实验所用引物如下:Pim-1上游引物5’-CACGACGAAGAGATCGTCAA-3’,下游引物5’-GCTATTTGCTGGGTGATGGT-3’;STAT3上游引物5’-CGCCACTCTGGTGTTTCATA-3’,下游引物5’-CAGGAACTGCTTGATTCTTCG-3’;GAPDH上游引物5’-GGCAGCCCAGAACATCATCC-3’,下游引物5’-GCCAGCCCCAGCATCAAAG-3’。每个样品反应总体系20 μL 。PCR 反应条件:95 ℃ 5 min,95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,30个循环。然后进行数据分析,各目的基因表达水平的变异用变化倍率(2-ΔΔCt) 来表示。
2.3siRNA干扰实验 以1×105cells/well将细胞接种到6 孔板,待细胞生长至 70%时,用LipofectamineTM2000介导siRNA转染,实验方法按说明书进行。转染36 h后,提取各组总RNA进行real-time RT-PCR检测,提取各组总蛋白进行Western blotting检测。Pim-1 siRNA序列正义链5’-CAAGGACGAGAACAUCUATT-3’,反义链5’-UAAGAUGUUCUCGUCCUUGAT-3’。STAT3 siRNA序列正义链5’-GCAGGAUCUAGAACAGAAATT-3’,反义链5’-UUUCUGUUCUAGAUCCUGCTT-3’。
2.4细胞计数 取对数生长期的VSMCs以 2×104cells/well 的密度种到 24孔板中,待细胞生长至 70 % 时,先进行Pim-1干扰实验,后再加入PDGF-BB(20 μg/L)继续培养 24 h,胰酶消化法收集细胞,用ScepterTM细胞计数器进行细胞计数。
2.5蛋白免疫印记(Western blotting) 收集各组的VSMCs,用冰PBS洗3次,加入含有蛋白酶抑制剂的细胞裂解液冰上处理20 min,离心后吸取上清。用10% SDS-PAGE凝胶电泳分离蛋白,蛋白上样量30 μg。转膜后用5 % 脱脂奶粉的TBST封闭2 h,分别加兔抗p-STAT3和STAT3的多克隆抗体(1∶1 000);鼠抗tubulin的多克隆抗体(1∶500),4 ℃ 孵育过夜;TBST洗膜后加碱性磷酸酶标记的山羊抗兔和马抗小鼠的Ⅱ抗(1∶1 000),室温摇床上孵育2 h,洗膜后用5-溴-4-氯-3-吲哚基-磷酸盐/四唑氮蓝显色液膜上显色,扫描后进行图像灰度分析。
2.6Actinomycin D、AG490、wortmannin和rapamycin的使用 用DMSO溶解基因转录阻断剂actinomycin D、JAK抑制剂AG490、PI3K抑制剂wortmannin和mTOR抑制剂rapamycin。接种于6孔板的VSMCs同步24 h后,加入actinomycin D (1 mg/L)、AG490(100 mmol/L)、rapamycin(200 μmol/L)和wortmannin(200 μmol/L),加入同体积的DMSO为对照,孵育20 min,再加入PDGF-BB(20 μg/L)作用30 min。
3统计学处理
数据用均数±标准差(mean ± SD)表示。组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1Pim-1对PDGF-BB诱导的VSMCs增殖的影响
Real-time RT-PCR检测结果如图1A所示,筛选出的有效片段能有降低VSMCs 中Pim-1 mRNA 水平(P<0.05),而对Pim-3 没有影响。转染后的各组细胞,用PDGF-BB孵育24 h,VSMCs明显增殖,而siPim-1+PDGF-BB组显著抑制了PDGF-BB 诱导的VSMCs 增殖(P<0.05),见图1B。
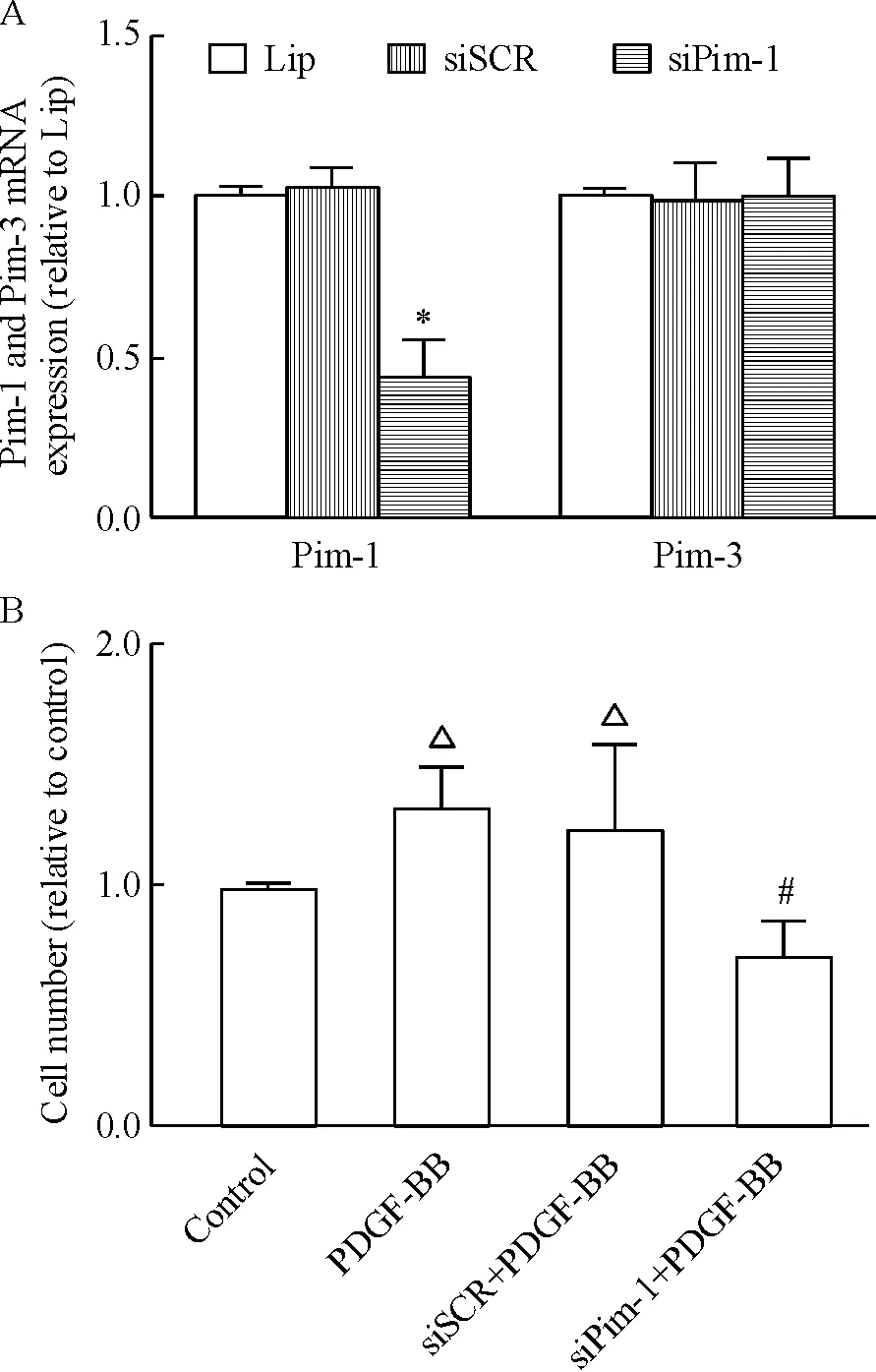
Figure 1.Pim-1 gene silencing (A) suppressed the proliferation of VSMCs induced by PDGF-BB (B).Mean±SD.n=3.*P<0.05vssiSCR or Lip;△P<0.05vscontrol;#P<0.05vssiSCR+PDGF-BB.
图1沉默Pim-1基因抑制PDGF-BB诱导的VSMCs增殖
2PDGF-BB对VSMCsPim-1mRNA表达的影响
接种于6孔板的VSMCs同步24 h后,以不同浓度的PDGF-BB作用相同时间(1 h),结果如图2A所示。与对照组比,除 5 μg/L组外,10 μg/L、20 μg/L和50 μg/L各组均能明显增强Pim-1 mRNA的表达(P<0.05),以20 μg/L组最显著。以同一浓度(20 μg/L)的PDGF-BB作用不同时间,结果如图2B所示,VSMCs中Pim-1 mRNA在短时间(0.5 h)作用组表达最强,随PDGF-BB作用时间延长而减弱。
3各种阻断剂对PDGF-BB诱导的Pim-1mRNA表达的影响
如图3所示,与未加阻断剂组相比,用actinomycin D和AG490预处理的 VSMCs中Pim-1 mRNA的表达显著降低(P<0.05),而用wortmannin(PI3K抑制剂)和rapamycin(mTOR抑制剂)预处理的VSMCs中Pim-1 mRNA表达都有明显上升(P<0.05)。
4PDGF-BB激活STAT3

Figure 2. Effects of PDGF-BB on the expression of Pim-1 mRNA in VSMCs.A: different concentrations of PDGF-BB for 1 h; B: 20 μg/L PDGF-BB for different time.Mean±SD.n=4.*P<0.05vscontrol;▲P<0.05vs5 μg/L;#P<0.05vs10 μg/L;△P<0.05vs0.5 h.
图2PDGF-BB诱导VSMCs中Pim-1mRNA表达
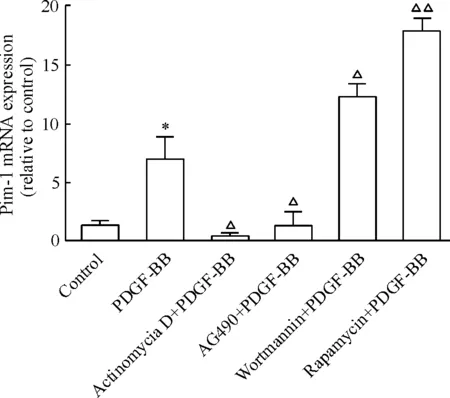
Figure 3. Effects of actinomycin D,AG490,wortmannin and rapamycin on Pim-1 mRNA expression induced by PDGF-BB.Mean±SD.n=4.*P<0.05vscontrol;△P<0.05,△△P<0.01vsPDGF-BB.
图3ActinomycinD、AG490、wortmannin和rapamycin对PDGF-BB诱导的VSMCsPim-1mRNA表达的影响
PDGF-BB(20 μg/L)作用不同时间,Western blotting结果显示(图4A),与0 min相比,PDGF-BB作用5 min可显著激活VSMCs p-STAT3表达,15 min、30 min、60 min和120 min后,随时间的延长逐渐减弱。用JAK抑制剂AG490预孵育20 min后,再用PDGF-BB 刺激10 min,如图4B所示,与未加抑制剂组相比,p-STAT3的表达明显被抑制。
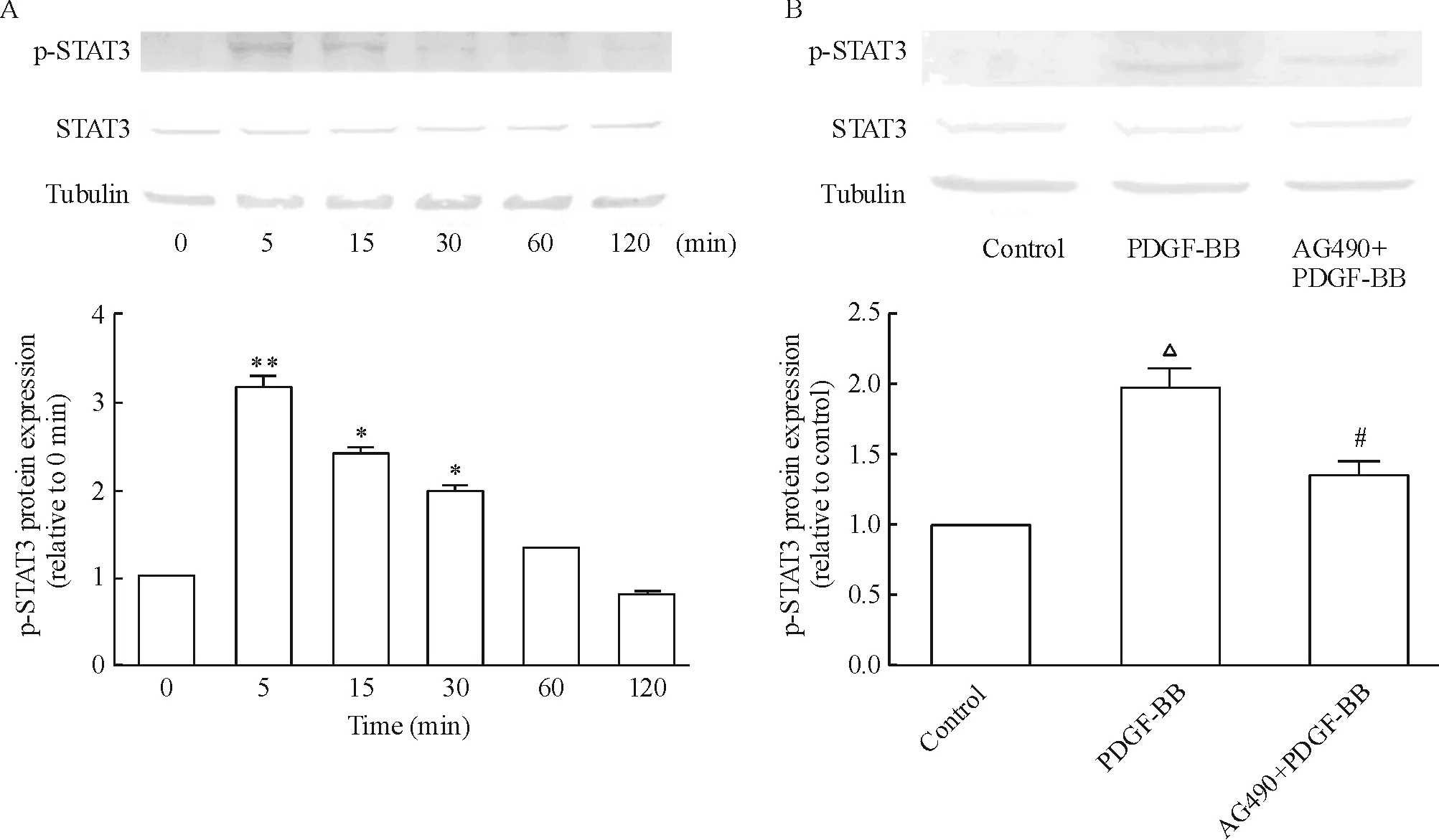
Figure 4. Western blotting was performed to detect the effect of PDGF-BB on phosphorylated STAT3 (p-STAT3) expression. A:20 μg/L PDGF-BB for different time;B:effects of PDGF-BB and JAK inhibitor AG490. Mean±SD.n=3.*P<0.05,**P<0.01vs0 min;△P<0.05vscontrol;#P<0.05vsPDGF-BB.
图4免疫印迹法显示PDGF-BB对STAT3蛋白磷酸化的影响
5沉默STAT3对VSMCsPim-1mRNA表达的影响
Real-time RT-PCR检测结果如图5A所示,筛选出的有效片段能有效降低VSMCs 中STAT3 mRNA 水平(P<0.05),而对STAT1没有影响。转染后的细胞提取蛋白,Western blotting结果如图5B所示,siSTAT3明显抑制了STAT3蛋白表达量(P<0.05)。转染后的各组细胞,用PDGF-BB孵育1 h,real-time RT-PCR结果如图5C所示,与siSCR+PDGF-BB相比,siSTAT3+PDGF-BB显著抑制了Pim-1 mRNA表达(P<0.05)。
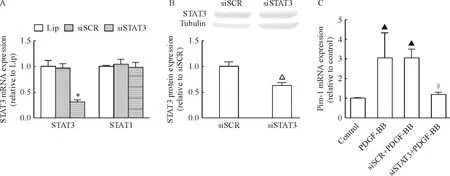
Figure 5. Small interfering RNA (siRNA) forSTAT3 (A:STAT3 mRNA;B:STAT3 protein) suppressed Pim-1 mRNA expression induced by PDGF-BB (C).Mean±SD.n=3.*P<0.05vssiSCR or Lip;△P<0.05vssiSCR;▲P<0.05vscontrol;#P<0.05vssiSCR+PDGF-BB.
图5siSTAT3转染VSMCs后对PDGF-BB诱导的Pim-1mRNA表达的影响
讨 论
研究发现,PDGF-BB可以通过Pim-1调节细胞周期蛋白p21而促进VSMCs增殖[3];肺动脉高压后肺动脉血管壁平滑肌细胞增殖和高表达Pim-1有关[4];还证实Pim-1作为一种VEGF的反应基因,参与调节球囊损伤后的VSMCs的增殖[6],提示Pim-1可能是促进VSMCs增殖的相关基因。
我们首先证实沉默Pim-1基因后,能抑制PDGF-BB诱导的VSMCs增殖,这一结果与文献报道一致[3]。接下来观察PDGF-BB对Pim-1 mRNA表达的影响及可能的信号机制,结果发现Pim-1 mRNA在正常未经处理的VSMCs上表达较低,低浓度PDGF-BB(5 μg/L)不能上调Pim-1 mRNA表达,浓度在10~50 μg/L则可显著上调Pim-1 mRNA表达。从时间梯度结果来看,选择PDGF-BB(20 μg/L)刺激细胞30 min,即可显著上调Pim-1 mRNA表达,维持到1 h后随之降低,说明 PDGF-BB瞬时(transient)调节Pim-1 mRNA表达,这一结果与已有的报道一致[7-8]。另外,由于mRNA水平的多少主要取决于该基因转录活化的程度与生成mRNA的稳定性[9],我们用基因转录抑制剂(actinomycin D)预处理VSMCs,发现actinomycin D完全阻断了PDGF-BB诱导的Pim-1 mRNA表达,说明PDGF-BB上调Pim-1 mRNA是发生在转录水平。
STAT3蛋白是近年来研究异常活跃的转录因子,在细胞因子和生长因子的作用下,通过JAK 或丝氨酸激酶诱导,STAT3被激活并形成p-STAT3,进入细胞核后与目的基因的启动子区域结合,调节靶基因转录。通过基因芯片技术,有研究发现在人T细胞内,活化的STAT3能直接与Pim-1启动子上GAS序列结合而使Pim-1基因表达上调[10]。据此,我们推测PDGF-BB可能是通过JAK/STAT3信号通路来调节Pim-1 mRNA表达。为了验证这一推测,我们先用AG490(JAK特异性阻断剂)预处理VSMCs,发现AG490明显抑制了PDGF-BB诱导的Pim-1 mRNA表达,通过Western blotting方法,证实PDGF-BB可以促进STAT3蛋白的活化,AG490可以阻断VSMCs中STAT3的活化,从而下调Pim-1 mRNA表达。分析Western blotting结果还发现,PDGF-BB激活STAT3蛋白发生在PDGF-BB刺激5 min,活化的STAT3维持到30 min 后逐渐减弱,而Pim-1 mRNA表达最高发生在PDGF-BB诱导30 min,也就是说PDGF-BB诱导Pim-1 mRNA表达在PDGF-BB活化STAT3之后发生,这一结果和高糖基化终产物受体诱导VSMCs表达Pim-1相似[8],也提示STAT3可能有调节Pim-1 mRNA表达的作用。这一点在下一步通过siRNA靶向沉默STAT3后得到了证实,STAT3基因沉默后,PDGF-BB不能上调Pim-1 mRNA表达。以上结果证明了PDGF-BB是通过JAK/STAT3信号通路来调节Pim-1 mRNA表达变化,但活化的STAT3是否与Pim-1 启动子序列结合而调节Pim-1的转录,还有待后续实验进一步证实。另外,在这个实验中,我们还用了PI3K抑制剂(wortmannin)和mTOR抑制剂(rapamycin),发现Pim-1 mRNA表达没有被抑制,相反是显著上调,提示PI3K/Akt/mTOR信号通路可能对Pim-1的调节呈现负性调控,这一点也有待进一步探讨。
本文观察了PDGF-BB对大鼠VSMCs中Pim-1 mRNA表达的影响,发现PDGF-BB(20 μg/L)对Pim-1表达影响最大,并呈现瞬时性,而且与JAK/STAT3信号通路有关。这些结果提示,Pim-1可能是PDGF-BB诱导VSMCs增殖的下游靶基因之一,PDGF-BB可能通过Pim-1改变VSMCs的迁移、增殖等功能而调节血管重建。
[1] Reeves R, Spies GA, Kiefer M, et al. Primary structure of the putative human oncogene,pim-1 [J]. Gene, 1990, 90(2):303-307.
[2] Shah N, Pang B, Yeoh KG, et al. Potential roles for the PIM1 kinase in human cancer: a molecular and therapeutic appraisal [J]. Eur J Cancer, 2008, 44(15):2144-2151.
[3] Willert M, Augstein A, Poitz DM, et al. Transcriptional regulation of Pim-1 kinase in vascular smooth muscle cells and its role for proliferation [J].Basic Res Cardiol, 2010,105(2):267-277.
[4] Paulin R, Courboulin A, Meloche J, et al. Signal transducers and activators of transcription-3/Pim1 axis plays a critical role in the pathogenesis of human pulmonary arterial hypertension [J]. Circulation, 2011, 123(11):1205-1215.
[5] 刘宇宏,王莎莎,沈凌汛,等. IL-32γ对大鼠血管平滑肌细胞增殖与细胞周期的影响 [J]. 中国病理生理杂志,2012, 28(2): 239-243.
[6] Katakami N, Kaneto H, Hao H, et al. Role of Pim-1 in smooth muscle cell proliferation [J]. J Biol Chem, 2004, 279(52):54742-54749.
[7] Aho TL, Lund RJ, Ylikoski EK, et al. Expression of humanpimfamily genes is selectively up-regulated by cytokines promoting T helper type 1, but not T helper type 2, cell differentiation [J]. Immunology, 2005,116(1):82-88.
[8] Meloche J, Paulin R, Courboulin A, et al. RAGE-dependent activation of the oncoprotein Pim1 plays a critical role in systemic vascular remodeling processes [J]. Arterioscler Thromb Vasc Biol, 2011,31(9):2114-2124.
[9] Chin CF, Shih AC, Fan KC. Influence of mRNA decay rates on the computational prediction of transcription rate profiles from gene expression profiles [J]. J Biosci, 2007, 32(7):1251-1262.
[10] Matikainen S, Sareneva T, Ronni T, et al. Interferon-α activates multiple STAT proteins and upregulates proliferation-associatedIL-2Rα,c-myc, andpim-1 genes in human T cells [J]. Blood, 1999,93(6):1980-1991.
STAT3mediatesPDGF-BB-inducedPim-1expressioninratvascularsmoothmusclecells
SUN Xiao-dong1, WANG Yan1, WANG Han-qin1, 2, 3, HUANG Tie-zhu3
(1InstituteofBasicMedicalSciences,2InstituteofLifeSciences,TaiheHospital,3DepartmentofHumanAnatomy,HubeiUniversityofMedicine,Shiyan442000,China.E-mail:hanqinwang111@yahoo.com.cn)
AIM: To study the expression of Pim-1 in vascular smooth muscle cells (VSMCs) induced by platelet-derived growth factor BB (PDGF-BB).METHODSVSMCs isolated from rats were treated with different concentrations of PDGF-BB for different time. The proliferation of VSMCs was detected by cell counting. The mRNA expression of Pim-1 was measured by real-time RT-PCR. The STAT3 activity was determined by Western blotting. Actinomycin D, AG490, and small interfering RNA (siRNA) forPim-1 orSTAT3 were used to investigate the underlying mechanisms.RESULTSPim-1 gene silencing attenuated the proliferation of VSMCs in response to PDGF-BB. The mRNA expression of Pim-1 was up-regulated by PDGF-BB at concentrations of 10 μg/L~50 μg/L for 1 h, and was maximally induced at the concentration of 20 μg/L. The time of Pim-1 mRNA expression maximally occurred 30 min after PDGF-BB exposure. Incubation of VSMCs with PDGF-BB resulted in a significant activation of STAT3. VSMCs pretreated with actinomycin D showed a significant decrease in the mRNA expression of Pim-1. Treatment with AG490 or knockdown ofSTAT3 in VSMCs resulted in inactivation of STAT3, and significantly suppressed the mRNA expression of Pim-1.CONCLUSIONPDGF-BB-induced VSMC proliferation is partly attributed to Pim-1. VSMCs strongly increase Pim-1 mRNA upon stimulation with PDGF-BB, and STAT3 signaling pathway appears to be efficient for regulation of Pim-1 expression. This process may play a critical role in development of vascular remodeling.
Pim-1 protein; STAT3 transcription factor; Vascular smooth muscle cells; RNA interference; Platelte-derived growth factor BB
Q78
A
10.3969/j.issn.1000- 4718.2013.05.006
1000- 4718(2013)05- 0804- 06
2012- 11- 12
2013- 03- 26
国家自然科学基金资助项目(No. 30770535);湖北省高等学校优秀中青年科技创新团队计划(No.T201008);湖北省自然科学基金资助项目(No. 2012FFB03903)
△通讯作者 Tel: 0719-8891156; E-mail: hanqinwang111@yahoo.com.cn

