T-cadherin在脂联素抑制缺氧/复氧导致的乳鼠心肌细胞凋亡中的作用*
孙亚丽, 边云飞, 孙 旭, 刘改珍, 白 瑞, 肖传实
(山西医科大学第一附属医院心内科,山西 太原 030001)
T-cadherin在脂联素抑制缺氧/复氧导致的乳鼠心肌细胞凋亡中的作用*
孙亚丽, 边云飞△, 孙 旭, 刘改珍, 白 瑞, 肖传实
(山西医科大学第一附属医院心内科,山西 太原 030001)
目的通过腺病毒介导的RNA干扰技术沉默一种新的脂联素(APN)受体T-cadherin的表达,并建立心肌细胞缺氧/复氧(H/R)模型, 观察T-cadherin对H/R所致心肌细胞凋亡的影响。方法选用原代培养72 h的心肌细胞进行实验,随机分为5组:(1)空白对照组:心肌细胞正常培养;(2)H/R组;(3)APN+H/R组;(4)Ad-T-cadherin-siRNA+APN+H/R组;(5)Ad-HK(腺病毒阴性对照)+APN+H/R组。首先,确定最适合的腺病毒感染滴度,RT-PCR和Western blotting检测腺病毒介导的干扰RNA对T-cadherin表达的影响效果;其次,通过流式细胞术和TUNEL检测心肌细胞的凋亡。结果原代培养获得高纯度的乳鼠心肌细胞。腺病毒感染的最佳MOI值为100,48 h后腺病毒的感染效率和红色荧光蛋白表达最强,其效率高于90%。RT-PCR和Western blotting证实腺病毒介导的siRNA转染的心肌细胞T-cadherin mRNA和蛋白水平均明显下降(P<0.05)。Ad-T-cadherin-siRNA+APN+H/R组心肌细胞凋亡率与APN+H/R组相比显著升高(P<0.05),与H/R组相比差异无统计学意义(P>0.05)。结论重组腺病毒Ad-T-cadherin-siRNA能够在体外高效感染原代心肌细胞,并成功降低T-cadherin在心肌细胞的表达;低表达的T-cadherin阻断了脂联素对缺氧/复氧诱导的乳鼠心肌细胞凋亡的抑制作用。
脂联素; T-钙黏蛋白; 心肌细胞; RNA干扰; 缺氧/复氧
脂联素(adiponectin,APN)是由脂肪组织分泌的一种激素,且在体内代谢平衡中发挥着重要的作用,近年多项研究显示脂联素有抗炎、抗动脉硬化、抗胰岛素抵抗的作用[1-2]。另外,脂联素还参与了缺血/再灌注 (ischemia/reperfusion,I/R)损伤的心肌保护[3]。目前多数研究认为,脂联素可能是与其特异性受体(adiponectin receptor,AdipoR;分为AdipoR1和AdipoR2)结合后发挥其生物学效应的。但是2004年Hug用分子克隆技术发现T-钙黏蛋白(T-cadherin,T-cad)是脂联素的一种新受体,属于钙黏蛋白家族,且T-cad是脂联素六聚体和高分子量多聚体的受体,不与脂联素球状结构域和脂联素三聚体结合[4]。继Yamauchi等[5]克隆了脂联素受体AdipoR1与AdipoR2后,AdipoR又成为研究热点。经典的钙黏蛋白分子由细胞外钙结合区及跨膜区两部分组成,但T-cad缺失跨膜区而经糖基磷脂酰肌醇(glycosyl phosphatidylinositol,GPI)附着于细胞膜上,其组织分布非常广泛,在心血管系统表达水平最高[6]。我实验室前期实验发现心肌细胞缺氧、复氧(hyposia/reoxygenation,H/R)后,APN 受体T-cad 的mRNA和蛋白水平明显降低;而APN 预处理后再进行H/R,上述改变均能得到较大程度的逆转,并且呈现一定的剂量依赖效应[7]。因此我们猜想:在脂联素对缺血再灌注心肌细胞发挥保护作用中,T-cad可能起着关键性的作用。
材 料 和 方 法
1动物
健康Sprague-Dawley (SD) 乳鼠,1~3日龄,雌雄不限,由山西医科大学实验动物中心提供。
2主要试剂
3主要方法
3.1乳鼠心肌细胞培养 取1~3日龄SD大鼠乳鼠,75%乙醇消毒,在剑突上一肋沿胸骨左缘剪开皮肤,弯镊取出心脏,置于预冷的D-Hanks液中洗净血污,剥离心房及大血管,剔除结缔组织及脂肪,用眼科剪剪成1 mm×1 mm×1 mm小块,加入含0.0625%胰酶消化3 min,静置,自然沉淀后去上清液,再加入1%Ⅱ型胶原酶消化吹打3 min,自然沉淀,留取上清液,加入含20%胎牛血清的DMEM中止消化,重复Ⅱ型胶原酶的消化2~3次,将收集的细胞悬液1 000 r/min离心10 min,弃上清,沉淀中加入含20%胎牛血清的DMEM高糖培养液将细胞接种于6孔板中并置培养箱(5%CO2、37 ℃)培养90 min后,差速贴壁去除成纤维细胞。48 h后换液,倒置显微镜观察。
3.2心肌细胞H/R模型的建立 采用Esumi等改进的方法,配制缺氧液和复氧液。缺氧液组成(mmol/L): 137 NaCl, 12 KCl, 0.49 MgCl2, 0.9 CaCl2, 4.0 HEPES, 10脱氧葡萄糖,20乳酸钠,pH 6.2;复氧液组成(mmol/L): 137 NaCl, 3.8 KCl, 0.49 MgCl2, 0.9 CaCl2, 4.0 HEPES, 10脱氧葡萄糖,pH 7.4。实验时用缺氧液换去原培养液,放入缺氧孵箱中(5% CO2、95%N2、37 ℃)培养6 h。再换入复氧液,将细胞置入正常孵箱(5% CO2、37℃)下孵育6 h。
3.3感染复数(multiply of infection, MOI)值测定 取原代培养的乳鼠心肌细胞,以5×108cells/L的密度接种至6孔板,培养2 d至细胞融合度达到70%。分为4个不同梯度的MOI值。在无糖无血清培养基中加入含有Ad-T-cad-siRNA的上清液,对照组仅含红色荧光报告基因的阴性对照腺病毒载体上清,感染6 h后,换新鲜含20%胎牛血清培养基。感染后每天倒置荧光显微镜下观察各组细胞红色荧光表达情况,并计数阳性细胞的百分比。
3.4原代心室肌细胞的鉴定 采用免疫荧光法,针对胞浆α-肌动蛋白,采用鼠单克隆α-肌动蛋白Ⅰ抗及FITC-羊抗鼠荧光Ⅱ抗鉴定心肌细胞。
3.5实验分组 实验用培养72 h原代心肌细胞。(1)空白对照组:心肌细胞正常培养;(2)H/R组;(3)APN+H/R组:30 mg/L脂联素与心肌细胞孵育24 h后,进行缺氧/复氧干预;(4)Ad-T-cad-siRNA+APN+H/R组:加入腺病毒介导的siRNA与心肌细胞孵育48 h后,再加入30 mg/L的脂联素与心肌细胞孵育24 h,进行缺氧/复氧干预;(5)Ad-HK+APN+H/R组:加入腺病毒介导的空质粒与心肌细胞孵育48 h后,再加入30 mg/L的脂联素与心肌细胞孵育24 h,进行缺氧/复氧干预。
3.6RT-PCR测定 按RNA抽提试剂盒说明提取总RNA,微量分光光度计测定RNA量,A260/A280均在1.8~2.0。将RNA反转录成cDNA后,再进行PCR扩增。目的基因T-cad上游引物5’-GGCAGAGCTTTGAGATCCAC-3’,下游引物5’-GACTGGTCCCTCGTTGACAT-3’,扩增片段产物长度206 bp。β-actin上游引物5’-GTCAGGTCATCACTATCGGCAAT -3’,下游引物5’-AGAGGTCTTTACGGATGTCAACGT -3’, 扩增片段产物长度184 bp。PCR反应条件:94 ℃预变性2 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,共28个循环,72 ℃ 10 min。扩增片段通过凝胶成像分析仪系统分析。
工程量清单计价方法目前并不十分完善,而且相关的法律规范也不明确,这就导致电力单位内部的体系松散。这种情况的结果非常严重,不但会造成工作效率低下的情况 而且给贪污腐败等违法乱纪行为提供土壤。而且其中很多部分的管理并不透明,难以调动内部工作人员的热情,而且很难进行及时调整,无法发挥实际效用。没有完善的管理体系,相关人员也会放松警惕,难以严格要求自己,严重的话甚至可能会造成非常大的经济损失造成不利影响。
3.7Western blotting检测 收集细胞,提取细胞总蛋白,用BCA法检测蛋白浓度。取样品蛋白质50 μg,SDS-聚丙烯酰胺凝胶电泳法分离、转膜、5%BSA封闭2 h后,依次加入兔抗鼠T-cadⅠ抗(1∶500)和兔抗鼠β-actin抗体(1∶500)4 ℃孵育过夜,羊抗兔Ⅱ抗(1∶2 000)孵育2 h后,ECL发光液孵育2 min。使用Bio-Rad图像分析系统进行半定量分析,β-actin作为内参照。
3.8流式心肌细胞凋亡率的测定 按照流式凋亡检测试剂盒说明制备单细胞悬液,用Annexin V/PI双染色标记法检测各组心肌细胞凋亡百分率。
3.9TUNEL法检测心肌细胞凋亡 收集各组细胞爬片,采用TUNEL法,按细胞凋亡原位检测试剂盒操作说明进行操作,最后使用含有DAPI染料的封片剂封片,激光共聚焦观察细胞凋亡情况,TUNEL阳性信号为绿色荧光,位于胞核,圆形,DAPI染核为蓝色。每一细胞爬片观察4个独立视野,计算每100个细胞中核荧光阳性的凋亡细胞数。
4统计学处理
采用SPSS 13.0统计软件进行分析,数据用均数±标准差(mean±SD)表示,组间数据分析采用单因素方差分析,各处理组之间采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1原代心室肌细胞的鉴定
倒置相差显微镜下,原代心室肌细胞生长形态多样,搏动明显,核居中呈卵圆形。倒置荧光显微镜下,细胞呈多角形,胞浆呈绿色荧光阳性表达的细胞达95%,非心肌细胞胞浆无阳性表达,见图1。
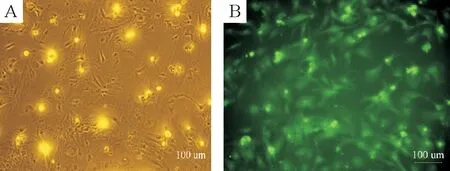
Figure 1. Primary culture and identification of neonatal rat cardiomyocytes (×200). A: morphological image of primary neonatal rat cardiomyocytes;B: indentification of cardiomyocytes by α-actin immunofluorescent staining (green). Scale bar: 100 μm.
图1乳鼠心肌细胞的原代培养及鉴定
2重组腺病毒对心肌细胞的感染力及感染效率检测
应用武汉淅码公司构建的Ad-T-cad-siRNA感染心肌细胞,10~12 h后,荧光显微镜下开始出现红色荧光,感染后48 h荧光强度最强。随着MOI的增加,红色荧光阳性率亦增加: MOI值为50时,荧光阳性率为70.5%;MOI值为100时,荧光阳性率接近97%,但心肌细胞的生长并无明显抑制,而PBS对照组未见有荧光表达。这说明我们使用的重组腺病毒能有效地感染乳鼠心肌细胞,且体外感染效率高,见图2。
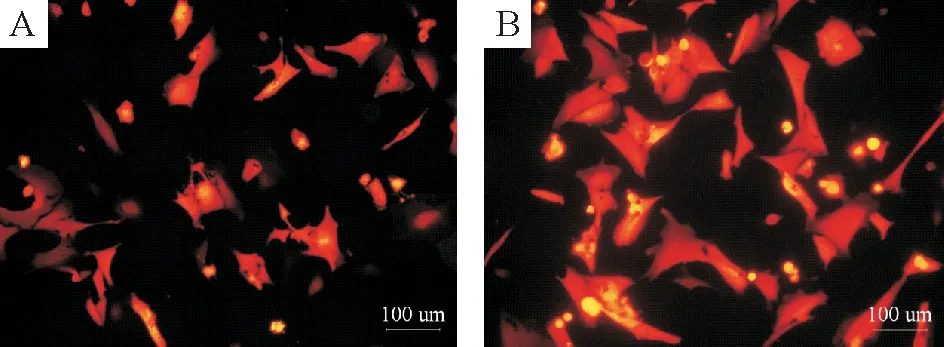
Figure 2. Cardiomyocytes infected with Ad-T-cad-siRNA for 48 h (×200). A: MOI=50; B: MOI=100.
图2转染Ad-T-cad-siRNA48h后的心肌细胞
3RT-PCR和Westernblotting检测T-cadmRNA和蛋白表达结果
相对其所有处理组,给予Ad-T-cad-siRNA处理组T-cad mRNA 水平明显降(P<0.05),与腺病毒阴性对照组比较,差异显著(P<0.05);Western blotting 结果检测T-cad 蛋白表达与mRNA 结果相一致,见图3。
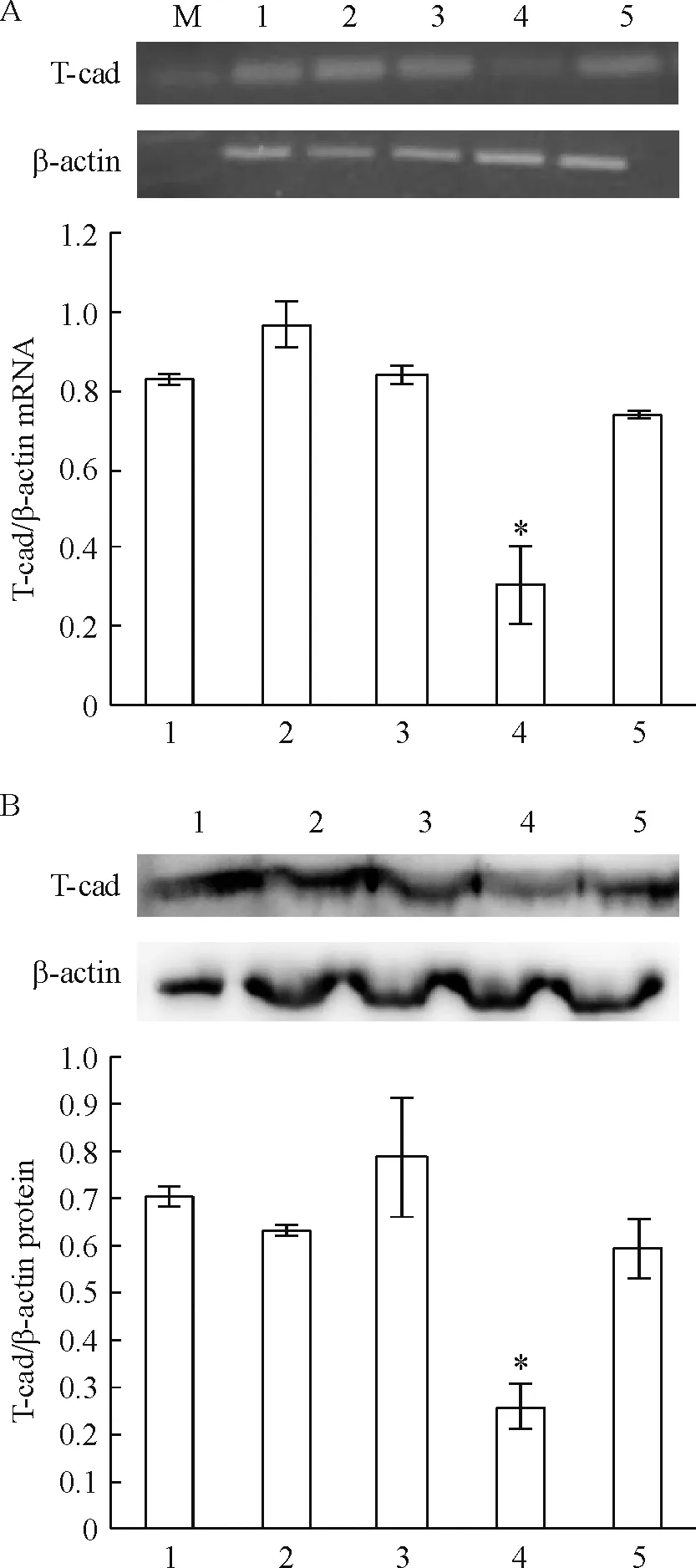
Figure 3. Expression of T-cadherin (T-cad) mRNA (A) and protein (B) in cardiomyocytes. M: DNA marker (100~600 bp); 1: control group; 2: H/R group; 3: APN (30 mg/L)+H/R group; 4: Ad-T-cad-siRNA+APN (30 mg/L)+H/R group; 5: Ad-HK+APN (30 mg/L)+HR group.Mean±SD.n=3.*P<0.05vsother groups.
图3各组心肌细胞T-cadmRNA和蛋白的表达
4流式细胞术检测心肌细胞凋亡率
用Annexin V-FITC/PI对心肌细胞进行双标记染色发现,正常对照组细胞集中在B3区,在B4区和B2区内无分布或分布甚少,凋亡率极低; H/R组出现大量凋亡细胞;脂联素预处理后,可见B2和B4区细胞分布明显减少,细胞凋亡较H/R组明显减少;沉默T-cad表达后,再给予脂联素处理,心肌细胞凋亡率较H/R组无明显差异(P>0.05),较APN+H/R组差异有统计学意义(P<0.05),与腺病毒阴性对照组相比,差异显著(P<0.05),见图4、表1。
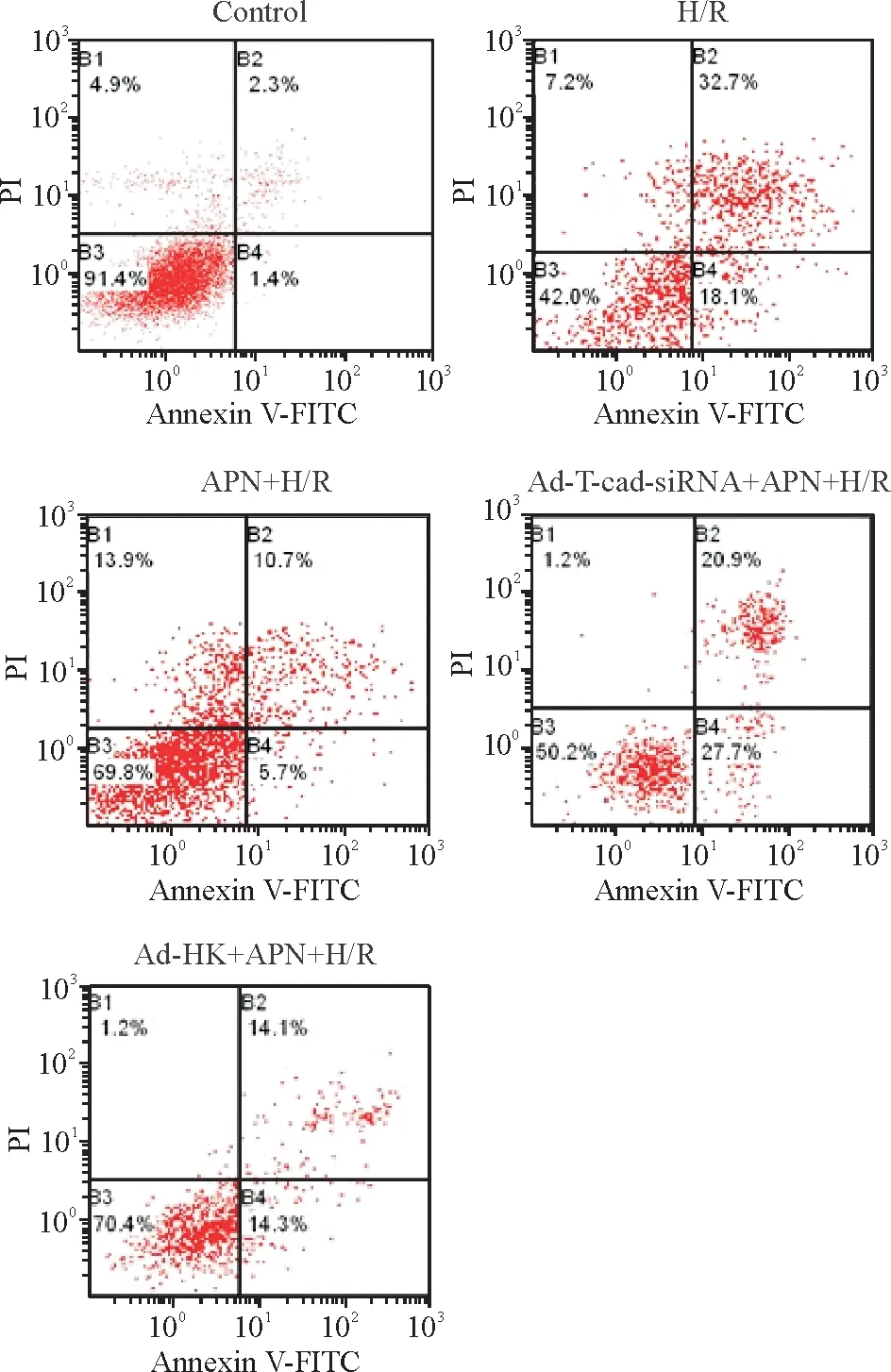
Figure 4. The apoptotic rates examined by flow cytometry.
图4流式细胞术检测各组心肌细胞凋亡率
表1各组心肌细胞凋亡率比较
Table 1. Comparison of apoptotic rates of cardiomyocytes examined by flow cytometry (%.Mean±SD.n=4)
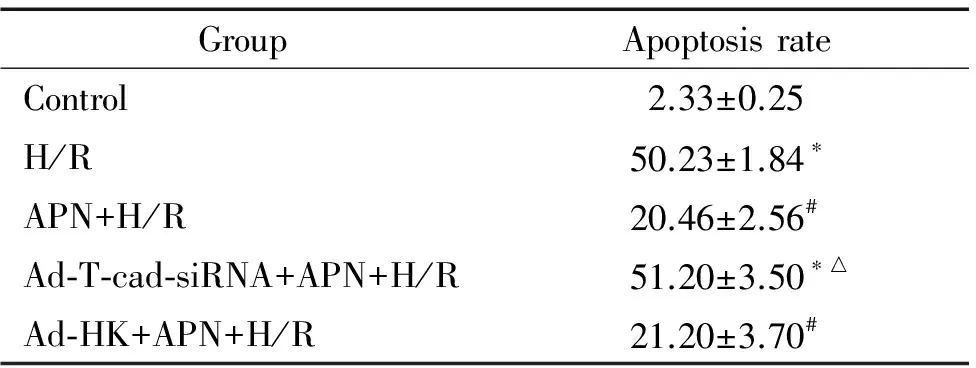
GroupApoptosisrateControl2.33±0.25H/R50.23±1.84∗APN+H/R20.46±2.56#Ad⁃T⁃cad⁃siRNA+APN+H/R51.20±3.50∗△Ad⁃HK+APN+H/R21.20±3.70#
*P< 0.05vscontrol group;#P<0.05vsH/R group;△P< 0.05vsAPN+H/R group.
5TUNEL法检测心肌细胞凋亡
激光共聚焦显微镜观察心肌细胞凋亡情况,TUNEL阳性信号位于细胞核,呈绿色荧光,而所有细胞核经DAPI 荧光染料复染呈蓝色。结果显示:正常对照组偶见细胞凋亡;H/R 组心肌细胞绿色荧光显著增多;APN 预处理后心肌细胞中绿色荧光较H/R 组显著减少;腺病毒沉默T-cad表达组,绿色荧光增多,与APN+H/R组比较差异有统计学意义(P<0.05),与H/R组比较无明显差异(P>0.05),与腺病毒阴性对照组相比差异显著(P<0.05),见图5。
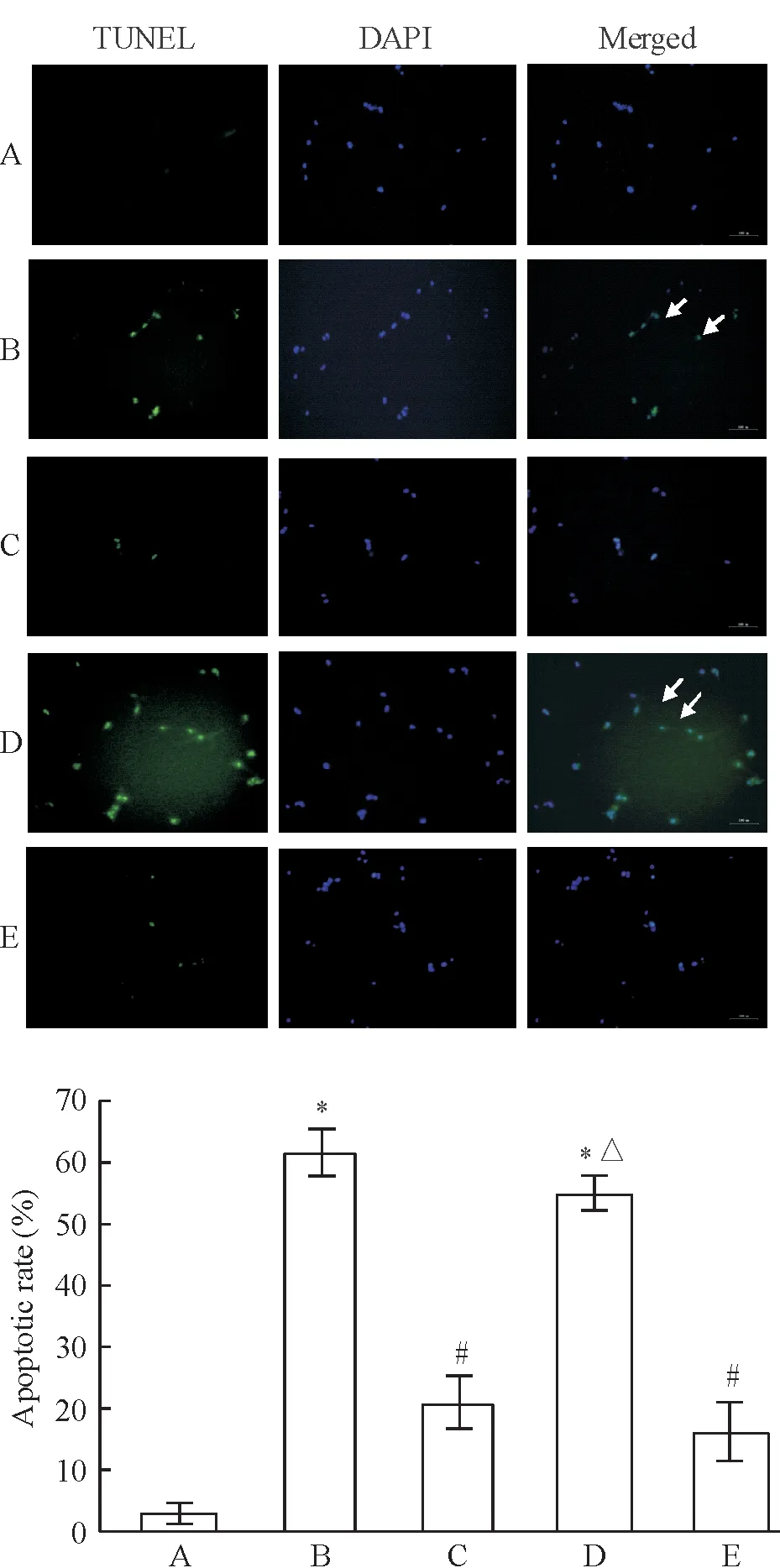
Figure 5. The apoptosis of cardiomyocytes in different groups examined by TUNEL staining. A: control group; B: H/R group; C:APN (30 mg/L)+H/R group; D:Ad-T-cad-siRNA+APN (30 mg/L)+H/R group; E:Ad-HK+APN (30 mg/L)+H/R group.Mean±SD.n=4.*P< 0.05vscontrol group;#P<0.05vsH/R group;△P< 0.05vsAPN (30 mg/L)+H/R group.
图5TUNEL法检测各组心肌细胞凋亡率
讨 论
脂联素作为脂肪分泌的一种激素,大量研究发现APN可以减轻缺血再灌注引起的心肌细胞损伤[8],Yamauchi等[9]应用分子克隆技术确定脂联素的这种保护作用与其特异性受体有关,分别为AdipoR1和AdipoR2,其中AdipoR1在骨骼肌分布广泛, AdipoR2则在肝脏中高度表达[9]。近年来T-cad作为脂联素的一种新受体,因其在心血管系统高度表达受到人们的广泛关注。研究发现,T-cad可抑制血管内膜增生,在小鼠的颈动脉被气囊导管扩张后T-cad会在新生内膜高表达[10]。同时,Philippova等[11]也发现,在发生冠状动脉粥样硬化血管附近存在T-cad和APN 的表达,暗示冠状动脉粥样硬化的进程中,T-cad起着关键的作用。另外,T-cad可通过抑制PERK信号途径,对抗内质网应激导致的血管内皮细胞凋亡[12]。
因此,为了确定T-cad在心肌细胞缺血再灌注的作用,本实验模仿心肌细胞缺血再灌注,体外建立H/R模型,并通过腺病毒介导的RNA干扰技术沉默T-cad,同时给予APN处理,发现与APN+H/R组和腺病毒阴性对照组相比,心肌细胞凋亡率明显增高(P<0.05);与H/R组相比,凋亡率无明显差异(P>0.05)。所以我们得出结论:T-cad这一受体在脂联素发挥对缺氧复氧引起的心肌细胞的损伤中起着关键性的作用,此受体的缺失使APN与心肌细胞失去联系,从而不能更好地发挥其对心肌细胞缺氧复氧的保护作用。与我们实验结果相一致的,Denzel等[13]研究也发现,在小鼠缺血再灌注损伤和心肌肥大的模型中,T-cad基因敲除小鼠心肌梗死面积增大,且同时给予腺病毒介导的脂联素后,并不能逆转上述变化[13]。但是在此过程中,AdipoR1和AdipoR2作为经典的脂联素受体所起的作用,是独立于脂联素而存在,或者是作为次要的受体和T-cad起着协同的作用,还未有明确的结论。另一方面,脂联素结合AdipoR1和AdipoR2后,主要是通过激活AMPK、PPARα、Rab5b和PI3K等信号转导通路发挥其抗脂肪酸氧化、蛋白质降解、细胞保护等作用[14]。对于T-cad,因其具有不同于AdipoR1和AdipoR2的7次跨膜结构,同时缺乏跨膜区和细胞内结合区域,仅仅通过GPI附着于细胞膜上,近年来研究发现,过表达的T-cad可以通过PI3K/Akt/mTOR信号通道,降低胰岛素的抵抗[15]。但是,在心血管系统,其作用的发挥和上述PI3K/Akt/mTOR等通道是否有着联系,尚需进一步详细研究。
[1] Liu JB, Jia L, Li BR, et al. Adiponectin suppresses inflammatory responses at the early phase of atherosclerosis in hyperglycemic rats[J].Mol Med Rep,2010,3(2):323-328.
[2] Goldstein BJ, Scalia RG, Ma XL. Protective vascular and myocardial effects of adiponectin[J]. Nat Clin Pract Cardiovasc Med, 2009, 6(1):27-35.
[3] Tao L, Gao E, Jiao X, et al. Adiponectin cardioprotection after myocardial ischemia/reperfusion involves the reduction of oxidative/nitrative stress[J]. Circulation,2007,115(11):1408-1416.
[4] Hug C,Wang J,Ahmad NS,et al.T-cadherin is a receptor for hexameric and high-molecular-weight forms of Aerp30/adiponectin[J].Proc Natl Acad Sci U S A,2004,101(28):10308-10313.
[5] Yamauchi T, Kamon J, Ito Y,et al. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects [J]. Nature, 2003, 423(6941):762-769.
[6] Ciatto C, Bahna F, Zampieri N, et al. T-cadherin structures reveal a novel adhesive binding mechanism [J]. Nat Struct Mol Biol,2010,17(3):339-347.
[7] 王 敏,柴颖儒,肖传实,等. 脂联素上调心肌细胞缺氧/复氧损伤后T-钙黏蛋白的表达[J].生理学报,2012,64(3):296-302.
[8] 边云飞,王 慧,肖传实.脂联素对氧应激所致心肌损伤的影响[J].中国病理生理杂志,2009,25(8):1581-1584.
[9] Yamauchi T,Nio Y,Maki T, et al. Targeted disruption of AdipoR1 and AdipoR2 causes abrogation of adiponectin binding and metabolic actions[J]. Nat Med,2007,13(3):332-339.
[10] Philippova M,Banff A,Ivanov D,et al.Atypical GPI-an-chored T-cadherin stimulates angiogenesisinvitroandinvivo[J].Arterioscler Thromb Vasc Biol,2006,26(10):2222-2230.
[11] Philippova M, Suter Y, Toggweiler S,et al.T-cadherin is present on endothelial microparticles and is elevated in plasma in early atherosclerosis[J]. Eur Heart J, 2011,32(6):760-771.
[12] Kyriakakis E, Philippova M, Joshi MB, et al. T-cadherin attenuates the PERK branch of the unfolded protein response and protects vascular endothelial cells from endoplasmic reticulum stress-induced apoptosis[J]. Cell Signal,2010,22(9):1308-1316.
[13] Denzel MS, Scimia MC, Zumstein RM, et al. T-cadherin is critical for adiponectin-mediated cardioprotection in mice[J].J Clin Invest,2010,120(12):4342-4352.
[14] Shehzad A, Iqbal W, Shehzad O, et al. Adiponectin: regulation of its production and its role in human diseases[J]. Hormones (Athens),2012, 11(1):8-20.
[15] Philippova M, Joshi MB, Pfaff D, et al. T-cadherin atte-nuates insulin-dependent signalling, eNOS activation, and angiogenesis in vascular endothelial cells[J]. Cardiovasc Res, 2012, 93(3):498-507.
EffectsofT-cadherinonhypoxia/reoxygenation-inducedapoptosisofcardiomyocytesfromneonatalrats
SUN Ya-li, BIAN Yun-fei, SUN Xu, LIU Gai-zhen, BAI Rui, XIAO Chuan-shi
(DeoatmentofCardiology,TheFirstAffiliatedHospitalofShanxiMedicalUniversity,Taiyuan030001,China.E-mail:yunfeibian@sina.com)
AIM: To investigate the mechanism of cardiomyocyte apoptosis induced by hypoxia/reoxygenation (H/R) by silencing a new adiponectin receptor T-cadherin through adenovirus-mediated RNA interference.METHODSThe primary cardiomyocytes were isolated from neonatal rats and cultured for 72 h. The cardiomyocytes were randomly divided into control group, H/R group, APN+H/R group, Ad-T-cadherin-siRNA+APN+H/R group and Ad-HK (adenovirus negative control)+APN+H/R group. The transfection ability and efficiency were examined. The expression of T-cadherin at mRNA and protein levels was detected by RT-PCR and Western blotting. The apoptotic rate was analyzed by flow cytometry and TUNEL.RESULTSHigh purity of neonatal rat cardiomyocytes was obtained by primary culture. After 48 h, over 90% of myocardiocytes were infected at MOI=100. The transfected myocardiocytes showed a low expression level of T-cadherin under normal physiological condition. Compared with APN+H/R group, the cell apoptotic rate significantly increased in Ad-T-cadherin-siRNA+APN+H/R group (P<0.05). Compared with H/R group, the difference was not statistically significant (P>0.05).CONCLUSIONAd-T-cadherin-siRNA effectively infects myocardial cellsinvitroand successfully reduces the expression of T-cadherin in myocardial cells. The inhibitory effect of adiponectin on H/R-induced cardiomyocyte apoptosis is attenuated by decreasing the expression of T-cadherin.
Adiponectin; T-cadherin; Cardiomyocytes; RNA interference; Hypoxia/reoxygenation
R541
A
10.3969/j.issn.1000- 4718.2013.05.004
1000- 4718(2013)05- 0790- 06
2012- 12- 10
2013- 04- 02
国家自然科学基金资助项目(No. 81170198)
△通讯作者 Tel: 0351-3365787; E-mail: yunfeibian@sina.com

