尼古丁对人脐带间充质干细胞增殖和迁移的影响*
曾慧兰, 卜欠欠, 陈慧中, 覃永亮, 李 阳, 柏小芬, 钟 启, 余泮熹, 刘宏伟, 刘革修, 苏泽轩
(暨南大学 1附属第一医院血液科, 2医学院口腔医学系,广东 广州 510632;3江门市人民医院血液科,广东 江门 529020; 4广东省第二人民医院血液科,广东 广州 510317;暨南大学 5国际学院, 6第一医院整形外科,7血液病研究所,广东 广州 510632)
尼古丁对人脐带间充质干细胞增殖和迁移的影响*
曾慧兰1▲, 卜欠欠1▲, 陈慧中2, 覃永亮3, 李 阳1, 柏小芬1, 钟 启4, 余泮熹5, 刘宏伟6, 刘革修7△, 苏泽轩6
(暨南大学1附属第一医院血液科,2医学院口腔医学系,广东 广州 510632;3江门市人民医院血液科,广东 江门 529020;4广东省第二人民医院血液科,广东 广州 510317;暨南大学5国际学院,6第一医院整形外科,7血液病研究所,广东 广州 510632)
目的探讨尼古丁对人脐带间充质干细胞(MSCs)一氧化氮(NO)、一氧化氮合酶(NOS)、诱导型一氧化氮合酶(iNOS)、活性氧(ROS)、线粒体膜电位及细胞因子生成的影响。方法尼古丁作用MSCs后,硝酸还原酶法测NO的释放情况;分光光度计法测NOS和iNOS活性;流式细胞技术测ROS及线粒体膜电位的变化;ELISA法测培养上清液中细胞间黏附分子 1(ICAM-1)、基质细胞衍生因子 1(SDF-1)、基质金属蛋白酶 9(MMP-9)、金属蛋白酶组织抑制物 1(TIMP-1)、转化生长因子 β1(TGF-β1)、胰岛素样生长因子 I(IGF-I)和碱性成纤维细胞生长因子(bFGF)水平的变化。结果在24 h和36 h,NO水平随尼古丁浓度上升而增加(P<0.05),但在48 h,0.8 g/L与1.0 g/L组,NO水平低于对照组;NOS和iNOS活性随尼古丁浓度上升而逐渐增加;尼古丁可增加MSCs的ROS水平,并降低线粒体膜电位;在尼古丁作用下,MSCs分泌SDF-1、TGF-β1、IGF-I及bFGF水平下降,ICAM-1、MMP-9及TIMP-1表达均上升。结论尼古丁通过增加NO、NOS、iNOS和ROS水平,降低线粒体膜电位,使SDF-1、TGF-β1、IGF-I及bFGF分泌下降,ICAM-1、MMP-9及TIMP-1表达上升,可能影响MSCs的增殖、黏附、迁移等特性。
尼古丁; 间充质干细胞; 一氧化氮; 一氧化氮合酶; 活性氧; 线粒体膜电位; 细胞因子类
人脐带间充质干细胞(mesenchymal stem cells,MSCs)是一类具有高度自我更新能力及多向分化潜能的多能干细胞,在细胞替代治疗及组织工程方面有极大的应用价值[1-2]。烟草危害是当今世界公认的公共卫生问题,其中尼古丁约占烟草生物碱总量的95%。本课题组前期研究发现尼古丁可促进MSCs凋亡[3]。本研究在此基础上,观察尼古丁对MSCs的一氧化氮(nitric oxide,NO)、一氧化氮合酶(nitric oxide synthase,NOS)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、活性氧(reactive oxygen species,ROS)、线粒体膜电位及细胞间黏附分子 1(intercellular adhesion molecule 1,ICAM-1)、基质细胞衍生因子 1(stromal cell-derived factor 1 ,SDF-1)、基质金属蛋白酶 9(matrix metalloproteinase 9,MMP-9)、金属蛋白酶组织抑制物 1(tissue inhibitor of metalloproteinase 1,TIMP-1)、转化生长因子 β1(transforming growth factor β1,TGF-β1)、胰岛素样生长因子 I(insulin-like growth factor I,IGF-I)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)影响,以进一步阐明尼古丁致病机制。
材 料 和 方 法
1材料
1.1细胞 人脐带MSCs的分离、培养及鉴定见文献[4],取第3~7代细胞做实验。
1.2试剂与仪器 尼古丁(北京伊普瑞斯公司);DMEM/F12、澳洲胎牛血清(Gibco);青霉素、链霉素(华北制药公司);胰酶(Sigma);NO试剂盒、NOS试剂盒和iNOS试剂盒(南京建成科技有限公司);活性氧试剂盒(碧云天生物技术有限公司);TGF-β1、ICAM-1、MMP-9、VEGF、HGF、VCAM-1和TIMP-1酶联免疫分析试剂盒(武汉博士德生物工程有限公司);bFGF、SDF-1和IGF-I酶联免疫分析试剂盒(华美生物工程有限公司);CO2培养箱(Thermo Forma);分光光度计(BD FACSAria);流式细胞仪(Becton Dickinson);TECAN: Sunrise Remote/TonchScreen酶标仪(南京华东电子集团医疗装备有限责任公司)。
2方法
2.1硝酸还原酶法测MSCs NO释放 MSCs以2×108/L接种于12孔板,培养24 h,实验组加含10%FBS的DMEM/F12 配制的尼古丁液(0.6 g/L、0.8 g/L和1.0 g/L),对照组加含10%FBS的DMEM/F12。分别于24 h、36 h和48 h取上清液,硝酸还原酶法测NO的释放情况。
2.2分光光度计法测NOS和iNOS活性 MSCs以1×108/L接种于24孔板,培养24 h,实验组加尼古丁液(0.6 g/L、0.8 g/L和1.0 g/L),对照组加含10%FBS的DMEM/F12培养液,分别作用24 h、36 h和48 h,取上清液,按说明书操作测NOS和iNOS活性。
2.3尼古丁对MSCs ROS影响 细胞以 2×108/L接种于6孔板,培养24 h后弃培养液。每孔加入10 mol/L DCFH-DA液1 mL,置37 ℃培养箱中孵育20 min,弃DCFH-DA液。对照组加含10%FBS的DMEM/F12,实验组加尼古丁液(0.6 g/L、0.8 g/L和1.0 g/L)。孵育20 min,收集细胞。PBS洗涤3次,1 mL PBS重悬细胞,流式细胞术测ROS。
2.4流式细胞仪测线粒体膜电位改变 MSCs以 2×108/L接种于6孔板,培养24 h后弃培养液。对照组加入含10%FBS的DMEM/F12,实验组加尼古丁液(0.6 g/L、0.8 g/L和1.0 g/L)。孵育24 h,收集细胞。加200 μL 10 mg/L JC-1荧光染料,避光染色30 min,离心,250 μL缓冲结合液重悬,流式细胞术测线粒体膜电位改变。
2.5ELISA法测MSCs细胞因子分泌水平 MSCs以2×108/L接种于6孔板,实验组加尼古丁液(0.4 g/L、0.6 g/L和1.0 g/L),对照组加含10%FBS的DMEM /F12培养液,24 h后,收集上清液于-80 ℃冷藏备用,按照ELISA试剂盒操作,酶标仪测450 nm处吸光度(A450),CurveExpert 1.3软件计算出ICAM-1、SDF-1、MMP-9、TIMP-1、TGF-β1、IGF-I和bFGF浓度。
3统计学处理
用SPSS 13.0软件,数据以均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1尼古丁对NO释放的影响
在24 h及36 h,尼古丁各浓度组的NO含量均明显高于对照组(P<0.05);但在48 h,尼古丁0.6 g/L组NO含量显著高于对照组(P<0.05),而0.8 g/L与1.0 g/L组NO含量低于对照组,但无显著差异(P>0.05),见图1。
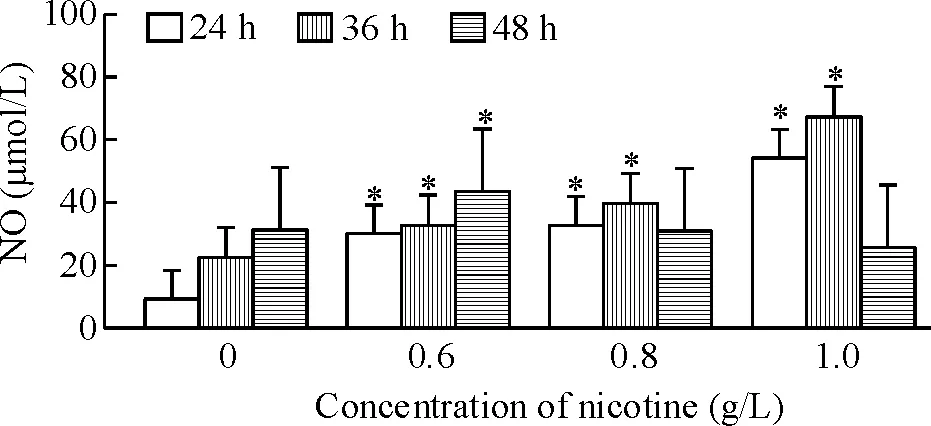
Figure 1. Effects of different concentrations of nicotine on NO release in MSCs for 24,36 and 48 h.Mean±SD.n=3.*P<0.05vs0 g/L nicotine group.
图1不同浓度尼古丁对MSCs释放NO的影响
2尼古丁对NOS和iNOS活性的影响
NOS活性随尼古丁浓度上升而逐渐增加,在36 h时最高,后逐渐降低,各组NOS活性在24 h和36 h时高于对照组(P<0.05),见图2;随尼古丁浓度上升iNOS活性逐渐增加,在36 h时最高,iNOS活性在24 h和48 h时高于对照组(P<0.05),见图3。
3尼古丁对ROS影响
0.6 g/L、0.8 g/L和1.0 g/L尼古丁作用MSCs 20 min后,各实验组荧光强度分别为284.56±5.92、301.69±11.37、368.46±10.13,均高于对照组(262.43±92.80;n=3,P<0.05),见图4。
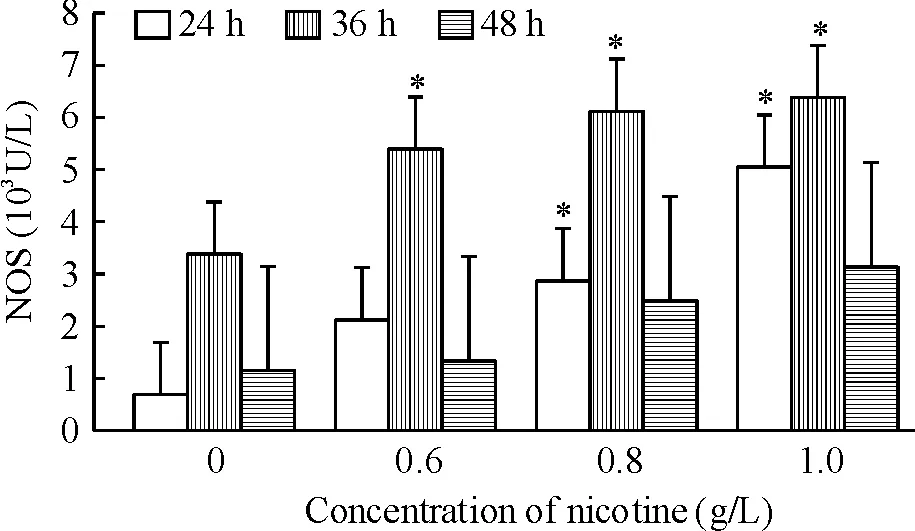
Figure 2. Effects of different concentrations of nicotine on NOS activity in MSCs for 24,36 and 48 h.Mean±SD.n=3.*P<0.05vs0 g/L nicotine group.
图2不同浓度尼古丁对MSCsNOS活性影响
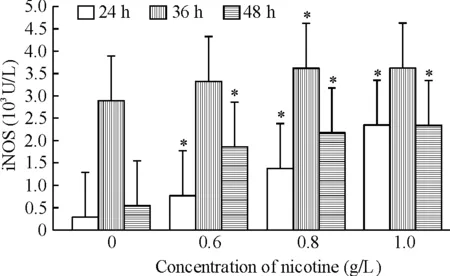
Figure 3. Effects of different concentrations of nicotine on iNOS activity in MSCs for 24,36 and 48 h.Mean±SD.n=3.*P<0.05vs0 g/L nicotine group.
图3不同浓度尼古丁对MSCsiNOS活性的影响

Figure 4. Effects of nicotine on ROS production in MSCs for 20 min.
图4尼古丁对MSCsROS的影响
4尼古丁对MSCs线粒体膜电位的影响
0.6 g/L、0.8 g/L和1.0 g/L尼古丁作用MSCs 24 h后,绿色荧光比率分别为(5.03±0.83)%、 (10.13±1.30)%和(19.10±1.25)%,均高于对照组[(2.56±0.40)%;n=3,P<0.05],见图5,呈浓度依赖性。
5尼古丁对细胞因子分泌水平的影响
不同浓度尼古丁作用后,ICAM-1表达上升,呈浓度依赖性,0.6和1.0 g/L尼古丁组与对照组相比差异有统计学意义(P<0.05),见表1;SDF-1浓度随尼古丁浓度的增加而逐渐降低(P<0.05),见表1;MMP-9表达上升,不同浓度尼古丁组TIMP-1浓度均高于对照组,0.4 g/L尼古丁组达高峰,后随尼古丁浓度增加,TIMP-1浓度降低(P>0.05),见表1;TGF-β1的浓度下降,呈浓度依赖性,见表2;IGF-I表达下降(P<0.05),见表2;bFGF表达下降,呈浓度依赖性,见表2。

Figure 5. Effects of nicotine on mitochondrial membrane potential in MSCs for 24 h.
图5尼古丁对MSCs线粒体膜电位的影响

表1 尼古丁对MSCs产生ICAM-1、SDF-1、MMP-9和TIMP-1的影响
*P<0.05vs0 g/L nicotine group.
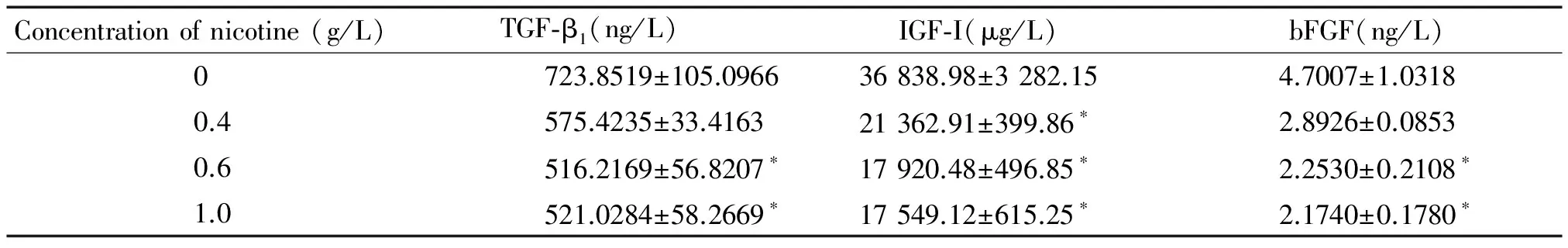
表2 尼古丁对MSCs产生TGF-β1、IGF-I和bFGF的影响
*P<0.05vs0 g/L nicotine group.
讨 论
近年来尼古丁对MSCs毒性研究引起关注,而其作用机制尚未十分明确,许多学者从形态学、增殖凋亡、Ca2+、尼古丁型乙酰胆碱受体表达变化等方面进行研究,证实尼古丁从多方面影响MSCs的活性及功能。本课题组也初步发现尼古丁对人脐带MSCs有毒性作用[3],但有关尼古丁对人脐带MSCs的NO、NOS、ROS、线粒体膜电位及细胞因子ICAM-1、SDF-1、MMP-9、TIMP-1、TGF-β1、IGF-I、bFGF水平影响如何,目前尚未见相关报道。
NO参与细胞凋亡的调控,有双重效应,高浓度NO促进细胞凋亡,低浓度则延缓细胞凋亡[5]。本研究发现尼古丁作用MSCs 24 h与36 h后,NO水平升高,呈浓度依赖性,表明尼古丁可通过刺激MSCs释放NO,导致细胞凋亡。但尼古丁作用48 h后,NO释放下降,可能是尼古丁刺激MSCs释放大量的NO,高浓度NO导致细胞凋亡,细胞数量减少,释放的NO也随之下降。NOS作为催化L-精氨酸合成NO唯一的限速酶,其中iNOS是被报道最多的亚型之一。iNOS由炎症因子、内毒素等诱导激活,催化合成大量NO,并产生大量的活性氧物质,造成细胞氧化损伤[6]。可见NOS、iNOS和NO与氧化损伤有一定相关性。本研究NOS和iNOS活性随尼古丁浓度上升而逐渐增加,同时通过催化生成大量NO,进而产生毒性很大的ONOO-而引起蛋白质、类脂质及DNA氧化,干扰多种酶而诱导细胞凋亡。
ROS主要由线粒体产生,造血干细胞的增殖、分化及迁移需要适当水平的ROS维持,但高水平的ROS则会使造血干细胞广泛性氧化损伤,导致细胞的死亡[7]。有学者认为线粒体DNA的损伤可促进ROS的产生,线粒体膜受到ROS攻击后发生脂质过氧化,导致凋亡诱导因子的释放[8]。本研究线粒体膜电位降低,而ROS水平增高,说明尼古丁使MSCs线粒体DNA损伤,从而促进ROS的产生。而高浓度的ROS攻击线粒体膜,线粒体膜发生脂质过氧化,通透性改变,释放凋亡诱导因子,形成ROS-线粒体DNA损伤的恶性循环,使细胞进入不可逆的凋亡过程。以上这些机制相互联系,通过协同作用,导致细胞氧化损伤,最终促使凋亡。
ICAM-1不仅调节细胞和细胞之间、细胞和基质之间的黏附,也影响和调节细胞对周围环境的反应,因而细胞黏附行为的改变势必影响到细胞的增殖活力、迁移等功能[9]。周卫辉等[10]报道尼古丁可增加内皮细胞ICAM-1表达,促进中性粒细胞与内皮细胞黏附,在COPD慢性炎症发病中起重要作用。本实验示尼古丁可促进MSCs的ICAM-1表达,使得MSCs与周围细胞及细胞外基质黏附异常,可能影响 MSCs的迁移等,与文献结果类似[11-12]。
MSCs归巢涉及多种趋化因子及其受体,最为典型的是SDF-1及其受体CXCR4。MSCs除了表达SDF-1,还可通过自分泌表达其受体CXCR4。SDF-1/CXCR4信号途径主要作用是促进MSCs的迁移,也可促进MSCs生长、转录激活、抗凋亡等[13-15]。MSCs在低氧条件下SDF-1表达增加,促进与其受体CXCR4的结合,从而增加了对MSCs的迁移和向缺血组织归巢的特性,可见SDF-1不仅介导趋化,还促进MSCs进入机体局部缺血的损伤区[16-17]。本研究中尼古丁抑制SDF-1表达,可能使MSCs的迁移能力下降。
MMP-9可降解基底膜和细胞外基质的大多数蛋白质,在细胞外基质降解、结构重塑、细胞迁移等过程中都发挥重要作用,TIMP-1以1∶1的比例形成非共价键与MMP-9形成复合物,从而阻断MMP-9与底物的结合,两者共同调解细胞外基质降解,一旦MMP-9/TIMP-1比例失衡,导致细胞外基质降解紊乱,严重破坏细胞的活性及迁移等功能。刘菲等[18]证实吸烟使大鼠脑血管内皮细胞MMP-9 的上调而致血管壁动脉粥样硬化的形成,最终致血栓的形成。本研究MMP-9和TIMP-1表达上升,但MMP-9/TIMP-1比例失衡,引起蛋白酶-抗蛋白酶失衡,细胞外基质等出现降解紊乱,除了使MSCs受损,也可能影响MSCs迁移等功能。上述结果与Katono等[19]研究的尼古丁致使人成骨细胞MMP-9/TIMP-1失衡结果类似。
李丽艳等[20]报道TGF-β1可诱导MSCs增殖和向软骨细胞分化,合成软骨特异性Ⅱ型胶原甚至蛋白多糖,为软骨组织工程修复缺损提供大量的种子细胞。TGF-β1对MSCs增殖、分化的促进作用已被广泛证实[21-22]。 IGF-I既有胰岛素样合成作用又有生长促进作用,是一种有丝分裂原,与其相应受体结合后可经过一系列信号转导把有丝分裂和代谢信号传递到细胞核,通过增加 DNA的合成、上调细胞周期蛋白的表达,发挥促进细胞分裂增殖等生物学效应[23]。MSCs可分泌IGF-I、bFGF等多种细胞因子,参与促进血管生成、降低心肌细胞凋亡等过程,对损伤心肌具有一定的保护作用。bFGF能促进多种细胞生长、增殖和分化,不仅能提高MSCs的增殖速度及其寿命,且能在增殖过程中保留MSCs的多向分化潜能[24-25]。巴云涛等[26]从人脐带Wharton’s jelly 中分离出MSCs和bFGF能使该细胞从组织块游出时间提前和有助于促使细胞贴壁,也在一定程度上维持细胞形态稳定性,提高增殖能力,且不改变细胞的表面标志物表达。本实验TGF-β1、IGF-I和bFGF分泌减少,抑制MSCs增殖,也可能通过影响新生血管形成,间接抑制MSCs增殖。
尼古丁刺激人脐带MSCs释放NO,增加NOS和iNOS活性,使线粒体DNA损伤,促进ROS产生,导致细胞氧化损伤;使细胞的ICAM-1分泌增加,SDF-1表达下降,MMP-9/TIMP-1比例失衡,破坏MSCs的黏附和迁移特性;使分泌TGF-β1、IGF-I和bFGF水平均下降,抑制MSCs增殖。
[1] 曾慧兰,钟 启,贾海涛,等. 氯化钴作用人脐带间充质干细胞的差异蛋白质组学分析[J].中华血液学杂志,2011,32(11):739-743.
[2] 毛文哲,许 超,李扬秋,等.长期培养的人脐带间充质干细胞PCNA、IL-6、IL-11和galetin-3的表达[J].中国病理生理杂志,2012, 28(6):1051-1056.
[3] 覃永亮,曾慧兰,卜欠欠,等.尼古丁诱导人脐带间充质干细胞凋亡的机制[J]. 暨南大学学报:自然科学与医学版,2011,32(6):598-601.
[4] Zeng HL, Zhong Q ,Qin YL,et al. Hypoxia-mimetic agents inhibit proliferation and alter the morphology of human umbilical cord-derived mesenchymal stem cells[J].BMC Cell Biol, 2011, 12:32.
[5] 赵君怡,刘伟国,郭秀丽. 一氧化氮与细胞凋亡相关疾病的关系及其调控[J].中国药学杂志,2010, 45(14):1044-1047.
[6] 杨丹蕾,徐永健,张珍祥,等.吸烟大鼠一氧化氮合酶和一氧化氮的变化[J].中国病理生理杂志,2003, 19(9):1185-1188.
[7] Circu ML,Aw TY. Reactive oxygen species, cellular redox systems, and apoptosis[J]. Free Radical Biol Med,2010,48(6):749-762.
[8] Van Houten B, Woshner V, Santos JH. Role of mitochondrial DNA in toxic responses to oxidative stress[J]. DNA Repair(Amsterdam),2006,5:145-152.
[9] Saed GM, Diamond MP.Molecular characterization of postoperative adhesions: the adhesion phenotype[J]. J Am Assoc Gynecol Laparosc,2004,11(3):307-314.
[10] 周卫辉,陈祥银,余丽君,等.尼古丁对中性粒细胞活化及细胞间粘附分子基因表达的影响[J].中国病理生理杂志,2000,16(9):779-782.
[11] Breen LT,McHugh PE,Murphy BP.HUVEC ICAM-1 and VCAM-1 synthesis in response to potentially athero-prone and athero-protective mechanical and nicotine chemical stimuli[J].Ann Biomed Eng, 2010,38(5):1880-1892.
[12] Albaugh G.Nicotine induces mononuclear leukocyte adhesion and expression of adhesion molecules, VCAM and ICAM, in endothelial cellsinvitro[J]. Ann Vasc Surg,2004, 18(3):302-307.
[13] Kortesidis A, Zannettino A, Isenmann S,et al. Stromal-derived factor-1 promotes the growth, survival, and development of human bone marrow stromal stem cells[J]. Blood,2005,105(10): 3793-3801.
[14] Son BR, Marquez-Curtis LA, Kucia M,et al. Migration of bone marrow and cord blood mesenchymal stem cellsinvitrois regulated by stromal-derived factor-1-CXCR4 and hepatocyte growth factor-c-met axes and involves matrix metalloproteinases[J]. Stem Cells,2006,24(5):1254-1264.
[15] Pasha Z, Wang Y, Sheikh R, et al. Preconditioning enhances cell survival and differentiation of stem cells during transplantation in infarcted myocardium[J]. Cardiovasc Res,2008,77 (1):134-142.
[16] 王庆德,杨述华,杨 操,等.低氧对人骨髓间充质干细胞HIF-1α、SDF-1、VEGF mRNA表达的影响[J].山东医药,2008,48(3):21-22.
[17] 李士勇,邓宇斌.SDF-1/CXCR4轴在缺氧缺血性脑损伤中的研究进展[J].生命科学, 2008, 20(3): 463-466.
[18] 刘 菲,柳忠兰,刘淑杰.吸烟大鼠脑血管内皮细胞基质金属蛋白酶9的表达[J].中国动脉硬化杂志, 2005,13(5):582-583.
[19] Katono T, Kawato T, Tanabe N,et al. Effects of nicotine and lipopolysaccharide on the expression of matrix metalloproteinases, plasminogen activators, and their inhibitors in human osteoblasts[J].Arch Oral Biol, 2009, 54(2): 146-155.
[20] 李丽艳,黄金中,杜 江.转化生长因子β1诱导骨髓间充质干细胞向软骨细胞分化[J].中国组织工程研究与临床康复,2010,14(1):38-41.
[21] Xian CJ, Foster BK. Repair of injured articular and growth plate cartilage using mesenchymal stem cells and chondrogenic gene therapy[J].Curr Stem Cell Res Ther,2006,1( 2) : 213-229.
[22] 钟 伟,杨希营,王韶峰,等. TGF-β1增强大鼠BMMSCs的侵袭能力研究[J].中华全科医学,2011,9(9):1333-1334.
[23] Langdahl BL,Kassem M,Mller MK,et al.The effects of IGF-I and IGF-Ⅱ on proliferation and differentiation of human osteoblasts and interactions with growth hormone[J] . Eur J Clin Invest,1998,28(3):176-183 .
[24] Tsutsumi S,Shimazu A,Miyazaki K,et al.Retention of multilineage differentiation potential of mesenchymal cells during proliferation in response to FGF[J].Biochem Biophys Res Commun,2001,228(2):413-419.
[25] Ohnishi S,Yasuda T,Kitamura S,et al.Effect of hypoxia on gene expression of bone marrow-derived mesenchymal stem cells and mononuclear cells[J].Stem Cells,2007,25 (5):1166-1177.
[26] 巴云涛,关方霞,胡 祥,等.人脐带Wharton’s jelly源间充质干细胞培养中碱性成纤维细胞生长因子的作用[J].中国组织工程研究与临床康复,2010,14(19):3513-3517.
Effectsofnicotineonproliferationandmigrationofhumanumbilicalcordmesenchymalstemcells
ZENG Hui-lan1, BU Qian-qian1, CHEN Hui-zhong2, QIN Yong-liang3, LI Yang1, BAI Xiao-fen1, ZHONG Qi4, YU Pan-xi5, LIU Hong-wei6, LIU Ge-xiu7, SU Ze-xuan6
(1DepartmentofHematology,TheFirstAffiliatedHospital,2DepartmentofStomatology,SchoolofMedicine,JinanUniversity,Guangzhou510632,China;3DepartmentofHematology,thePeople’sHospitalofJiangmen,Jiangmen529020,China;4DepartmentofHematology,GuangdongNo.2ProvincialPeople'sHospital,Guangzhou510317,China;5InternationalAcademy,6DepartmentofPlasticSurgery,TheFirstAffiliatedHospital,7InstituteofHematology,JinanUniversity,Guangzhou510632,China.E-mail: 53483119@qq.com)
AIM: To explore the effects of nicotine on nitric oxide (NO), nitric oxide synthase (NOS), inducible nitric oxide synthase (iNOS), reactive oxygen species (ROS), mitochondrial membrane potential and cytokine secretion in human umbilical cord mesenchymal stem cells (MSCs).METHODSMSCs were treated with different concentrations of nicotine. The content of NO was detected by nitrate reductase method. The activity of NOS and iNOS was mea-sured by ultraviolet spectrophotometry. ROS and mitochondrial membrane potential were detected by flow cytometry. The levels of intercellular adhesion molecule 1(ICAM-1), stromal cell-derived factor 1 (SDF-1), matrix metalloproteinase 9 (MMP-9), tissue inhibitor of metalloproteinase 1(TIMP-1), transforming growth factor β1(TGF-β1), insulin-like growth factor I (IGF-I) and basic fibroblast growth factor (bFGF) were determined by ELISA.RESULTSAt 24 h and 36 h after exposure to nicotine, the levels of NO were significantly increased in a dose-dependent manner. However, at 48 h, the levels of NO in 0.8 g/L group and 1.0 g/L group were lower than that in control group. The activity of NOS and iNOS were significantly increased in a dose-dependent manner. The level of ROS increased, while mitochondrial membrane potential decreased. After nicotine treatment, the secretions of SDF-1, TGF-β1, IGF-I and bFGF declined, while the levels of ICAM-1, MMP-9 and TIMP-1 increased.CONCLUSIONNicotine may affect the proliferation, adhesion and migration of MSCs by increasing the levels of NO, NOS, iNOS and ROS and the production of ICAM-1, MMP-9 and TIMP-1, and decreasing the mitochondrial membrane potential and the secretion of SDF-1, TGF-β1, IGF-I and bFGF.
Nicotine; Mesenchymal stem cells; Nitric oxide; Nitric oxide synthase; Reactive oxygen species; Mitochondrial membrane potential; Cytokines
R329.21
A
10.3969/j.issn.1000- 4718.2013.05.002
1000- 4718(2013)05- 0778- 06
2012- 12- 26
2013- 03- 21
国家自然科学基金资助项目 (No.81270568;No.30973127);2011年广州市第二批科技攻关项目(No.2011Y-00003);2011年广东省医学科研项目(No.A2011339);2012年暨南大学“国家级大学生创新实验计划”(No.1210559045)
△通讯作者Tel: 020-85220262; E-mail: 53483119@qq.com
▲并列第1作者

