丹参素干预对肺纤维化大鼠TGF-β1 /Smads信号通路的影响*
秦 静, 赵铭山, 李 君
(滨州医学院附属医院呼吸内科,山东 滨州256603)
肺纤维化是一种严重危害人类健康的疾病,预后极差,流行病学调查发现,5 年生存率<50%,中位生存期为2.8 年[1],目前临床上仍以糖皮质激素和免疫抑制剂及细胞毒性药物为主,但疗效均不理想,且具有明显的毒副作用[2]。近期研究发现丹参素(Danshensu,DA;即3,4-二羟基苯基乳酸,3,4-dihydroxyphenylacetic acid)能够增加肺组织超氧化物歧化酶活性,减少丙二醛、羟脯氨酸含量,对肺纤维化有一定的干预作用,而且尚未发现丹参素对人体有明显的不良反应[3],因此本研究利用博莱霉素(bleomycin,BLM)诱导的大鼠肺纤维化模型进一步来观察丹参素对肺纤维化的干预作用以及相关细胞因子的改变。
材 料 和 方 法
1 材料
1.1 动物 SPF 级雄性SD 大鼠40 只,体重(200 ±10)g,购于山东绿叶制药有限公司,饲养于滨州医学院实验动物中心。
1.2 药物与试剂 博莱霉素(每支15 mg,日本化药株式会社,批号为201560),地塞米松(dexamethasone,DXM)磷酸钠注射液(每支5 mg,济南利民制药,批号为11011115),注射用丹参素钠(每支150 mg,山东绿叶制药,批号为050208),Masson 染色试剂盒(南京建成),RevertAidTMFirst Strand cDNA Synthesis Kit(Fermentas),Maxima SYBR Green/Rox qPCR Master Mix (Fermentas),兔抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(Sigma),二步法免疫组化试剂盒(北京中杉金桥)。
1.3 主要仪器 病理图像分析系统Image-Pro Plus 6.0 (Media Cybernetics),PCR 扩增仪(Perkin Elmer,9600 型),实时荧光定量PCR 仪(澳大利亚Corbett,Rotor Gene 3000 型)。
2 方法
2.1 动物模型的建立、分组与标本处理 按随机数字表法将40 只SD 大鼠分为4 组,每组10 只。其中3 组为博来霉素诱导肺纤维化模型组,参照Thrall 等报道的方法将博莱霉素5 mg·kg-1气管内一次性滴注复制大鼠肺纤维化模型,分为BLM 组、DXM 组和DA 组;另一组为正常对照(normal control,NC)组,同时间按同样方法气管内滴注0.2 mL 生理盐水。次日起,DA 组和DXM 组大鼠分别腹腔注射丹参素15 mg·kg-1·d-1和地塞米松1 mg·kg-1·d-1,BLM组和NC 组腹腔注射0.2 mL·d-1生理盐水。所有动物于造模后第28 天解剖分离肺组织,右肺置于4%多聚甲醛固定后制备4 μm 石蜡切片供病理学检查(HE 染色及Masson 染色)及免疫组化,左肺组织投入液氮中保存。
2.2 肺组织病理学改变 HE 染色评定肺组织肺泡炎程度,Masson 染色评定肺组织纤维化程度。行常规HE 染色及Masson 染色。Masson 染色操作严格按照Masson 染色试剂盒产品说明书进行,蓝色的胶原纤维为阳性染色,并用Image-Pro Plus 6.0 专业图像分析软件系统采集肺组织Masson 染色图像,随机取染色区域6 个高倍视野(×100),测量并记录每个视野阳性染色的面积(μm2)进行半定量分析。
2.3 免疫组织化学测定肺组织α-SMA 表达 按即用型免疫组织化学试剂盒说明书(SP 法)操作。常规脱蜡至水,抗原修复,阻断内源性过氧化物酶,正常山羊血清封闭;Ⅰ抗:兔抗鼠α-SMA 单克隆抗体(1∶400);Ⅱ抗:生物素化山羊抗兔IgG;DAB 显色;常规苏木素复染;脱水、透明、封片。用PBS 代替Ⅰ抗进行免疫细胞化学染色,结果作为阴性对照。使用Image-Pro Plus 6.0 专业图像分析软件系统采集肺组织免疫组织化学图像,将肺组织各切片随机取染色区域6 个高倍视野(×400),测量并记录每个视野阳性染色的平均积分吸光度(IA)。
2.4 实时荧光定量PCR 测定转化生长因子β1(transforming growth factor beta 1,TGF-β1) 、Smad3 及Smad7 mRNA 的表达 引物由上海生工生物工程技术服务有限公司提供。TGF-β1上游引物5'-ctgctgacccccactgatac-3',下游引物5'-ctgtattccgtctccttggttc-3',产物长度90 bp;Smad3 上游引物5'-gctttgaggctgtctaccagtt-3',下游引物5'-tccctttactcccagtgtctct-3',产物长度233 bp;Smad7 上游引物5'-tgctgtgcaaagtgttcaggtg-3',下游引物5'-ccatcgggtatctggagtaagga-3',产物长度177 bp;β-actin 上游引物5'-gagagggaaatcgtgcgtgac-3',下游引物5'-catctgctggaaggtggaca-3',产物长度453 bp。TRIpure 试剂提取大鼠肺组织总RNA,按逆转录试剂盒说明书提供的方法进行逆转录,再以cDNA 为模板进行实时荧光定量PCR 扩增。PCR 反应条件:95℃10 min ,1 个循环;95 ℃15 s ,60 ℃60 s,40 个循环。PCR 实验数据分析采用相对定量方法,用内参照β-actin 作为标准,计算方法选择2-ΔΔCt法。
3 统计学处理
利用SPSS 17.0 统计软件进行分析,计量资料以均数±标准差(mean ±SD)表示,组间均值比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD 检验,以P <0.05 为差异有统计学意义。
结 果
1 肺组织病理学改变
HE 染色结果显示,NC 组大鼠肺组织结构轮廓完整清晰,肺泡壁薄而光滑,未见炎性细胞浸润;BLM 组大片肺泡结构破坏或萎陷,肺泡间隔明显增厚,形成多发片状实变,实变组织内可见大量炎性细胞浸润;DXM 组部分肺泡结构塌陷,肺泡间隔增厚,炎症较NC 组严重,但较BLM 组明显减轻;DA 组肺泡结构仍存在,肺泡间隔增厚不明显,炎症较BLM组和DXM 组均明显减轻,见图1。
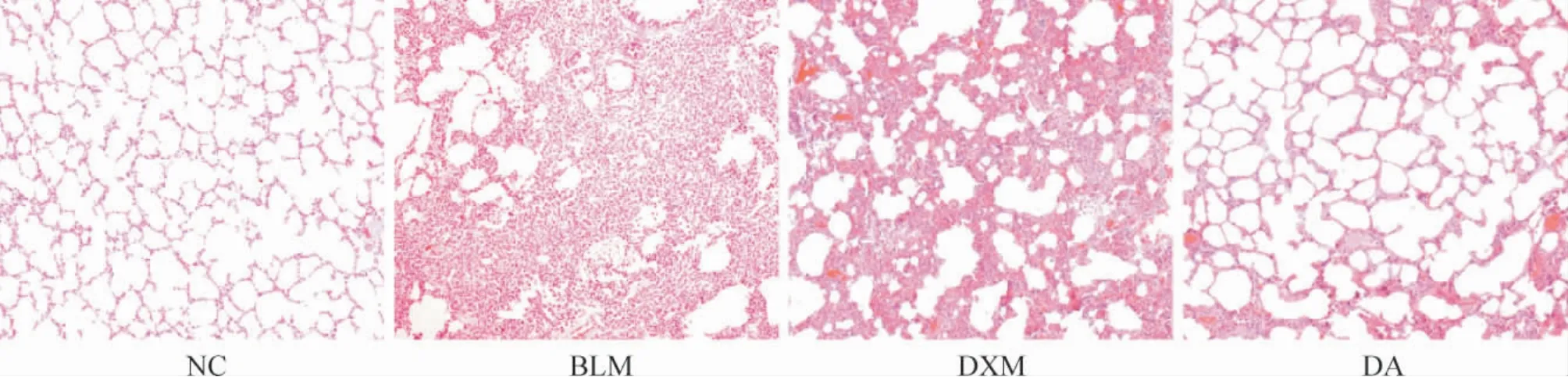
Figure 1. Histopathological changes of lung tissues of rats in each group (HE staining,×100).图1 各组大鼠肺组织病理学改变
Masson 染色结果显示,NC 组肺血管壁和气管周围及肺泡间隔可见少量蓝色的胶原纤维沉积,为肺间质的正常组成成分;BLM 组肺血管壁、支气管壁和肺泡间隔均可见大量片状或束状的胶原纤维沉积,并可见大量蓝色胶原沉积于肺泡腔,形成典型的间质纤维化改变,与NC 组比有显著差异(P <0.01);DXM 组肺血管壁与支气管壁的胶原纤维主要表达在肌层下,肺泡间隔胶原纤维表达较BLM 组显著减少(P <0.05);DA 组肺组织也有蓝染的胶原纤维表达,较BLM 组显著减少(P <0.01),较DXM组也显著减少(P <0.01),见图2。4 组大鼠阳性染色面积的比较见表1。
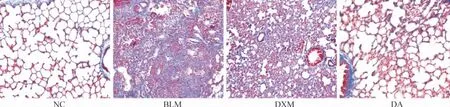
Figure 2. Collagen deposition of lung tissues of rats in each group (Masson staining,×100).图2 各组大鼠肺组织胶原沉积
2 肺组织α-SMA 表达
免疫组化结果以细胞中出现棕黄色颗粒为α-SMA 阳性显色。NC 组肺组织的较大血管平滑肌和气道平滑肌偶见α-SMA 阳染细胞;BLM 组肺组织可见大量α-SMA 阳染细胞,形成典型的成纤维细胞灶,与NC 组有显著差异(P <0.01);DXM 组肺组织仍可见成纤维细胞灶存在,但α-SMA 阳染细胞较BLM 组明显减少(P <0.05);DA 组肺组织未见成纤维细胞灶,α-SMA 阳染细胞较BLM 组明显减少(P <0.01),较DXM 组也明显减少(P <0.05),见图3。各组IA 值比较见表1。
3 肺组织TGF-β1、Smad3 和Smad7 mRNA 的表达
BLM 组TGF-β1和Smad3 mRNA 的表达显著高于NC 组(均P <0. 01);DA 组TGF-β1和Smad3 mRNA 的表达较BLM 组显著降低(均P <0.01),但较NC 组升高(均P <0.05)。BLM 组Smad7 mRNA的表达显著低于NC 组(P <0. 01);DA 组Smad7 mRNA 的表达较BLM 组显著升高(P <0.01),但仍低于NC 组(P <0.01),见表2。

Figure 3. Immunohistochemical staining of α-SMA in lung tissues of rats in each group (×400).图3 各组大鼠肺组织α-SMA 的免疫组化染色
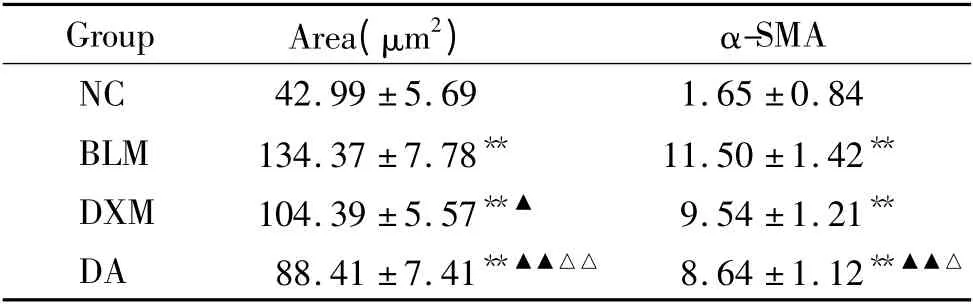
表1 各组大鼠肺组织胶原纤维面积和肺组织α-SMA 蛋白表达的比较Table 1. Area of collagen and expression of α-SMA protein in lung tissues of rats in each group (mean±SD.n=18)
讨 论
丹参素是从丹参水提液中分离得到的一种有效成分,近年来被广泛应用于对肝纤维化的研究。多项研究结果显示丹参素对肝纤维化有明显的治疗作用[4],但对肺纤维化形成阶段的治疗作用及其机制尚未完全清楚。本研究通过博来霉素诱导大鼠肺纤维化模型后,在肺纤维化形成阶段给予丹参素进行干预,结果发现丹参素可减轻大鼠肺泡炎和肺纤维化的严重程度,表明丹参素具有抗肺纤维化形成的作用,有可能成为新的抗肺纤维化的药物,但还需要进一步研究。
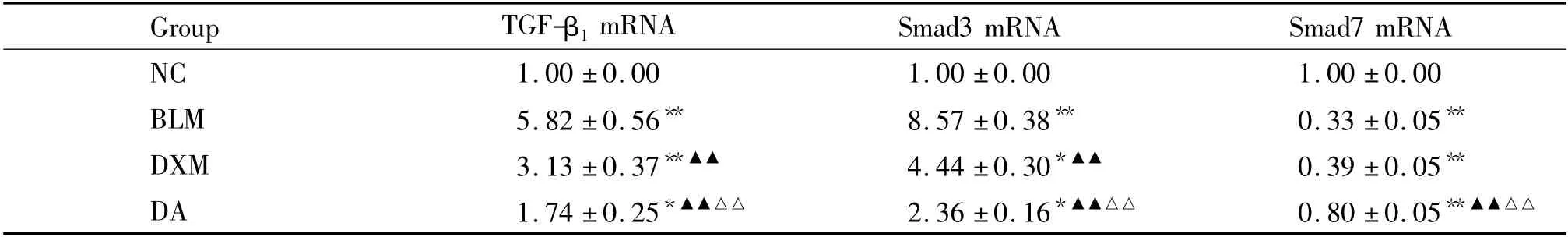
表2 各组大鼠肺组织TGF-β1、Smad3 和Smad7 mRNA 的表达Table 2. The mRNA expression of TGF-β1,Smad3 and Smad7 in lung tissues of rats in each group (mean±SD.n=9)
成纤维细胞灶是特发性肺纤维化的主要病理学特征之一[5]。成纤维细胞灶主要由肌成纤维细胞(myofibroblasts,MFb)构成,其合成胶原纤维的能力是成纤维细胞(fibroblast,Fb)的4 ~5 倍,是造成细胞外基质异常沉积的主要效应细胞[6]。由于α-SMA是Fb 向MFb 转化的标志性蛋白[7],因此对α-SMA蛋白表达水平的检测可以间接地反映MFb 的增殖。本实验结果表明,α-SMA 在DA 组大鼠肺组织中的表达水平较BLM 组显著降低,表明丹参素能够阻止以表达α-SMA 为主的MFb 形成,从而减缓大鼠肺纤维化的形成。
在众多致纤维化细胞因子中,TGF-β1被公认是最重要的调控因子,有研究表明TGF-β1mRNA 在肺纤维化大鼠肺组织中明显升高[8]。TGF-β1能刺激未成熟成纤维细胞生长,促进Fb 迁移、增殖,诱导Fb 表型转换为MFb,继而促进胶原蛋白等细胞外基质在肺间质和肺泡间过度积聚,从而导致肺纤维化的发生与发展[9]。本研究发现,TGF-β1mRNA 在DA组肺组织中的表达程度较BLM 组显著降低,提示丹参素的抗纤维化作用可能部分是通过抑制TGF-β1进而减少肺组织中表达α-SMA 的肌成纤维细胞的数量来实现的。
TGF-β1的致肺纤维化效应主要通过Smads 信号通路转导。Smads 是TGF-β1与其细胞膜上的受体结合后的胞内激酶底物,介导了TGF-β1的细胞内信号转导,其中Smad3 促进纤维化的形成,Smad7 却是TGF-β1信号转导途径的主要抑制性蛋白[10]。因此,本实验选择Smad3 和Smad7 为观察指标,初步探讨丹参素抗纤维化作用的可能机制。本研究发现,BLM 组大鼠肺组织中Smad3 mRNA 表达升高,Smad7 mRNA 表达降低,提示博莱霉素可能激活了TGF-β1/Smads 信号通路,从而使肺成纤维细胞向肌成纤维细胞转化;经丹参素干预后,大鼠肺组织Smad3 mRNA 表达下调,而Smad7 mRNA 上调,提示丹参素可能通过影响成纤维细胞Smad3 和Smad7 mRNA 的表达,抑制TGF-β1/Smads 信号途径,从而发挥抗肺纤维化作用。
[1] Douglas WW,Ryu JH,Schroeder DR. Idiopathic pulmonary fibrosis:impact of oxygen and colchicine,prednisone,or no therapy on survival[J]. Am J Respir Crit Care Med,2000,161(4):1172-1178.
[2] Dempsey OJ. Clinical review:idiopathic pulmonary fibrosis -past,present and future[J]. Respir Med,2006,100(11):1871-1885.
[3] 郭 飞,赵铭山. 丹参素对博莱霉素致大鼠肺纤维化的治疗作用[J].山东医药,2011,51(13):24-25.
[4] 唐 静,戴立里,呙琳琳,等. 肝纤维化中丹参素对TGF -β1/Smads/ERK 信号通路的影响及其相互关系[J]. 第三军医大学学报,2011,33(11):1159-1164.
[5] King TE Jr,Schwarz MI,Brown K,et al. Idiopathic pulmonary fibrosis:relationship between histopathologic features and mortality[J]. Am J Respir Crit Care Med,2001,164(6):1025-1032.
[6] Jiang D,Jiang Z,Han F,et al. HGF suppresses the production of collagen type III and α-SMA induced by TGFβ1in healing fibroblasts[J]. Eur J Appl Physiol,2008,103(5):489-493.
[7] Phan SH. Biology of fibroblasts and myofibroblasts[J].Proc Am Thorac Soc,2008,5(3):334-337.
[8] 金晓光,代华平,庞宝森,等. 博来霉素致大鼠肺纤维化模型肺组织的动态病理变化及其发生机制[J]. 中国病理生理杂志,2009,25(4):708-714.
[9] Böhm M,Raghunath M,Sunderkötter C,et al. Collagen metabolism is a novel target of the neuropeptide α-melanocyte-stimulating hormone[J]. J Biol Chem,2004,279(8):6959-6966.
[10]Leask A,Abraham DJ. TGF-β signaling and the fibrotic response[J]. FASEB J,2004,18(7):816-827.

