沉默FOXC2 对TGF-β1 诱导的MCF-7 细胞上皮-间质转化的逆转作用
屈洪波, 吴诚义△, 范原铭, 韩明利, 陈 鑫, 汤为学
(1重庆医科大学附属第一医院内分泌外科,2 重庆市神经病学重点实验室,重庆400016)
上皮-间质转化(epithelial-mesenchymal transition,EMT)指的是上皮细胞失去其上皮样表型,获得间质样表型的过程,其相反过程称之为间质-上皮转化(mesenchymal-epithelial transition,MET),两者不仅在胚胎发育、损伤修复及组织归巢中发挥重要作用,也在肿瘤侵袭及转移中起着关键性作用[1-3]。2007 年,Mani 等[4]发现叉头框C2(forkhead box C2,FOXC2)通过调控EMT 参与乳腺癌侵袭转移,可能是基底样乳腺癌预后判断的一种重要分子标志物。类似的,Zagouri 等[5]发现MET 现象在三阴乳腺癌中频繁出现可能是其不良预后的表现。最近,Yu 等[6]研究证实循环肿瘤细胞通过在EMT 和MET 中动态表达转化生长因子β1(transforming growth factor β1,TGF-β1)信号分子和FOXC1 转录因子,从而逃避化疗的杀伤作用。目前,有关转录因子FOXC2 在乳腺癌EMT 中的作用及机制的研究尚未见报道。因此,我们拟建立TGF-β1诱导的乳腺癌MCF-7 细胞EMT模型和FOXC2 基因RNA 干扰慢病毒表达载体,探讨沉默FOXC2 表达对TGF-β1诱导的MCF-7 细胞上皮间质转化的逆转作用及对乳腺癌侵袭性的影响,为针对于乳腺癌的靶向治疗提供新的线索。
材 料 和 方 法
1 材料
人乳腺癌细胞系MCF-7 购自中国科学院上海细胞库,慢病毒包装质粒:pGCL-GFP-LV、pHelper1.0 及pHelper2.0 购自上海吉凯基因公司;大肠杆菌DH5α由重庆市神经病学实验室保存;限制性内切酶Age I和EcoR I、琼脂糖凝胶回收试剂盒及T4 连接酶(NEB);质粒DNA 提取试剂盒(Qiagen),Lipofectamine 2000(Invitrogen);人重组TGF-β1(Pepro-Tech);单克隆山羊抗人FOXC2 和单克隆鼠抗人上皮性钙黏蛋白(E-cadherin,E-cad)、紧密连接蛋白1(claudin-1,CLDN1)、纤维连接蛋白1(fibronectin-1,FN1)及β-actin 抗体(Santa Cruz);FITC 标记兔抗鼠II 抗和TRITC 标记的兔抗鼠II 抗(北京中杉金桥生物技术有限公司);总蛋白提取试剂盒、BCA 蛋白定量试剂盒、DAPI 染色液及HRP 标记的兔抗鼠II 抗和兔抗山羊II 抗(碧云天生物技术研究所);总RNA提取试剂盒、逆转录试剂盒、Taq DNA 聚合酶及DNA marker(大连宝生物工程有限公司);PCR 引物设计及合成(上海生工生物工程公司);Transwell 小室(Millipore),胎牛血清及DMEM 高糖培养基(Gibco)。
2 方法
2.1 细胞培养和MCF-7 细胞EMT 模型的建立 乳腺癌MCF-7 细胞在37 ℃、5%CO2及饱和湿度条件下培养,用含有10% 胎牛血清、1 ×105U/L 青霉素、100 mg/L 庆大霉素及5 U/L 胰岛素的DMEM 高糖培养基培养。用0.25% 胰酶消化传代,待细胞生长至板底70% ~80%后,换成无血清培养基饥饿过夜,再加入含有5 μg/L TGF-β1的高糖DMEM 培养基诱导MCF-7 细胞EMT 发生,期间适时加入含有TGFβ1的完全培养基维持间质状态,倒置相差显微镜下观察不同时间下的细胞形态。
2.2 免疫荧光染色检测MCF-7 细胞上皮和间质相关标志物表达 将MCF-7 细胞以1 ×108/L 密度接种于24 孔板中预置的盖玻片上,待细胞贴壁后换成无血清培养基饥饿过夜,加入5 μg/L TGF-β1的高糖DMEM 培养基诱导MCF-7 细胞EMT 发生,96 h 后取出盖玻片,0.4%多聚甲醛固定20 min,如果抗原为核表达需用0.5% Triton X-100 透膜15 min;用5%BSA 封闭30 min,加入单克隆鼠抗人E-cad、CLDN1和FN1 的I 抗(浓度均为1∶50),4 ℃孵育过夜,加FITC 或TRITC 标记的兔抗鼠Ⅱ抗(浓度均为1∶50),37 ℃下避光孵育1.5 h,PBS 冲洗3 次后加DAPI 染色液,室温作用15 min,缓冲甘油封固,荧光显微镜下观察并拍照。
2.3 人FOXC2 基因RNA 干扰慢病毒载体的构建及鉴定 选择GenBank 中人FOXC2 基因编码区序列(NM_005251.2)作为分析序列。设计及合成FOXC2基因的siRNA 寡核苷酸序列和发卡样结构的双链OligoDNA。构建各个干扰序列的表达质粒,转染至293T 细胞,根据FOXC2 抑制率,确定最终有效靶序列为5'-CTACCTGAGCGAGCAGAAT-3',由上海吉凯基因公司合成。其siRNA 的DNA Oligo:5'-CCG GCTACCTGAGCGAGCAGAATCTCGAGATTCTGCTCGCTCAGGTAGTTTTTG-3'。阴性对照的核心序列为5'-TT CTCCGAACGTGTCACGT-3',其DNA Oligo:5'-CCGGTTCTCCGAACGTGTCACGTACGTGACACGTTCGGAGA-ATTTTTG-3'。寡核苷酸经退火形成双链DNA。经T4 连接酶与Age I 和EcoR I 双酶切后的pGCL-GFP载体连接,形成表达siRNA 的重组慢病毒质粒载体(pGCL-GFP-FOXC2-siRNA),经酶切鉴定。转化DH5α 大肠杆菌,摇菌后接种到含氨苄青霉素的LB琼脂培养基上,37 ℃培养16 h,挑取重组阳性克隆行PCR 筛选。
2.4 慢病毒包装及滴度测定 以Qiagen 公司的质粒抽提试剂盒对慢病毒包装系统中3 种质粒:表达最有效靶序列siRNA 的重组慢病毒质粒载体pGCGFP-LV、pHelper1.0 及pHelper2.0,分别进行高纯度无内毒素DNA 抽提,质粒DNA 溶于除菌的TE 中,以紫外光吸收法测定其浓度及纯度,保证所提质粒DNA 的A260/A280在1.8 ~2.0 之间。按说明共转染293T 细胞,8 h 后更换为完全培养基,48 h 后收集富含慢病毒颗粒的细胞上清液,对浓缩后得到高滴度的慢病毒液,以293T 细胞GFP 蛋白的表达水平经孔稀释法测定病毒滴度。
2.5 乳腺癌MCF-7 细胞培养及转染 将TGF-β1诱导成功后的间质化的MCF-7 细胞分为3 组:未转染组、control-siRNA 组及FOXC2 -siRNA 组。在6 孔培养板每孔中接种2 ×105个细胞,待其生长至底板30% ~50%时,按感染复数(MOI =20)加入慢病毒颗粒进行转染实验,以空载体病毒液作为对照,48 h后倒置荧光显微镜下观察绿色荧光表达情况。2 周后采用流式分选出GFP 阳性表达的细胞,通过RTPCR 和Western blotting 检测FOXC2 mRNA 及蛋白表达情况。
2.6 RT-PCR 检测MCF-7 细胞中E-cad、CLDN1 及FN1 mRNA 表达 将TGF-β1诱导的间质化MCF-7细胞经转染,并分选出GFP+细胞扩大培养,待长至瓶底80%后,加入Trizol 试剂常规抽提总RNA,逆转录得到cDNA。以β-actin 为内参照,检测目的基因表达变化,β-actin 上游引物5'-AGCGAGCATCCCCCAAAGTT-3',下游引物5'-GGGCACGAAGGCTCATCATT-3';FOXC2 上游引物5'-CTCAACGAGTGCTTCGTCAA-3',下游引物5'-GCTCCTCCTTCTCCTTGGAC-3';E-cad 上游引物 5'-TTGCTACTGGAACAGGGACAC-3',下游引物5'CCCGTGTGTTAGTT CTGCTGT-3';CLDN1 上游引物5'-AGAAGATGAGGATGGCTGTCA-3',下游引物5'-TTGGTGTTGGGTAAGAG GTTG-3';FN1 上游引物5'-G CCTTCAAGTTCCTGTTAC-3',下游引物5'-GACTCTCTCCGCTTGG ATTCT-3'。设置反应参数:95 ℃预变性15 s,95 ℃10 s,58℃30 s,72 ℃1 min,共进行35 个循环。RT-PCR 产物条带采用Quantity One 软件分析,以β-actin 为内参照,以目的基因灰度值/β-actin 灰度值计算mRNA相对表达量,以上实验重复3 次,取平均值。
2. 7 Western blotting 检测MCF-7 细胞中E-cad、CLDN1 及FN1 蛋白表达 将TGF-β1诱导的间质化MCF-7 细胞经转染、分选出GFP+细胞扩大培养,收集细胞后,加入RIPA 裂解液及PMSF,冰上静置30 min。4 ℃、12 000 r/min 离心10 min,将上清移至一新的EP 管中,BCA 法测定蛋白浓度,沸水煮5 min后上样,采用8%SDS-PAGE 电泳,先用40 V 电泳30 min 左右至跑到分离胶处,再改为80 V 电泳1.5 h左右,直至溴酚蓝跑至底部。做好“三明治”夹板,250 mA 恒流转膜1.5 h,20 mL 封闭液37 ℃孵育2 h,加入单克隆鼠抗人E-cad、CLDN1 和FN1 的Ⅰ抗(浓度均为1∶200),4℃孵育过夜,次日TBST 洗膜3次,HRP 标记的兔抗鼠Ⅱ抗(浓度均为1∶1 000),37℃孵育1.5 h,TBST 洗膜3 次。ECL 化学发光试剂孵育1 min,置于暗盒内曝光拍照,曝光时间30 s。以β-actin 为内参照,以目的蛋白灰度值/β-actin 灰度值计算目的蛋白相对表达量。以上实验重复3 次,取平均值。
2.8 Transwell 小室检测MCF-7 细胞的侵袭能力
将MCF-7 细胞分为3 组:空白对照组、TGF-β1诱导组和FOXC2-siRNA 组,每组设3 个复孔。各组细胞用0.25%胰酶消化后,用含10% 胎牛血清的高糖DMEM 培养基重悬为1 ×108/L。每个Transwell 上室加入0.3mL 这种细胞悬液(约3 ×104细胞),下室加入0.6 mL 含10% 胎牛血清的高糖DMEM 培养基,37 ℃、5%CO2孵箱中培养24 h 后,取出小室并弃去上室液体,用棉签擦去膜上层细胞,4%多聚甲醛液固定15 min,瑞氏染色液染色20 min,于倒置相差显微镜下计数膜下层的细胞。200 倍光镜随机选择10 个视野计数,计算平均值。
3 统计学处理
应用SPSS 19.0 统计分析软件,数据以均数±标准差(mean ±SD)表示,组间均数比较应用单因素方差分析。以P <0.05 为差异有统计学意义。
结 果
1 TGF-β1 诱导MCF-7 细胞形态学变化观察
MCF-7 细胞经5 μg/L TGF-β1诱导的第3 天,细胞形态发生明显变化,倒置相差显微镜观察显示,第0 d 未处理的MCF-7 细胞呈现典型上皮细胞形态,细胞排列紧密;而经TGF-β1处理后,大部分细胞丧失了多角形上皮表型,细胞明显拉长,细胞间连接更疏松,取而代之的为一种梭形、纤维细胞样及间质细胞样形态,见图1。
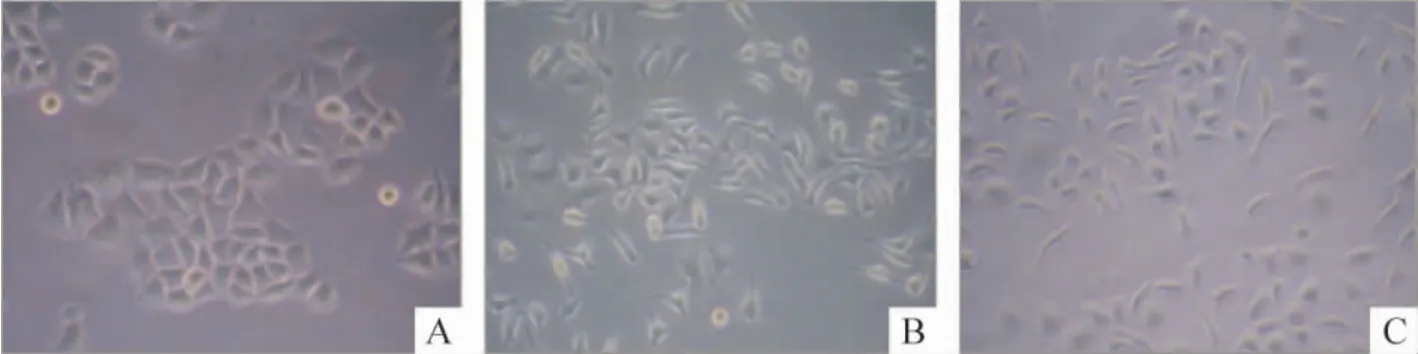
Figure 1. The morphology of MCF-7 cells induced by TGF-β1(×100).A:the cells showed multi-angle shape or epithelial phenotype characteristics in control group (0 d);B,C:the cells showed spindle-shaped changes in TGF-β1 group (3 d and 6 d,respectively).图1 TGF-β1 诱导MCF-7 细胞发生EMT 时的细胞形态学变化
2 TGF-β1 诱导MCF-7 细胞EMT 后上皮和间质相关标志物的表达
经5 μg/L TGF-β1处理MCF-7 细胞96 h 后,免疫荧光染色显示,相比于对照组,上皮性标志物Ecad 和CLDN1 在细胞膜表达明显减少,而间质性标志物FN1 表达明显增加,见图2。

Figure 2. The expression of the markers related to EMT in MCF-7 cells induced by TGF-β1(×200).Yellow arrows indicate positive expression.图2 TGF-β1 诱导MCF-7 细胞EMT 后EMT 相关标志物的表达
3 重组慢病毒载体滴度的测定及MCF-7 细胞转染
采用逐孔稀释法,转染96 h 后,荧光显微镜可见不同稀释倍数下荧光细胞所占比例,根据不同病毒颗粒数计算出病毒滴度为7 ×1014Tu/L,说明有大量质粒进入感染细胞,病毒包装成功。使用上述2 组病毒颗粒感染MCF-7 细胞,12 h 后观察未见细胞明显死亡,说明FOXC2-siRNA 慢病毒本身对细胞无明显毒害作用,实验组与对照组之间无明显差异。转染12 h 后,更换为完全培养基,48 h 后观察有荧光蛋白表达,且表达量在96 h 达到最大,感染效率>80%,并在之后保持在高表达状态,没有明显下降,可用于后续实验,见图3。

Figure 3. The green fluorescent protein expression in MCF-7 cells transfected FOXC2-siRNA lentiviral vector observed by fluorescent microscope (×200).A:inverted phase-contrast microscope;B:fluorescent microscope;C:merged.图3 FOXC2-siRNA 慢病毒转染MCF-7 细胞的绿色荧光蛋白表达
4 沉默FOXC2 表达对TGF-β1 诱导的MCF-7 细胞EMT 相关标志物mRNA 表达的影响
RT-PCR 凝胶电泳条带显示,FOXC2-siRNA 组、control-siRNA 组及未转染组FOXC2 mRNA 表达量分别为0.08 ±0.01、0.44 ±0.06 和0.59 ±0.08;E-cad mRNA 表达量分别为0.67 ± 0.11、0.41 ± 0.08 和0.53 ±0.09;CLDN1 mRNA 表达量分别为:0.56 ±0.07、0.23 ±0.04 和0.21 ±0.03;FN1 mRNA 表达量分别为0.07 ±0.01、0.64 ±0.08 和0.75 ±0.12。与control-siRNA 组及未转染组比较,FOXC2-siRNA 组上皮性标志物E-cad 和CLDN1 明显上调,而间质性标志物FN1 明显下调,差异均有统计学意义(P <0.05),见图4。
5 沉默FOXC2 表达对TGF-β1诱导的MCF-7 细胞EMT 相关标志物蛋白表达的影响
Western blotting 凝胶成像条带显示,与未转染组及control-siRNA 组比较,FOXC2-siRNA 组FOXC2 蛋白的表达明显降低,FOXC2 下游E-cad 及CLDN1 表达上调,间质性标志物FN1 表达下调,3 组间差异有统计学意义(P <0.05),见图5。

Figure 4. The mRNA expression of FOXC2 (A)and the markers related to EMT (B:E-cad;C:CLDN1;D:FN1)in mesenchymal MCF-7 cells analyed by RT-PCR.M:marker;1:FOXC2-siRNA group;2:control-siRNA group;3:non-transfection group.图4 RT-PCR 检测间质化MCF-7 细胞中FOXC2 和EMT 相关标志物mRNA 的表达

Figure 5. The protein expression of FOXC2 and EMT-related markers in mesenchymal MCF-7 cells analyed by Western blotting.1:non-transfection group;2:control-siRNA group;3:FOXC2-siRNA group.Mean±SD. n=3. * P <0.05 vs non-transfection or control-siRNA.图5 Western blotting 检测间质化MCF-7 细胞中FOXC2 EMT 相关标志物蛋白的表达
6 沉默FOXC2 表达对TGF-β1 诱导的MCF-7 细胞侵袭能力的影响
对照组、TGF-β1组和FOXC2-siRNA 组穿过人工基质胶的间质化MCF-7 细胞的数目分别为16 ±3、52 ±6 及13 ±2,TGF-β1组侵袭细胞数明显高于其它2 组,差异有统计学意义(P <0.05),见图6。
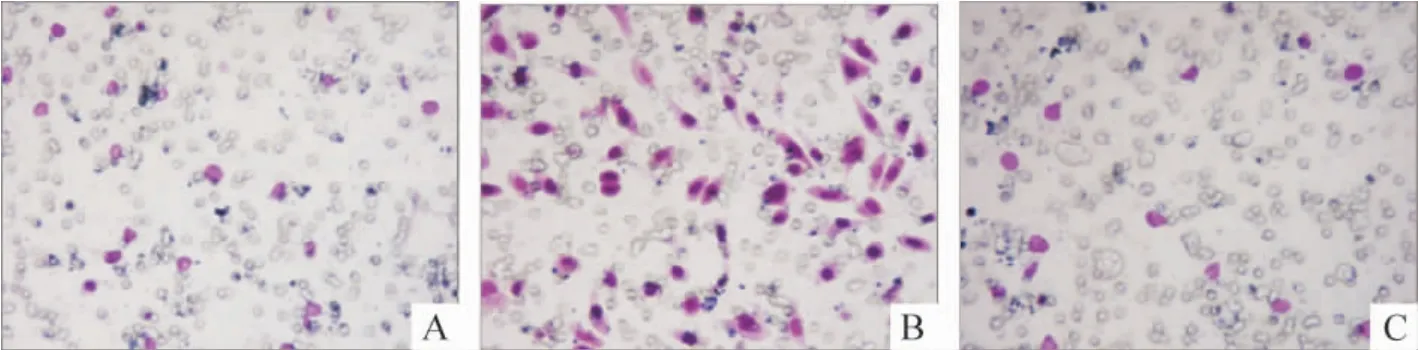
Figure 6. Impact of FOXC2 silencing on invasion of mesenchymal MCF-7cell was assayed using Transwell chambers(×200).A:control group;B:TGF-β1-induced group;C:FOXC2-siRNA group.图6 沉默FOXC2 对间质化MCF-7 细胞体外侵袭能力的影响
讨 论
EMT 在多种肿瘤演进中扮演重要角色,有些是瞬时事件,有些表现为永久性EMT 特征。EMT 使得上皮细胞失去细胞极性及与基底膜连接等上皮样特征,而获得高迁移、侵袭、抗凋亡及降解细胞外基质等间质样特征[7]。EMT 发生受到诸多因素的影响,其中TGF-β1是诱发EMT 的关键始动因素,TGF-β1可通过Smad 或非Smad 信号通路诱导某些上皮细胞发生EMT[8-9]。
研究表明,一些重要的转录调控因子,如Twist、Snail1、Slug、FOXC2、ZEB1/2 等能够诱导EMT 发生,它们共同特征是含有能识别靶基因启动子上E-box基序的DNA 结合序列[10-11]。更多的EMT 相关标志物鉴定,为EMT 模型的建立提供理论依据。本研究发现,MCF-7 细胞在外源性TGF-β1诱导下,48 h 内显示出细胞生长抑制现象,这与先前推论的TGF-β1在早期对细胞表现为生长抑制一致,从第3 d 开始至第6 d,细胞逐渐拉长,形成长梭形具有运动能力的成纤维样细胞,说明EMT 转录因子表达量需要积累到一定浓度才能与E-cad 的启动子结合抑制其表达,导致细胞间连接的松散,可能是因为从转录到翻译,再到蛋白质合成并发挥作用需要一定的时间,说明MCF-7 细胞EMT 过程表现出时序特征[12-13]。而免疫荧光检测结果也显示上皮性标志物E-cad 及CLDN1 在TGF-β1诱导的MCF-7 细胞膜上表达降低,而FN1 在间质样细胞中表达明显增加。Gerhard等[14]在化生性乳腺癌研究中,发现claudins 蛋白及E-cad 蛋白表达缺失或降低与波形蛋白高表达及癌干细胞表型相关,表明化生性乳腺癌具有低紧密连接蛋白特征。其它研究也发现EMT 相关转录因子高表达与Claudin-low 及化生性乳腺癌表型相关[10]。类似的,Jung 等[15]发现claudin-1、claudin-2、claudin-3及claudin-4 的低表达与胃癌的侵袭性及不良预后相关。
FOXC2 属于人类叉头框(forkhead box,FOX)家族成员之一,FOX 蛋白不仅作为典型转录因子通过招募共激活因子等调节基因转录,有些还能直接同凝聚染色质结合参与重构,协同其它转录因子参与转录调节,PI3K/Akt、TGF-β/Smad 和MAPK 等多个信号通路都可以影响FOX 蛋白磷酸化水平,调节其活性。新近研究发现FOX 蛋白家族中的多个成员通过调控上皮细胞可塑性,在肿瘤恶性进展中发挥着促进或抑制作用[16]。如牟永告等[17]研究显示核转录因子FOXP3 阳性的星形细胞瘤较FOXP3 阴性的星形细胞瘤的预后差,可能成为星形细胞瘤免疫调节的新靶点。而蒋光愉等[18]研究显示FOXA1 及BRCA1 在三阴乳腺癌中表达呈负相关,提示FOXA1在乳腺癌中发挥着抑癌作用。目前,有关FOXC2 在乳腺癌侵袭转移中作用及其是否参与TGF-β1调控的EMT 机制,仍不清楚。为此,我们构建FOXC2 基因RNA 干扰慢病毒表达载体,转染至间质化MCF-7细胞中,RT-PCR 及Western blotting 结果均显示间质性标志物FN1 表达下调,而上皮性标志物E-cad 及CLDN1 表达上调,提示EMT 过程发生逆转,即FOXC2 可逆转间质化MCF-7 细胞回复到上皮表型,这与EMT 机制可逆性,即MET 机制相符[19-20]。而Transwell 小室模型也证明沉默FOXC2 表达能够显著降低穿过人工基质基底膜间质化的MCF-7 细胞数量,且穿过基底膜的细胞形态学回复至上皮表型,不仅表明乳腺癌细胞侵袭能力受到抑制,同时也表明EMT 是一种动态及可逆的过程。以上结果表明FOXC2 可能作为TGF-β1下游靶基因参与MCF-7 细胞EMT 和MET 的调控。
综上所述,外源性TGF-β1能够诱导MCF-7 细胞发生EMT,沉默FOXC2 表达可逆转EMT 发生并降低其侵袭转移能力,提示FOXC2 在乳腺癌侵袭转移中发挥重要作用;而FOXC2 作为转录因子,处于信号通路级联反应的中心环节,对其上游信号转导通路及下游转录调控的直接靶基因尚有待进一步研究。
[1] Morrison CD,Parvani JG,Schiemann WP. The relevance of the TGF-β paradox to EMT-MET programs[J]. Cancer Lett,2013,Mar 5.[Epub ahead of print]
[2] Hader C,Marlier A,Cantley L. Mesenchymal-epithelial transition in epithelial response to injury:the role of Foxc2[J]. Oncogene ,2010,29(7):1031-1040.
[3] Wang Y,Lui WY. Transforming growth factor-β1 attenuates junctional adhesion molecule-A and contributes to breast cancer cell invasion[J]. Eur J Cancer,2012,48(18):3475-3487.
[4] Mani SA,Yang J,Brooks M,et al. Mesenchyme Forkhead 1 (FOXC2)plays a key role in metastasis and is associated with aggressive basal-like breast cancers[J].PNAS,2007,104(24):10069-10074.
[5] Zagouri F,Bago-Horvath Z,Rössler F,et al. High MET expression is an adverse prognostic factor in patients with triple-negative breast cancer[J]. Br J Cancer,2013,108(5):1100-1105.
[6] Yu M,Bardia A,Wittner BS,et al. Circulating breast tumor cells exhibit dynamic changes in epithelial and mesenchymal composition[J]. Science,2013,339(6119):580-584.
[7] Yao D,Dai C,Peng S. Mechanism of the mesenchymalepithelial transition and its relationship with metastatic tumor formation[J]. Mol Cancer Res,2011,9(12):1608-1620.
[8] Ono Y,Hayashida T,Konagai A,et al. Direct inhibition of the transforming growth factor-β pathway by proteinbound polysaccharide through inactivation of Smad2 signaling[J].Cancer Sci,2013,32(12):1549-1559.
[9] Freudlsperger C,Bian Y,Contag Wise S,et al. TGF-β and NF-κB signal pathway cross-talk is mediated through TAK1 and SMAD7 in a subset of head and neck cancers[J]. Oncogene,2013,32(12):1549-1559.
[10]Taube JH,Herschkowitz JI,Komurov K,et al. Core epithelial-to-mesenchymal transition interactome gene-expression signature is associated with claudin-low and metaplastic breast cancer subtypes[J]. Proc Natl Acad Sci U S A,2010,107(35):15449-15454.
[11]Harney AS,Meade TJ,LaBonne C. Targeted inactivation of Snail family EMT regulatory factors by a Co(III)-Ebox conjugate[J]. PLoS One,2012,7(2):e32318.
[12]Dhasarathy A,Phadke D,Mav D,et al. The transcription Factors Snail and Slug activate the transforming growth factor-beta signaling pathway in breast cancer[J].PLoS One,2011,6(10):e26514.
[13]王海兵,张慧君,苏晋梅,等. 肺癌A549 细胞上皮-间质转化及其对微小RNA 表达的影响[J].中华肿瘤杂志,2011,33(8):590-593.
[14]Gerhard R,Ricardo S,Albergaria A,et al. Immunohistochemical features of claudin-low intrinsic subtype in metaplastic breast carcinomas[J]. Breast,2012,21(3):354-360.
[15]Jung H,Jun KH,Jung JH,et al.The expression of claudin-1,claudin-2,claudin-3,and claudin-4 in gastric cancer tissue[J]. J Surg Res,2011,167(2):e185-e191.
[16]Feuerborn A,Küffer S,Gröne HJ. Forkhead factors regulate epithelial plasticity:impact on cancer progression[J]. Cell Cycle,2011,10(15):2454-2460.
[17]牟永告,王振宁,史泓浏,等. 核转录因子FOXP3 蛋白在人脑星形细胞肿瘤组织中的表达及临床意义[J].中国病理生理杂志,2010,26(8):1479-1482.
[18] 蒋光愉,李 红,何伟丽,等. 三阴乳腺癌FOXA1 和BRCA1 的表达及其对预后的意义[J]. 中国病理生理杂志,2012,28(7):1230-1234.
[19]Kurahara H,Takao S,Maemura K,et al. Epithelial-mesenchymal transition and mesenchymal-epithelial transition via regulation of ZEB-1 and ZEB-2 expression in pancreatic cancer[J].J Surg Oncol,2012,105(7):655-661.
[20]Chen J,Han Q,Pei D. EMT and MET as paradigms for cell fate switching[J]. J Mol Cell Biol,2012,4(2):66-69.

