脒基锂化合物催化Tishchenko反应
姚吉祥,刘巧,吴佳娜,袁鸿,张伟,郭志强,魏学红
(山西大学 应用化学研究所,山西 太原 030006)
Tishchenko反应(也叫Claisen-Tishchenko反应)是一种通过醛的二聚合成羧酸酯的反应(式1).它可以把简单醛直接催化转化为相应的酯,实现了每个反应物原子的百分之百利用率,体现了“原子经济性”,从而得到广泛关注.该反应已成功应用于医药、香料和食品工业[1].传统的Tishchenko反应使用醇钠、醇铝等作为催化剂,但是在催化芳香醛(如苯甲醛)时反应缓慢或者生成相应的酯产率低[2].此后开发出多种多样的催化剂,诸如硼酸[3]、过渡金属化合物[4],但是这些催化剂有的需要比较苛刻的反应条件,有的催化剂比较昂贵,有的催化效率比较低.
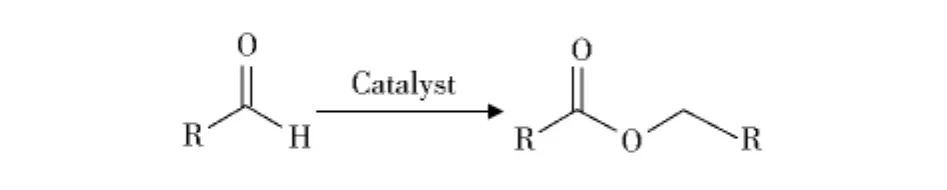
式1 Tishchenko反应Scheme 1 Tishchenko reaction
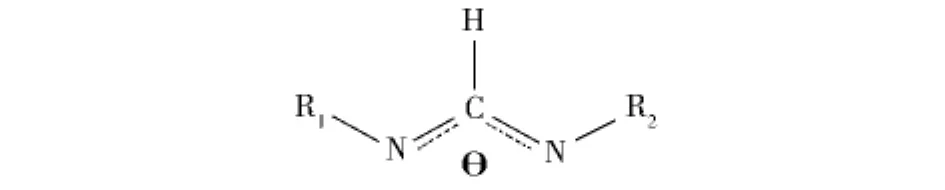
图1 甲脒基配体Fig.1 Formamidinate ligands
最近,有文献报道了脒基碱土金属化合物[5]和脒基镧系金属化合物[6]在催化Tishchenko反应方面有很好的催化活性和底物耐受性,但是催化剂的制备使用了剧毒的汞,容易造成环境污染.
由于脒基(图1)是含有两个氮原子的配体,它可以和金属以多种配位模式配位,通过改变氮和碳原子上的取代基,脒基配体的空间结构和电子密度很容易进行调控,是金属有机化学中的重要的配体之一[7].基于此,本论文尝试了脒基碱金属化合物用于催化Tishchenko反应,以期能够得到环境友好,催化效率高的新型催化剂.
1 实验部分
1.1 试剂与仪器
原甲酸三乙酯(天津市光复精细化工研究所,分析纯);苯胺、邻甲基苯胺、间甲基苯胺、对甲基苯胺、2,6-二异丙基苯胺(阿拉丁试剂公司,分析纯);冰醋酸(北京化学试剂公司,分析纯);正丁基锂(2.2mol·L-1的正己烷溶液)(Alfa Aesar试剂公司,分析纯);实验所用的醛均经过减压蒸馏或重结晶后使用;
Bruker DRX-300MHz超导核磁共振仪.
1.2 脒基锂化合物的合成(式2)
五种不同取代基的二芳基脒锂化合物是按文献方法合成[8-10]:在圆底烧瓶中加入二芳基苯胺(60mmol)和原甲酸三乙酯(30mmol),加入乙酸(1.5mmol),加热搅拌过夜.粗产品用冷的正己烷(30mL)洗涤,抽滤,真空干燥,得到无色粉末状产品(产率80%~92%).在氮气保护下将1.05倍量的nBuLi滴加到0℃下的N,N′二芳基甲脒的THF溶液中,浓缩重结晶得到脒基锂化合物,熔点及谱图数据和文献一致[8-10].
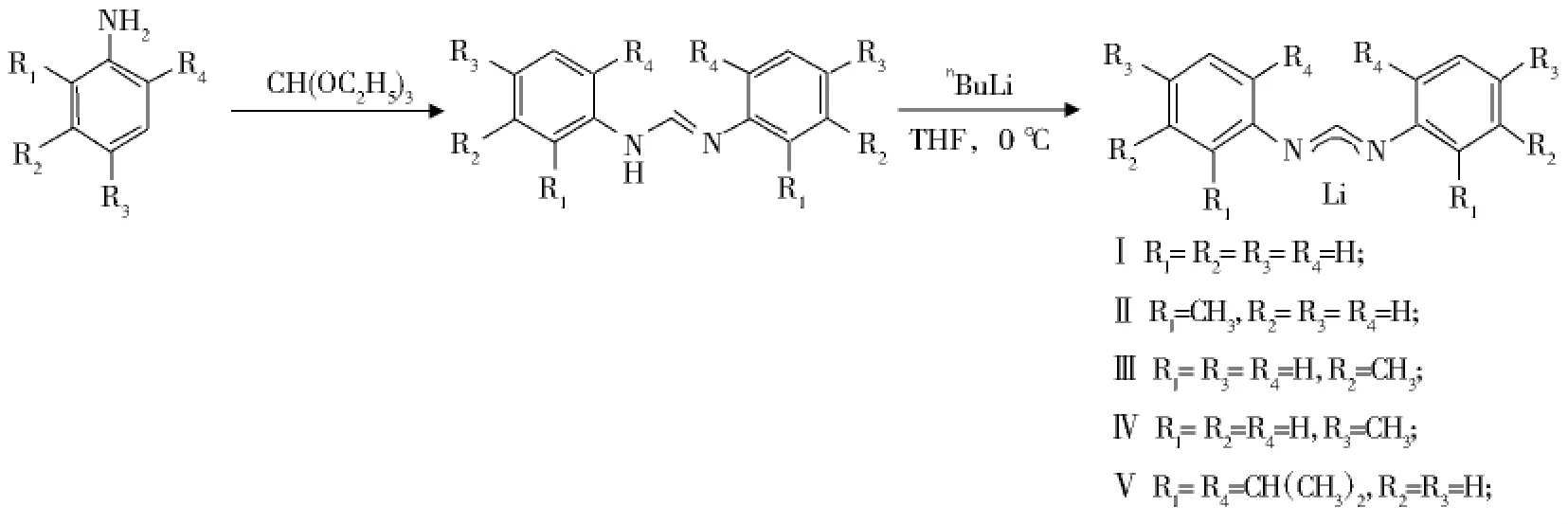
式2 脒基配体及其锂化合物的合成Scheme 2 Synthesis of formamidines and lithium formamidinates
1.3 Tishchenko反应
a苯甲酸苄酯的合成:室温下,将苯甲醛(2.8mL,28mmol)加入到盛有催化剂Ⅴ(0.28mmol)的Schlenk瓶中,油浴加热,80℃反应4h后(催化反应过程用TLC进行监测)停止加热,通空气,用少量水终止反应,减压蒸馏得无色油状液体苯甲酸苄酯(2.877g,94%),核磁检测产率为98%.1H NMR(300MHz,CDCl3):δ(ppm)5.38(s,2H,CH2),7.38-7.56(t,8H,C6H5),8.09-8.11(d,2H,C6H5).
b 4-甲基苯甲酸-4-甲基苯甲酯的合成,方法同a,减压蒸馏得无色油状液体b,产率86%.1H NMR(300 MHz,CDCl3):δ(ppm)2.36-2.40 (d,6H,CH3),5.31 (s,2H,CH2),7.18-7.23 (t,4H,C6H4),7.33-7.35(d,2H,C6H4),7.94-7.97(d,2H,C6H4).
c 4-甲氧基苯甲酸-4-甲氧基苯甲酯的合成,方法同a,减压蒸馏得无色油状液体c,产率74%.1H NMR(300MHz,CDCl3):δ(ppm)3.79-3.86(t,6H,CH3),5.26(s,2H,CH2),6.87-6.90 (t,4H,C6H4),7.35-7.38(d,2H,C6H4),7.99-8.02(d,2H,C6H4).
d 2-氯苯甲酸-2-氯苯甲酯的合成,方法同a,减压蒸馏得无色油状液体d,产率49%.1H NMR(300 MHz,CDCl3):δ(ppm)5.35(s,2H,CH2),7.02-7.18(m,3H,C6H4),7.23-7.32(m,3H,C6H4),7.38-7.43(t,1H,C6H4),7.76-7.77(d,1H,C6H4).
e 4-氯苯甲酸-4-氯苯甲酯的合成:用10mL THF溶解催化剂Ⅴ(0.165g,0.32mmol),加入对甲氯苯甲醛(4.508g,32mmol),室温下反应24h,核磁检测产率为73%.1H NMR(300MHz,CDCl3):δ(ppm)5.32(s,2H,CH2),7.26-7.43 (t,6H,C6H5),7.98-8.01 (d,2H,C6H5).
f 2-硝基苯甲酸-2-硝基苯甲酯的合成,方法同e,核磁检测产率为29%.熔点:100~101℃.1H NMR(300MHz,CDCl3):δ(ppm)5.76 (s,2H,CH2),7.51 (m,1H,C6H4),7.64-7.81 (m,5H,C6H4),7.93(d,1H,C6H4),8.09(d,1H,C6H4);13C NMR (CDCl3,75MHz):δ(ppm)66.1,125.3,126.4,128.4,130.5,130.9,131.3,132.1,133.3,134.3,135.2,148.9,149.4,166.1.
g 4-硝基苯甲酸-4-硝基苯甲酯的合成,方法同e,核磁检测产率为76%.1H NMR (300MHz,CDCl3):δ(ppm)5.49(s,2H,CH2),7.61(d,2H,C6H4),8.22-8.32(m,6H,C6H4).
2 结果与讨论
2.1 催化剂筛选
以苯甲醛为底物,反应温度80℃,反应时间4h,催化剂用量1%(催化剂与底物的摩尔比,下同),无溶剂条件下考察了脒基锂化合物(Ⅰ-Ⅴ)的催化Tishchenko反应(表1,P94),发现大位阻的脒基锂化合物Ⅴ的催化效果最好,核磁结果显示几乎完全反应(Table 1,Entry 5).在此基础上,进一步考察了催化剂Ⅴ在不同条件下的催化反应活性,结果表明,产率随反应温度的提高而显著提高,但在超过80℃时,产率变化不大(Table 1,Entries 5,6,7,11).同时考察了催化剂用量对催化活性的影响,为0.1%摩尔量时,仍有催化效果,为0.2%摩尔量时,即可达到较高的产率(Table 1,Entries 8,9),催化剂用量为0.5%摩尔量时,产率可达到89%(Table 1,Entry 5).
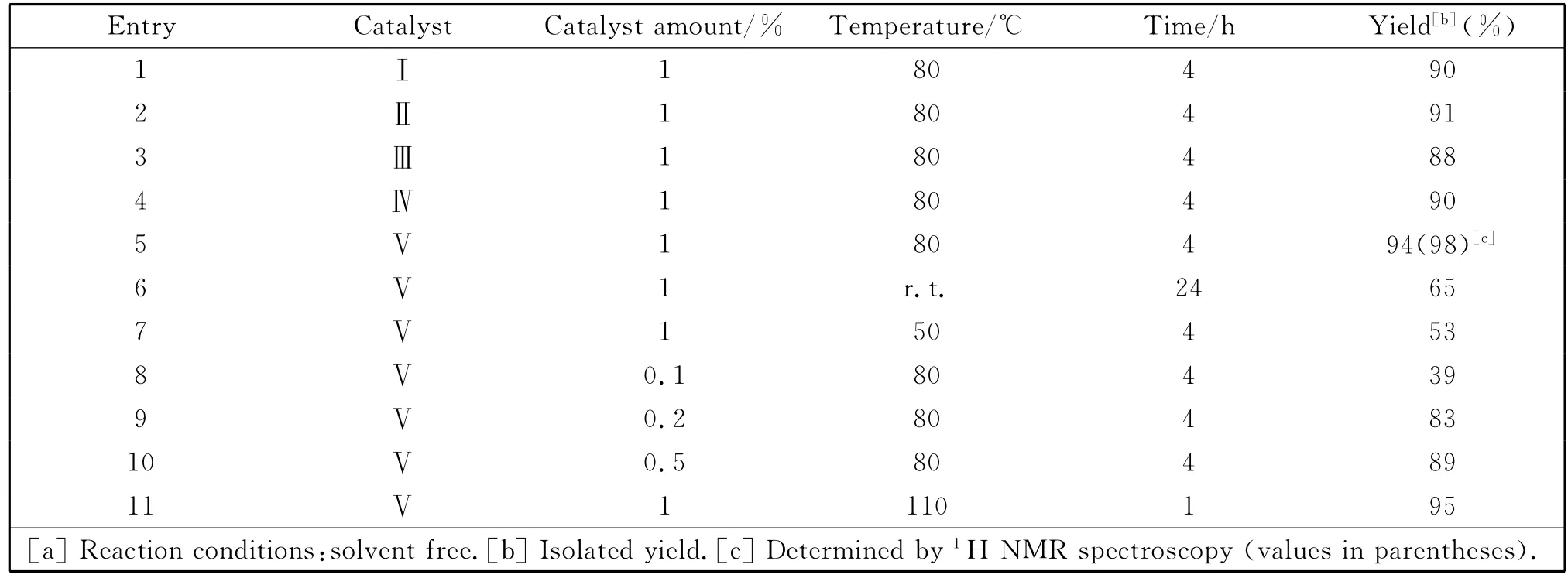
表1 脒基锂化合物催化苯甲醛的Tishchenko反应Table 1 Tishchenko reaction of benzaldehyde to benzyl benzoate[a]
2.2 不同芳香醛的Tishchenko反应
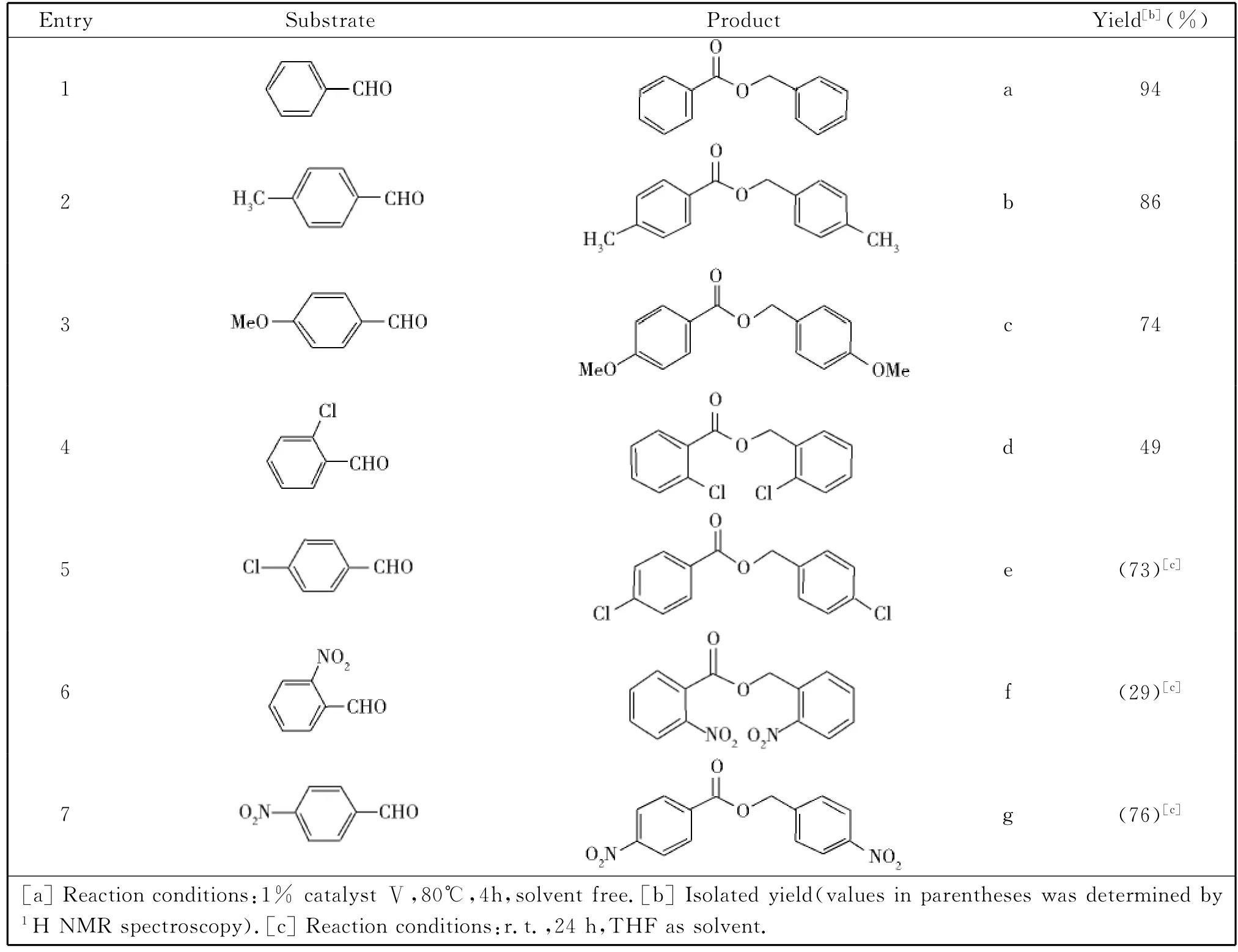
表2 N,N′-二(2,6-二异丙基苯基)甲脒锂(Ⅴ)催化芳香醛的Tishchenko反应Table 2 Tishchenko reactions of aromatic aldehydes catalyzed by catalystⅤ[a]
在2.1结果基础上,考察了催化剂Ⅴ对不同芳香醛的适应性(表2,P94).结果表明:对位取代苯甲醛在相同条件下的反应活性随取代基的推电子效应增强而降低(Table 2,Entries 2,3),随取代基吸电子效应增强而升高(Table 2,Entries 5,7);邻位取代的醛因为位阻效应催化效果偏低(Table 2,Entries 6,7).在室温条件下,催化剂Ⅴ催化对氯苯甲醛和对硝基苯甲醛的Tishchenko反应,产率分别可达到73%和76%(Table 2,Entries 5,6).
3 结论
本论文合成出一系列脒基锂化合物,并用于催化芳香醛的Tishchenko反应.发现催化剂配体位阻越大和底物醛上带有吸电子基团,越有利于增强催化剂的催化活性.在无溶剂条件下,80℃反应4h,N,N′-二(2,6-二异丙基苯基)甲脒锂催化剂负载量为1%,苯甲酸苄酯的产率为98%.该反应在无溶剂条件下进行,负载量低,原子100%利用,是一种绿色环保的制备酯的好方法.
[1]Seki T,Nakajo T,Onaka M.The Tishchenko Reaction:a Classic and Practical Tool for Ester Synthesis[J].Chem Lett,2006,35(8):824-829.
[2]Ogata Y,Kawasaki A.Alkoxide Transfer from Aluminum Alkoxide to Aldehyde in the Tishchenko Reaction[J].Tetrahedron,1969,25(4):929-935.
[3]Stapp P R.Boric Acid Catalyzed Tishchenko Reactions[J].J Org Chem,1973,38(7):1433-1434.
[4]Simon Marc-Olivier,Darses S.An in situ Generated Ruthenium Catalyst for the Tishchenko Reaction[J].Adv Synth Catal,2010,352(2+3):305-308.
[5]Crimmin M R,Barrett A G M,Hill M S,et al.Heavier Alkaline Earth Amides as Catalysts for the Tischenko Reaction[J].Org Lett,2007,9(2):331-333.
[6]Zuyls A,Roesky P W,Deacon G B,et al.Lanthanide Formamidinates as Improved Catalysts for the Tishchenko Reaction[J].Eur J Org Chem,2008(4):693-697.
[7]Barker J,Kilner M.The Coordination Chemistry of the Amidine Ligand[J].Coord Chem Rev,1994,133:219-300.
[8]Kuhn K M,Grubbs R H.A Facile Preparation of Imidazolinium Chlorides[J].Org Lett,2008,10(10):2075-2077.
[9]Cole M L,Junk P C,Louis L M.Synthesis and Structural Characterization of Some Novel Lithium and Sodium N,N′-di(para-tolyl)formamidinate Complexes[J].J Chem Soc Dalton Trans,2002(20):3906-3914.
[10]Cole M L,Davies A J,Jones C,et al.Lithium and Sodium N,N′-di(2,6-dialkylphenyl)formamidinate Complexes[J].J Organomet Chem,2004,689(19):3093-3107.

