HPLC加标检测6-氨基青霉烷酸产品中残余苯乙酸含量
王海雁,常华,胡雅琴,杨维芳,冯锋
(1.山西大同大学 化学化工学院,山西 大同 037009;2.国药集团大同威奇达中抗制药有限公司,山西大同经济技术开发区,山西 大同 037000)
0 引言
我国是世界青霉素原料药生产大国,山西大同地区由于其得天独厚的日照时间长、空气干燥等气候条件,成为全国主要的青霉素原料药生产基地.6-氨基青霉烷酸(6-Aminopenicillanic acid,6-APA),结构式见图1A,是制备半合成头孢菌素如氨苄青霉素、阿莫西林、羟氨苄青霉素、唑酮氨苄青霉素、硫苯咪唑青霉素、磺唑氨苄青霉素等的主要母核.6-APA终产品中苯乙酸(结构式见图1B)的含量是评价6-APA品质的一个重要标准.6-APA终产品中苯乙酸的质量百分比必须低于0.1%,否则直接影响下游产品质量.目前已有的苯乙酸的分析方法,主要是针对6-APA生产过程中的质量控制,终产品中苯乙酸等杂质的单独测定则需要复杂的样品前处理过程[1-6].
基于《中国药典》2010年版检测6-APA的标准HPLC方法[7],本实验建立了HPLC的苯乙酸加标检测法,能够直接测定6-APA终产品中的6-APA及残留苯乙酸的含量.该方法符合国家食品药品监督管理局国家药品标准[8],且不需要柱前预处理.与现行梯度洗脱测定苯乙酸含量的方法相比,操作简便、快速,且精密度、准确度、重复性均符合国标要求.
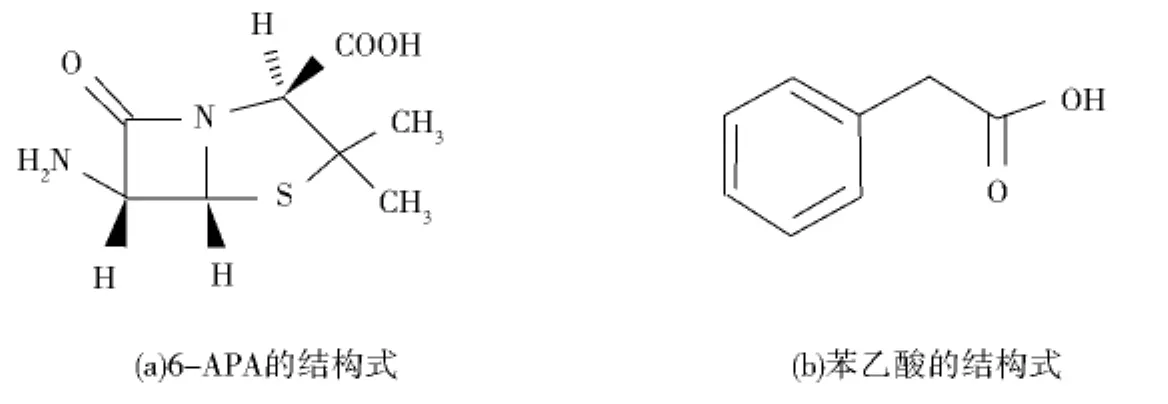
图1 6-APA、苯乙酸的结构式Fig.1 Constitutional formulas of 6-APA and Phenylacetic Acid
1 实验方法
1.1 主要仪器和试剂
高效液相色谱仪(Agilent 1260,美国),紫外分光光度计(岛津UV-1601,日本),100mm×4.6mm,5μm ODS-2C18色谱柱(Hypersil,美国).
KH2PO4(分析纯,天津市科密欧化学试剂有限公司),Na2HPO4(分析纯,天津市科密欧化学试剂有限公司),6-APA终产品(批号1205179,含水分0.043%,国药集团大同威奇达药业中抗有限公司提供),6-APA标准品(批号 WS2012001,含量99.4%),苯乙酸标准品(批号 WS2012002,含量99.19%),实验用水均为纯化水.
1.2 实验方法
在2010年版检测6-APA的标准HPLC方法[7]基础上结合本实验室条件加以优化.流动相A为pH=7.00的磷酸盐缓冲溶液,流动相B为乙腈.检测波长选择220nm,柱温是25℃,流量为1mL/min,进样量为20μL.
依据6-APA样品中苯乙酸色谱峰的保留时间和峰面积定量计算苯乙酸的含量.为了精确鉴别色谱图中微量苯乙酸的出峰位置,参照文献中检测物加标分析法[8],将已知浓度的苯乙酸标准液在测试前加入到样品溶液中一同进样,与未加标准品的样品溶液的色谱图相比较,该色谱图中苯乙酸的峰面积会明显增加,即可精确确认实际样品中苯乙酸峰的位置,并根据标准曲线计算其含量.这是一种简单快速的定量定位法.
精确称量苯乙酸标准品、6-APA标准品适量,用流动相A溶解并稀释.配制苯乙酸标准储备液的浓度为0.1526mg/mL,苯乙酸标准对照液浓度为其标准储备液质量浓度的1%,用于精密度试验的苯乙酸标准使用液浓度为2.250×10-3mg/mL;配制6-APA标准储备液的浓度为3.00mg/mL,6-APA标准对照液的浓度为其标准储备液浓度的1%.配制苯乙酸和6-APA混合标准对照液中苯乙酸与6-APA的浓度与其标准对照液相同,分别为1.526×10-3mg/mL、3.00×10-2mg/mL.4℃条件下贮藏.
2 结果与讨论
2.1 系统适用性实验
分别取空白辅料溶液、苯乙酸标准对照液、6-APA标准对照液、苯乙酸和6-APA混合标准对照液,以及6-APA终产品作为供试品溶液,按以上条件测定.得到6-APA和苯乙酸的保留时间分别为3.886min和6.372min(图2).苯乙酸和6-APA分离完全,分离度为10.05,大于1.5;6-APA的理论塔板数为4793,不低于1500,拖尾因子为0.86,不高于2.5,符合国标[9].
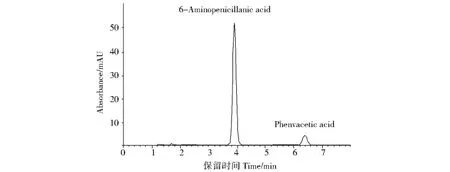
图2 苯乙酸和6-氨基青霉烷酸混合标准对照液的色谱图Fig.2 Chromatograms of standard solution of 6-aminopenicillanic acid and phenvacetic acid
2.2 线性范围
以峰面积A为纵坐标,苯乙酸的浓度C为横坐标进行线性分析,得到苯乙酸对照标准品溶液在0.3022~3.022×10-3mg/mL浓度范围内其浓度C与峰面积A 呈良好的线性关系,线性方程Y=38.74 X+0.2637,相关系数为0.9998.
2.3 检测限及精密度实验
流动相A逐级稀释苯乙酸标准对照品溶液10倍、100倍、1000倍、10000倍.分别过滤,注入Agilent样品瓶中,按色谱条件测定,记录色谱图,量取峰面积.结果表明:当信噪比(S/N)为3/1时,溶液的浓度为0.0153×10-3mg/mL,苯乙酸对照品溶液的检测限为15.26ng/mL(RSD=0.82%).
苯乙酸标准使用液注入Agilent样品瓶中,按色谱条件测定,记录色谱图,量取峰面积,连续进样6次.该试验得出6次进样所得峰面积的相对标准偏差为0.82%,小于2.0%,可用于6-APA样品中苯乙酸含量的测定.
2.4 稳定性实验
过滤苯乙酸标准对照液,注入Agilent样品瓶中,分别于0h,1h,2h,3h,4h,5h进样.按色谱条件测定,记录色谱图,量取峰面积.稳定性实验结果RSD<2%,表明本实验条件下,样品在25℃条件下5h内稳定,仪器的稳定性良好,可以满足6-APA样品中苯乙酸含量的测定[9].
2.5 加标苯乙酸的回收率实验
取3批苯乙酸含量已知的6-APA样品,如表1所示精确称取样品量,置于100mL的容量瓶中,并平行加入1.0mL苯乙酸储备液,用流动相A溶解并稀释至刻度,摇匀、过滤,取滤液,注入Agilent样品瓶中,按色谱条件进行测定.测定结果见表1.实验结果显示,实验回收率在80%~120%范围内,可以满足6-APA样品中苯乙酸含量的测定[9].
2.6 终产品样品分析
实际样品分析时,按照试验方法对不同批号的6-APA终产品样品进行加标处理并测定.结果见表2.样品分析结果表明,由该方法测得的样品中苯乙酸的含量略小于由梯度洗脱测得的结果,但均符合国家食品药品监督管理局国家药品标准(0.1%).
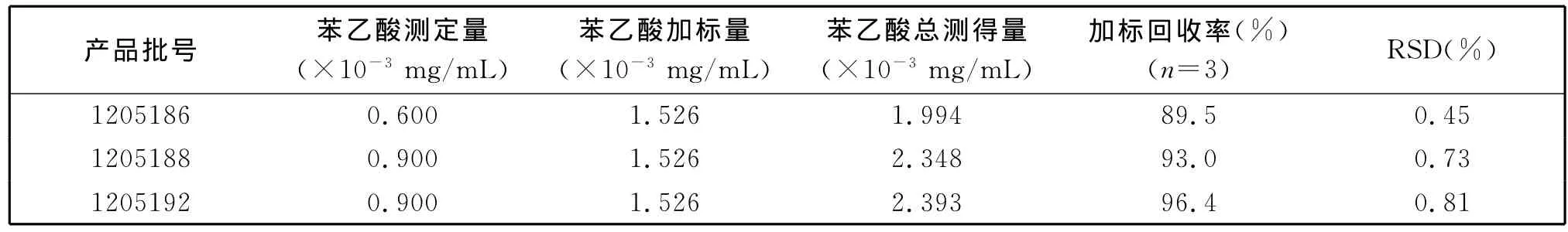
表1 苯乙酸回收实验Table 1 Recovery test of standard Phenethyl acid

表2 终产品中苯乙酸测定Table 2 Analysisi of phenethyl acid in real samples
3 结论
本文建立了高效液相色谱法加苯乙酸标准品检测6-APA样品中残留苯乙酸含量的方法.应用本方法,6-APA、苯乙酸分离完全,线性良好,相关系数为0.9998.对样品不需要进行柱前预处理,不仅节省了时间,提高了效率,而且所得的测量结果,准确度与精密度都符合要求,分析结果令人满意.总体来说,本文所用方法快速便捷,而且准确度、分离度、重现性都能达到要求,完全适用于终产品中6-APA和残留苯乙酸含量的直接测定.
[1]赵静玫,都绛瑛,张铭俊.青霉素裂解液的高效液相色谱分析[J].色谱,2001,19(1):88-90.
[2]刘杨秋,李强,王亚辉,等.高效毛细管电泳法测定酶法合成阿莫西林反应体系[J].过程工程学报,2008,8(1):148-154.
[3]王冕,台燕,李景红.HPLC法测定6-氨基青霉烷酸中苯乙酸和青霉素 G含量[J].中国抗生素杂志,2008,33(2):87-91.
[4]赵国芬,尹翠英,王洪涛.6-APA中残余苯乙酸、青霉素 G含量的测定[J].石家庄职业技术学院学报,2008,20(4):15-17.
[5]LEE,C K,SU W D.Separation of Phenylacetic Acid From 6-aminopenicillanic Acid via Cloud-point Extraction with N-decyltetra(Ethylene Oxide)Nonionic Surfactant[J].Seperetion Science & Technology,1998,33(7):1003-1012.
[6]师学娟,苏大伟,刘焕姿,等.高效液相色谱法测定6-APA 的相关物质[J].河北化工,2011,34(12):20-22.
[7]《中国药典》2010年版二部附录 Ⅳ[S].
[8]Wang H Y,Lee W M A,Shuang S M,et al.SPE/HPLC/UV Studies on Acrylamide in Deep-fried Flour-based Indigenous Chinese Foods[J].Microchemical Journal,2008,89:90-97.
[9]国家食品药品监督管理局国家药品标准 WSI-(X-046)-2005Z[S].

