硫化氢对拟南芥在干旱胁迫条件下的生理影响
金竹萍,方慧慧,张丽萍,罗雅楠,乔增杰,龚泽华,裴雁曦*
(1.山西大学 生命科学学院,山西 太原 030006;2.中北大学 化工与环境学院,山西 太原 030051)
硫化氢(H2S)在常温下是一种无色有臭鸡蛋气味的气体,长期以来一直被科学家们当成有毒气体看待,认为它对人体有害无益.直到2008年杨广东等在Science发表论文,表明H2S参与了生理性血管扩张和血压的调节,将H2S的研究推向一个高峰[1].之后越来越多的证据表明H2S在动物体中是继一氧化氮(NO)和一氧化碳(CO)之后的又一种气体信号分子[2-3].
植物体的内源H2S主要以L/D-半胱氨酸为底物,通过半胱氨酸脱巯基酶催化产生H2S、丙酮酸盐和NH3;也可以通过叶片吸收大气中的H2S;或者在亚硫酸盐还原酶的作用下,将SO2-3直接还原成H2S[4].植物中已经克隆到与内源H2S产生直接相关的基因:L型半胱氨酸脱巯基酶编码基因(L-cysteine desulphydrase,LCD)At3g62130[5]和D型半胱氨酸脱巯基酶编码基因(D-cysteine desulphydrase,DCD)At1g48420[6].H2S在植物体内生理作用的研究刚刚起步,相继有报道证实H2S可增强植物的抗氧化胁迫能力,增加植物非生物胁迫抗性[7-10]、促进根的形成和种子的萌发等[11-12].目前绝大多数研究停留在外源施加H2S供体后,对供试材料进行表型观察和生理生化指标测定,而对内源H2S在植物体内重要生理作用的机制却知之甚少.
本文通过聚乙二醇(PEG)模拟干旱胁迫,以拟南芥野生型和H2S产生酶的编码基因LCD的缺失突变体为实验材料,通过对胁迫前后种子萌发率和抗氧化酶等活性的测定,揭示了内源H2S对拟南芥(Arabidopsis thaliana)在干旱胁迫条件下的生理影响.
1 材料与方法
1.1 植物材料
拟南芥生态型Columbia;购买美国俄亥俄州立大学(ABRC)的T-DNA插入突变体lcd(SALK_082099)种子,经分子鉴定,杂合植株自交获得纯合株系.
1.2 实验方法
PEG处理参考张依章等的方法[13],按照预实验结果,质量浓度(g/mL)梯度设定为0、0.1、0.15、0.17、0.19、0.25、0.3.播种消毒后的野生型(wild type,WT)种子,200粒/皿,每个PEG浓度梯度重复3次.置于人工气候箱内,(23±1)℃,光照强度2000lx,16h光照/8h黑暗周期培养.1周后记录种子的萌发情况,统计萌发率.萌发率
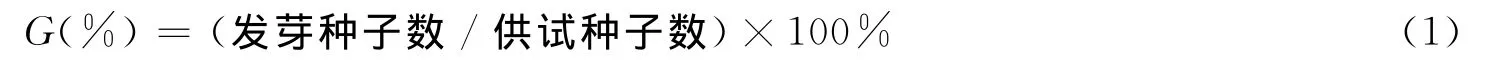
将种子萌发率为50%的PEG浓度作为种子萌发的半抑制浓度.在半抑制浓度的培养基上同时播种WT和lcd种子,培养1周后统计萌发率进行比较.
将1/2MS培养基上生长2周的WT和lcd幼苗取出并分为两部分:一部分进行H2S产率测定和材料脱水处理[7],

另一部分幼苗的根部浸泡于0.3g/mL PEG溶液中5h,分别将胁迫前后的材料用50mmol/L Tris-HCl缓冲液(pH 7.8)提取粗蛋白.超氧化物歧化酶SOD活性采用A001-1试剂盒(南京建成生物公司)测定;过氧化氢酶CAT、过氧化物酶POD、抗坏血酸过氧化物酶APX的活性及丙二醛MDA含量测定参考李忠光等的方法[14];过氧化氢 H2O2的测定方法采用DAB显色法[15].
1.3 统计分析
结果用“平均值±标准偏差”表示,采用SPSS Statistics 17.0分析软件进行单因素比较,P<0.05和P<0.01分别为差异显著和差异极显著.
2 结果与分析
2.1 PEG干旱胁迫下WT和lcd的种子萌发
选取状态一致的WT种子,在上述不同PEG浓度条件下培养1周,统计萌发率.结果显示:对照组的萌发率为100%,随着PEG浓度的升高,萌发率逐渐降低.PEG浓度为0.17g/mL时,萌发率降低为50%,是拟南芥WT种子萌发的半抑制浓度;当PEG浓度增加到0.25g/mL时,WT种子的萌发受到完全抑制.以0.17g/mL PEG为培养浓度,同时播种Col和lcd种子,1周后再观察其萌发情况,结果如图1(a)所示.WT的萌发率大约为50%,lcd种子萌发率与之相比下降约40%,两者的差异极显著(P<0.01).

图1 WT和lcd的H2S产率(b)、失水率(c)及其在干旱胁迫下的种子萌发率(a)Fig.1 H2S production rate(b),water loss rate(c)and germination rate(a)of WT and lcd under drought stress
2.2 WT和lcd的H2S产率和失水率
为探究萌发率差异的原因,对两种材料的H2S产率和失水率进行了测定.突变体lcd的H2S产率仅为WT的61.86%,两者存在显著差异(P<0.05)(图1b);随着脱水时间的延长,lcd的失水速度明显较 WT快(图1c),且表现为更严重的萎蔫状态.为了进一步揭示内源H2S对植物体在干旱胁迫下的作用机制,测定以下相关的生理指标.
2.3 H2S对干旱胁迫下拟南芥体内H2O2的影响
H2O2是对植物体具有极强毒害作用的活性氧,几乎能氧化所有的细胞组分.采用DAB显色法来显示叶片中H2O2的含量,结果如P116图2(a)所示.胁迫前的野生型WT叶片中几乎没有H2O2,而突变体lcd叶片内H2O2较多.PEG干旱胁迫后,WT和lcd叶片中的H2O2斑点数量明显增加,尤其是lcd中的斑点更密集、颜色更深.
2.4 H2S对干旱胁迫下拟南芥体内MDA的影响
MDA含量可以反映植物膜脂过氧化的水平和对细胞膜的伤害程度.图2(b)所示是野生型WT和突变体lcd在PEG处理后体内MDA含量的变化情况.可以看出,在PEG胁迫前,WT体内MDA含量为lcd的80%,但没有显著差异(P>0.05).经过PEG胁迫处理后,WT和lcd体内MDA含量均增加,且两者相差1.56倍,差异极显著(P<0.01).
2.5 H2S对干旱胁迫下拟南芥POD活性的影响
POD是植物体内普遍存在的、活性较高的酶,通过POD活性可以了解某一时期植物体内生理代谢的变化.由图2(c)得知,胁迫前野生型 WT的POD活性与突变体lcd相比,没有显著差异(P>0.05).随着PEG的胁迫,其活性在二者体内均有明显的升高,WT在胁迫处理后POD活性提高了28.64%;而lcd则比处理前相比提高了2.11倍,与胁迫后的WT相比具极显著差异(P<0.01).
2.6 H2S对干旱胁迫下拟南芥CAT活性的影响
CAT在活性氧(ROS)代谢过程中,将H2O2转化为H2O和O2,使生物机体免受H2O2的毒害作用.由图2(d)可知,在正常培养条件下,野生型WT体内CAT的活性较低,突变体lcd与其相比具有显著差异(P<0.05).经过PEG胁迫后,lcd的CAT活性为胁迫前的1.84倍,差异极显著(P<0.01),且与 WT相比也有极显著增加(P<0.01).
2.7 H2S对干旱胁迫下拟南芥SOD活性的影响
SOD可以催化氧自由基的歧化反应,生成H2O2,然后再进一步被CAT转化.因此SOD可看作是植物抗氧化的第一道防线.从图2(e)可以看出,PEG胁迫前野生型WT的SOD活性与突变体lcd相比,没有显著差异(P>0.05).PEG胁迫处理后,WT和lcd的SOD活性分别提高了1.26倍和2.22倍,且两者之间具有极显著差异(P<0.01).
2.8 H2S对干旱胁迫下拟南芥APX活性的影响
APX在ROS代谢过程中,以还原型抗坏血酸为底物对H2O2进行清除,使脂质过氧化作用减弱.从图2(f)可以看出,胁迫前的突变体lcd与野生型 WT相比,APX活性无显著差异(P>0.05).经过PEG进行胁迫之后,WT和lcd的APX活性均有极显著增加(P<0.01),分别为胁迫前的1.23倍和1.37倍,且胁迫后的WT和lcd的APX活性相比差异显著(P<0.05).
3 讨论
H2S作为重要的气体信号分子,在植物生命活动中的作用已受到越来越多的关注.随着研究的不断深入,外源H2S对植物体的生理作用表现得更加全面.张华等研究了H2S供体NaHS对Cd和Cu胁迫下小麦种子萌发的影响,说明外源H2S能显著促进小麦种子中淀粉酶与酯酶的活性上升[12,16].本研究以拟南芥野生型和H2S体内生成的关键酶编码基因LCD敲除突变体为实验材料,测定了PEG干旱胁迫后的种子萌发率.结果表明突变体lcd中由于LCD基因表达量下降,植株体内H2S的产率降低,使得其种子萌发率较WT降低40%,具有极显著差异(P<0.01),进一步揭示了内源H2S可促进植物种子萌发的作用机制.
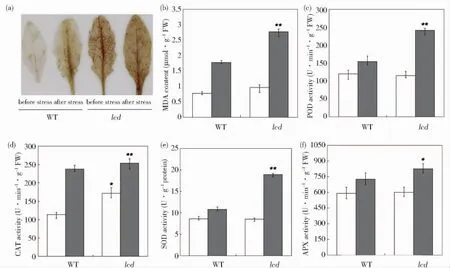
图2 WT和lcd在PEG胁迫下H2O2、MDA含量及各种抗氧化酶活性的比较Fig.2 Comparison of H2O2,MDA content and antioxidant enzymes activity under drought stress
此外,陆续有报道表明,外源H2S可作为一种抗氧化信号分子,提高植物的抗旱性[7-9]、缓解铬和铜等重金属毒性[10,12].植物处在干旱和重金属等非生物胁迫的环境中时,会直接或间接地产生活性氧(ROS)[17],对植物产生毒害作用.植物体在长期适应环境的过程中,进化出一套完整的酶促保卫系统,包括SOD、POD、CAT和APX等,能够清除大量自由基,从而降低或消除ROS对脂膜的伤害.有研究结果表明,在干旱、重金属等非生物胁迫条件下,外源施加H2S供体可使抗氧化酶的活性升高,MDA和H2O2的含量下降[9-10,12].本实验结果表明:WT和lcd在PEG胁迫处理前,H2O2的斑点密度和颜色及略高的MDA含量,表明突变体lcd已有H2O2的积累,但大部分抗氧化酶的活性都未呈现显著差异;而经PEG胁迫处理后,H2O2的积累量和MDA含量极显著增加,SOD、POD和CAT活性较处理前均有不同幅度的增加,而且lcd与WT相比也有极显著差异(P<0.01).也就是说,正常生长条件下,WT和lcd中的H2O2含量无显著差异,因此两者的抗氧化酶活性差异不显著(P>0.05).经PEG胁迫处理后,由于H2S信号的缺失,使得lcd中H2O2的含量增加,氧化损伤的程度更为严重,植物通过提高抗氧化酶活性,达到清除ROS的目的.因此在干旱胁迫条件下,H2S对ROS的清除有促进作用,可能与植物体内的抗氧化系统是平行关系,两者共同作用最终清除ROS.这与外源NO可以使重金属As胁迫下的水稻抗氧化酶活性下降的结果相一致[18].
[1]Yang G,Wu L,Jiang B,et al.H2S as a Physiologic Vasorelaxant:Hypertension in Mice with Deletion of Cystathionine Gamma-lyase[J].Science,2008,322:587-590.
[2]Sanderson K.Emissions Control,Could Hydrogen Sulphide be the New Nitric Oxide?Katharine Sanderson Reports on the Rotten-egg Gas That is Earning a Reputation in Human Physiology[J].Nature,2009,459:500-502.
[3]Pei Y X,Wu B,Cao Q H,et al.Hydrogen Sulfide Mediates the Anti-survival Effect of Sulforaphane on Human Prostate Cancer Cells[J].Toxicol App Pharmaco,2011,257:420-428.
[4]Papenbrock J,Riemenschneider A,Kamp A,et al.Characterization of Cysteine-Degrading and H2S-Releasing Enzymes of Higher Plants-From the Field to the Test Tube and Back[J].Plant Biol,2007,9:582-588.
[5]Harrington H M,Smith I K.Cysteine Metabolism in Cultured Tobacco Cells[J].Plant Physiol,1980,65(1):151-155.
[6]Soutourina J,Blanquet S,Plateau P.Role of D-cysteine Desulfhydrase in the Adaptation of Escherichia coli to D-cysteine[J].Journal of Biological Chemistry,2001,276:40864-40872.
[7]Jin Z P,Shen J J,Qiao Z J,et al.Hydrogen Sulfide Improves Drought Resistance in Arabidopsis Thaliana[J].Biochem Biophys Res Commun,2011,414:481-486.
[8]Zhang H,Ye Y K,Wang S H,et al.Hydrogen Sulfide Counteracts Chlorophyll Loss in Sweet Potato Seedling Leaves and Alleviates Oxidative Damage Against Osmotic Stress[J].Plant Growth Regul,2009,58:243-250.
[9]Zhang H,Jiao H,Jiang C X,et al.Hydrogen Sulfide Protects Soybean Seedlings Against Drought-induced Oxidative Stress[J].Acta Physiol Plant,2010a,32:849-857.
[10]Zhang H,Hu L Y,Hu K D,et al.Hydrogen Sulfide Alleviated Chromium Toxicity in Wheat[J].Biol Plantaru,2010,54:74-747.
[11]Zhang H,Tang J,Liu X P,et al.Hydrogen Sulfide Promotes Root Organogenesis in Lpomoea Batatas,Salix Matsudana and Glycine Max [J].J Integr Plant Biol,2009,51:1086-1094.
[12]Zhang H,Hu L Y,Hu K D,et al.Hydrogen Sulfide Promotes Wheat Seed Germination and Alleviates the Oxidative Damage Against Copper Stress[J].J Integr Plant Biol,2008,50:1518-1529.
[13]张依章,王幼宁,张文胜,等.聚乙二醇模拟水分胁迫筛选拟南芥突变体的新方法 [J].植物生理学通讯,2006,42(2):285-287.
[14]李忠光,李江鸿,杜朝昆,等.在单一提取系统中同时测定五种植物抗氧化酶 [J].云南师范大学学报:自然科学版,2002,22(6):44-48.
[15]张蜀秋.植物生理学实验技术教程 [M].北京:科学出版社,2011:56-58.
[16]焦浩.硫化氢调控胁迫条件下植物种子萌发及幼苗生长的信号机制[D].合肥:合肥工业大学,2010.
[17]Jami S K,Clark G B,Turlapati S A,et al.Ectopic Expression of an Annexin from Brassica Juncea Confers Tolerance to Abiotic and Biotic Stress Treatments in Transgenic Tobacco[J].Plant Physiol Biochem,2008,46:1019-1030.
[18]Singh H P,Kaur S,Batish D R,et al.Nitric Oxide Alleviates Arsenic Toxicity by Reducing Oxidative Damage in the Roots of Oryza Sativa (rice)[J].Nitric Oxide,2009,20:289-297.

