聚羟基丁酸羟基辛酸关节一体化组织工程支架制备条件及性能优化
杜美丽,张永红,吕利华,刘坚,陈学英,赵良启*
(1.山西大学 化学生物学与分子工程教育部重点实验室,山西 太原 030006;2山西医科大学 第二医院骨科,山西 太原 030001;3山西省医用组织库,山西 太原 030006)
创伤和骨性关节炎引起的关节骨软骨损伤是临床上的一种常见病,但由于软骨自身修复能力极弱,使得关节骨软骨损伤修复成为医学难题之一[1-2].传统的关节骨软骨损伤治疗方法虽然取得了一些临床效果,但分别呈现出不同的医学缺陷与不足,如供体不足、供区继发性受损、免疫排斥等,长期疗效不够理想[3].1994年Vacanti等[4]首次将组织工程学引入关节骨软骨损伤修复研究,为关节损伤修复开辟了新途径.关节骨软骨组织工程研究包括支架、生长因子和种子细胞三大部分,其中支架制备是最重要的基础工作之一.制备支架曾经历了单层支架、双层支架研究阶段.初期是分别制备软骨、硬骨单层支架,通过缝合/黏合组成两层关节支架.这种关节支架的缺陷是两层连接不紧密,容易分离或脱落.于是人们开始研究一次制备骨软骨双层支架,较好地解决了双层分离的问题,但未能解决阻止血管进入软骨部分的问题.为此,参照关节组织结构,研制仿生多层一体化关节组织工程支架成为新课题.
本实验室自主开发出一种新型生物材料——羟基丁酸与羟基辛酸共聚体[P(HB-HO)],该材料具有良好的可塑性、加工性、生物相容性、生物可降解性和降解产物无毒性等特性[5].本文通过溶剂浇铸/颗粒沥滤法[6-7]技术路线,以PHBHOx为连续相,研制骨层、过渡层、软骨层一体化仿生关节组织工程支架,优化支架制备条件和支架性能,并进行支架与细胞的复合培养试验,为该一体化支架修复关节损伤研究提供技术支撑与实验数据.
1 材料与方法
1.1 材料:羟基丁酸与羟基辛酸共聚体(山西大学生物技术研究所)、一周龄新西兰白兔(购自山西医科大学)、猪骨头(购自太原市田和食品集团有限公司)
1.2 主要仪器:RGT1-20A万能力学试验机(深圳瑞格尔仪器有限公司),JSM-6701F扫描电子显微镜(日本电子株式会社),酶联标记检测仪(美国BioRad-550型).
1.3 实验方法
1.3.1 猪膝关节软骨脱细胞基质的制备
为了制备软骨层复合材料,参照改良的Courtman法[8]对关节软骨行脱细胞处理后,进行HE、甲苯胺蓝、Masson染色.
1.3.2 软骨层/过渡层/硬骨层一体化关节支架制备条件优化
各层支架的制备:氯仿溶液溶解PHBHOx及复合材料(脱细胞基质、β-磷酸三钙),加入一定粒径NaCl颗粒作为致孔剂充分混匀,置于自制模具内,压实常温干燥后脱模,蒸馏水浸泡去除NaCl,真空干燥至恒质量.
一体化支架的制备:选择各层支架的最优参数,以PHBHOx为连续相,氯仿为溶剂,在同一模具内连续制作3层支架,常温压实干燥后,脱模去盐制得软骨层/过渡层/骨层PHBHOx一体化关节组织工程支架.
1.3.2.1 孔隙率的测定:采用比重法[9],在25℃条件下进行孔隙率测定.
1.3.2.2 力学强度的测定:万能材料试验机测试支架的抗压强度,支架为直径10mm、高度15mm的圆柱状.测试时以5mm/min加载速率进行,测定受力压缩达30%时的荷载,计算抗压强度.计算公式:

其中бc、P、A分别代表抗压强度(Pa)、压缩30%时的荷载(N)及试样面积(m2).
1.3.2.3 扫描电镜观察:将支架切成6mm×3mm×3mm的长方体,真空喷金后,观察支架的内部结构以及孔径大小.
1.3.2.4 吸水率的测定:将支架切成质量大体相同的6块并称重记为m0,然后将其放在PBS缓冲液中,每隔1h用滤纸吸干称重记为m1.计算公式为

1.3.3 兔骨髓间充质干细胞与关节一体化支架的复合培养
将兔骨髓间充质干细胞(BMSC)与关节一体化支架进行复合培养,检测支架对BMSC生长和增殖的影响.
1.3.3.1 BMSC的分离:采用全骨髓分离法[10]提取并分离BMSC,接种于培养瓶,在37℃、体积分数5%CO2、饱和湿度条件下的培养箱进行原代培养,首次24h换含体积分数20%胎牛血清的L-DMEM液,以后每隔3d换液.
1.3.3.2 BMSC在支架上的生长情况:取第二代BMSCs,质量浓度0.25%的胰酶消化后调整浓度至1.0×103个/mL,在96孔板内放置20块相同规格的经消毒过的支架,将细胞悬液用移液枪滴注于支架上,每块材料接种150μL.在37℃、体积分数5%CO2、饱和湿度条件下的培养箱内静置4h后,每孔加入培养液200μL充分覆盖材料,作为实验组.将细胞以1.0×103/mL直接接种于96孔板内作为对照组.培养10d后经MTT法处理后在酶联免疫分析仪测定490nm处的OD值.所测数据进行t检测统计分析.
1.3.3.3 细胞在支架上的黏附情况:将支架切成体积大小相似的小块并用体积分数75%酒精浸泡24h,再用L-DMEM浸泡12h,在超净台上紫外线照射30min,然后将细胞滴加在支架上复合培养7d,用体积分数2.5%的戊二醛固定24h,体积分数10%、30%、50%、70%、90%的酒精梯度脱水,自然晾干后真空喷金,扫描电镜观察细胞在支架上的黏附情况.
2 结果
2.1 猪膝关节软骨脱细胞基质的制备结果
将脱细胞基质(ACTM)石蜡包埋、切片、倒置显微镜观察,结果见图1(P110).经HE染色,细胞中空,无细胞核残留,只有细胞外基质(红色)(图1a).经甲苯胺蓝染色,细胞外基质呈深蓝色,表明蛋白多糖呈阳性(图1b).经Masson染色,细胞外基质呈蓝色,表明胶原呈阳性(图1c).结果显示:猪软骨细胞已去除干净,仅保留了细胞外基质成分,表明该脱细胞基质不会引起免疫排斥反应,可用于BMSC培养.
2.2 支架各层支架制备条件优化及关节一体化支架制备结果
以孔隙率和力学强度为主要技术指标,进行了单因素优化试验,结果见表1(P110).结果显示,致孔剂的粒径和含量分别影响着支架的孔径大小、孔隙率及力学强度,支架的孔隙率与NaCl含量成正比,力学强度与NaCl含量及β-TCP、ACTM含量成反比.根据人体骨软骨组织工程对各层的要求:软骨层选择ACTM/PHBHOx质量分数为4%、NaCl/PHBHOx为4g/g;过渡层选择 NaCl/PHBHOx为3g/g;硬骨层选择β-TCP/PHBHOx质量分数为15%、NaCl/PHBHOx为4g/g.
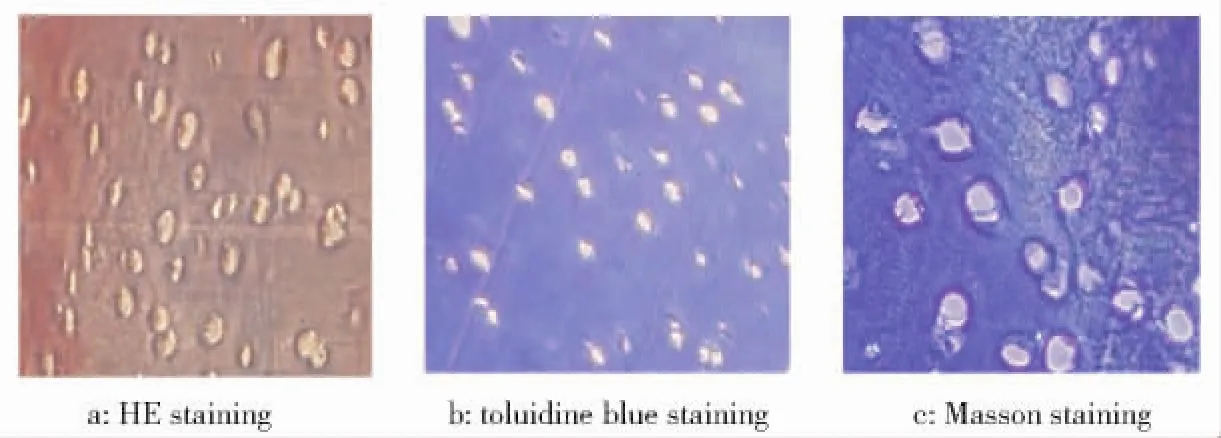
图1 猪膝关节软骨脱细胞基质的染色观察(×400)Fig.1 Staining observation of pig knee joint acellular matrix
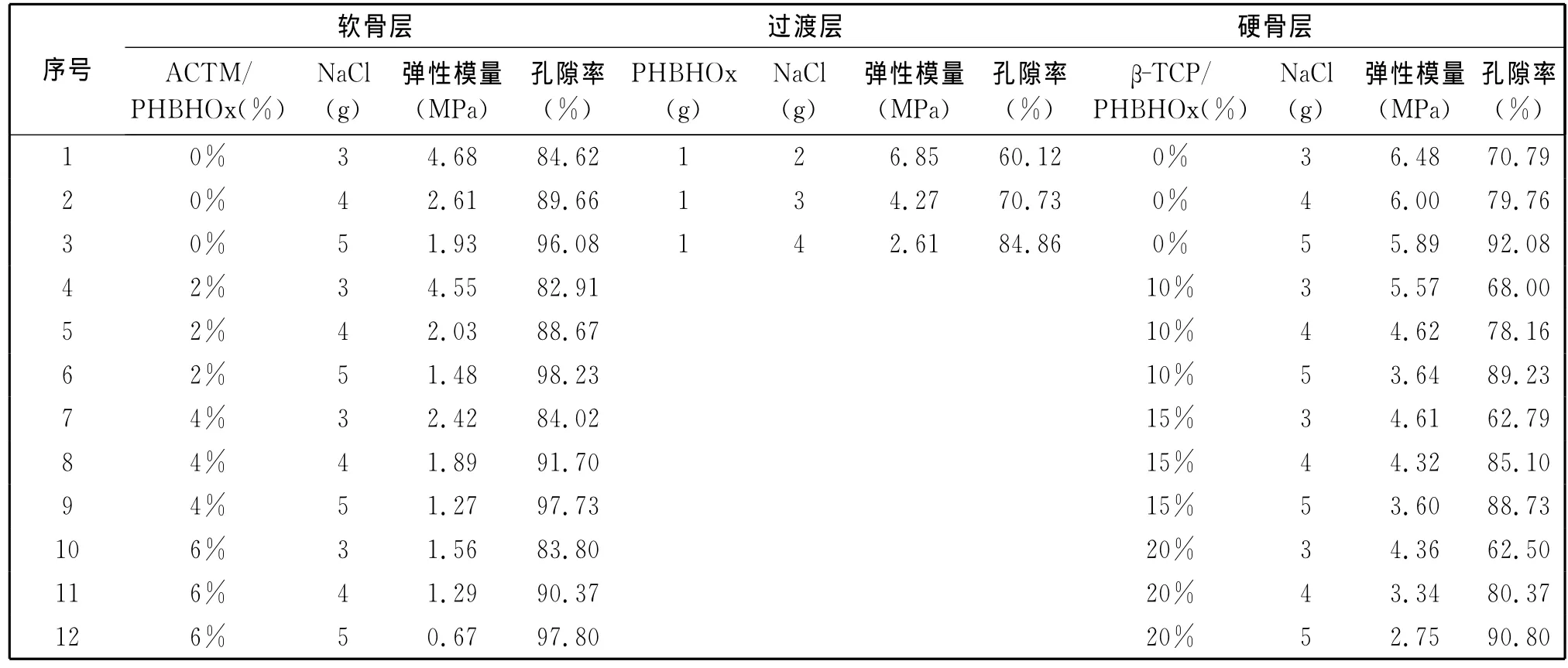
表1 软骨层、过渡层、硬骨层性能测定Table 1 Performance test of cartilage,interlayer and bone
按照各层支架优化后的技术参数制作一体化支架.一体支架的光学照片见图2a,圆柱状、白色、表面粗糙.支架分为三层,上层为软骨层,中间为过渡层,下层为硬骨层.由支架的横截面电镜照片(图2b)可以看出支架各层连接紧密,由图2c可以看出层内与层间孔道相通,连通性良好.由图2d、2e、2f电镜图可以看出支架的孔径大小与致孔剂的粒径大小有关,软骨部分孔径大小为(125±10)μm、过渡层孔径为(30±5)μm左右、硬骨部分孔径大小为(300±35)μm.

图2 支架宏观图及电镜图Fig.2 Microstructure and SEM of scaffold
从表2(P111)可以看出支架在1h时吸水率已经达到75%以上,5h时吸水率剧增达到200%以上.这说明支架的吸水率很好,为后期BMSC与支架的复合培养奠定了基础.

表2 一体化支架的吸水率Table 2 Water absorption of integrative scaffold
2.3 BMSC与关节一体化支架的复合培养
经全骨髓分离法提取得到BMSC,在首次换液后的第2天出现零星的贴壁细胞,见图3a.在第5天时,开始出现漩涡状的细胞群,见图3b.在第9天时,细胞增殖融合达到整个细胞瓶底的80%以上,见图3c.全骨髓分离法提取的细胞增殖能力强,在换液过程中逐渐去除不贴壁的杂细胞,得到纯BMSC.

图3 倒置显微镜下观察兔骨髓间充质干细胞(×100)Fig.3 Observation of rabbit bone marrow stromal cells under inverted microscope(×100)
将第二代BMSC与支架共培养10d后经MTT法检测得到的结果(表3).进行t检测统计分析.可见空白软骨、空白硬骨与对照组二者之间差异非常显著(P<0.01),说明支架适合细胞的生长.复合软骨与空白软骨二者之间差异显著(P<0.05),说明ACTM为细胞的生长提供了营养;复合硬骨与空白硬骨二者之间差异显著(P<0.05),说明添加了β-TCP后支架表面更加粗糙,有利于细胞的黏附.

表3 细胞在支架上的生长Table 3 Cell growth on the scaffold

图4 扫描电镜下观察兔骨髓间充质干细胞黏附在支架上Fig.4 Rabbit bone marrow stromal cells were attached to scaffold under SEM
扫描电镜观察表明,BMSC在支架的软骨层和硬骨层都可以完全黏附,而且细胞表面有分泌物的产生(图4a、4b),表明一体化支架无毒,且内部结构适宜细胞的生长.
3 讨论
关节骨软骨拥有复杂的解剖学结构,从软骨顶层到硬骨依次为软骨储备区、软骨增生区、软骨成熟区、软骨钙化区、成骨区,如果严格按照关节结构设计支架比较困难,因此在支架制备时设计了一个过渡层而代之.过渡层的致孔剂粒径≤38μm,获得的孔径约在30μm左右,可以阻止成骨细胞的迁移以及血管伸入软骨部分.将过渡层的孔隙率控制在70%以上,以便于营养物质和代谢废物的交换输送.
在软骨部分复合了ACTM,为BMSC的生长、增殖、分化提供了营养成分并促进软骨组织形成.硬骨部分复合了β-TCP,β-TCP有较强的力学强度,其表面部分遇水后会形成羟基磷灰石结晶,成为硬骨的主要无机成分,很好的仿生了骨的物质结构,也使支架表面更加粗糙有利于BMSC的黏附.
采用溶剂浇铸-粒子滤沥法,制备软骨层/过渡层/硬骨层三层一体化支架的过程中,以PHBHOx为连续相,建立了分步操作一次成型新工艺.
BMSC与支架复合培养试验结果表明支架不仅对细胞无毒性,而且为细胞生长提供了良好的生存环境.这一结果也说证实在支架制备过程中没有氯仿残留.
关节一体化组织工程支架的成功制作,仅为关节组织工程研究奠定了支架基础,接下来尚有一系列的研究工作有待进行,如生长因子的介入及体内外的细胞及组织培养、关节损伤修复的动物试验、临床试验等.
[1]Havla J B,Lotz A S,Richter,et al.Cartilage Tissue Engineering for Auricular Reconstruction:in Vitro Evaluation of Potential Genotoxic and Cytotoxic Effects of Scaffold Materials[J].Toxicol In Vitro,2010,24(3):849-853.
[2]Galois L,Freyria A M,Grossin L,et al.Cartilage Repair:Surgical Techniques and Tissue Engineering Using Polysaccharide and Collagen-based Biomaterials[J].Biorheology,2004,41(3):433-443.
[3]Boopalan P R,Sathishkumar S,Kumar S,et al.Rabbit Articular Cartilage Defects Treated by Allogenic Chondrocytetransplantation[J].Int Orthop,2006,30(5):357-361.
[4]Langer R,Vacanti J P.Tissue Engineering[J].Science,1993,260(5110):920-926.
[5]张婵,董岳峰,王海宾,等.费氏中华根瘤菌合成羟基丁酸和羟基己酸共聚体的研究[J].微生物学通报,2007,34(6):1077-1081.
[6]Mikos A G,Sarakinos G,Leite S M,et al.Laminated Three-dimensional Biodegradable Foams for Use in Tissue Engineering[J].Biomaterials,1993,14(5):323-330.
[7]Mikos A G,Thorsen A J,Czerwonka L A,et al.Preparation and Characterization of Poly(L-lactic acid)Foams[J].Polymer,1994,35(5):1068-1077.
[8]张晨,景士兵,杨琨,等.软骨脱细胞基质支架材料的软骨组织工程实验研究[J].中国修复重建外科杂志,2008,22(7):846-850.
[9]邹俊,狄东华,周海骏,等.聚-L-乳酸/β-磷酸三钙多孔支架材料的制备及性能研究[J].化工时刊,2006,20(11):1-4.
[10]黄家志,陈前芬,肖曾明,等.兔骨髓间充质干细胞的体外分离及鉴定[J].广西医学大学学报,2011,21(1):9-12.

