自体荧光内镜诊断消化道恶性肿瘤和癌前病变的临床初探*
戈之铮 龚 帅 萧树东 叶衍铭 郑家骠 夏敬芳
上海交通大学医学院附属仁济医院消化内科 上海市消化疾病研究所1(200001)上海盛荧光电科技有限公司2
据统计,胃癌、结直肠癌和食管癌分别居我国恶性肿瘤发病率的第二、三、五位,居病死率的第三、四、五位[1]。目前,上述几种消化道恶性肿瘤的诊断主要依靠内镜下活检结合组织病理学检查,因此内镜下发现病灶并准确进行活检是消化道恶性肿瘤早期诊断的关键。然而,随机活检存在诸多偶然性,对于部分早期恶性肿瘤易漏诊,对于部分进展期恶性肿瘤如印戒细胞癌等活检阳性率不理想。近年来,一些新型内镜技术不断应用于临床,除可指导靶向活检外,还能进行实时诊断,缩短活检后组织病理学检查的等待时间。自体荧光内镜应用于临床已十余年,但对其诊断消化道恶性肿瘤和癌前病变的价值仍存在较大争议。本研究采用自主研制的自体荧光内镜对确诊或疑似消化道恶性肿瘤患者或随访癌前病变患者的手术标本和在体受试者进行检查,并以组织病理学检查结果作为金标准,旨在探讨自体荧光内镜在消化道恶性肿瘤和癌前病变中的诊断价值。
对象与方法
一、研究对象
第一阶段:选取2010年6月~2011年12月于上海交通大学医学院附属仁济医院经内镜活检或影像学检查确诊或高度怀疑消化道恶性肿瘤而行手术治疗的患者。第二阶段:选取2012年1月~2013年3月该院收治的确诊或高度怀疑消化道恶性肿瘤患者和随访观察的消化道癌前病变患者。排除标准:①具有吞咽困难、精神症状等而不能配合检查者;②肝硬化、肾功能不全、急性消化道出血、凝血功能不全者;③妊娠期和哺乳期妇女;④拒绝签署知情同意书者。研究方案经上海交通大学医学院附属仁济医院医学伦理委员会批准,入组患者及其家属签属知情同意书。
二、主要仪器设备和原理
本研究采用自主研制的自体荧光内镜进行检查。该仪器主要由消化道电子内镜、双光照明光源、视频分离器、白光图像处理器、荧光图像处理器、图像压缩器、图像显示器等设备组合而成,工作原理见图1。在紫光照明的视频中通过通道“2”和“3”分别记录组织发出的红色、绿色荧光图像,然后经特殊图像处理方法得到各像点红、绿光比值(R/G),最后根据R/G值大小赋予不同颜色加以显示。正常或良性组织R/G值较低,在图像中呈现绿色;异型增生或癌组织R/G值高于正常或良性组织,在图像中呈现红色。
三、样本量估计
设定检验水准 α 为0.05,容许误差 δ为0.1。前期研究[2]显示自体荧光光谱诊断胃癌的敏感性和特异性分别为82.9%和91.5%。根据诊断试验样本量计算公式,第一阶段达到统计学意义的最小样本量应为肿瘤病灶54例,非肿瘤病灶30例。第二阶段根据第一阶段自体荧光内镜离体诊断的敏感性和特异性进行计算,得出最小样本量为肿瘤病灶18例,非肿瘤病灶20例。研究中选择患者自身癌旁正常组织作为对照。
四、研究方法
1.第一阶段:对纳入患者的离体手术标本行自体荧光内镜检查。新鲜手术切除标本去污后,取癌组织和癌旁正常组织(距病灶边缘≥5 cm)。将荧光内镜对准标本中需检测的部位,经钳道孔导入光纤,开启主机双光照明功能,内镜显示屏上同屏显示检测部位真彩色图像和激发光照明的荧光伪彩色图像。对检查中发现的病灶处异常荧光(红色)和周围正常组织正常荧光(绿色)区域标本行组织病理学检查。
2.第二阶段:对纳入患者行在体自体荧光内镜检查。首先在常规内镜下对食管至十二指肠降部进行检查,发现病灶后,对病灶和病灶周围正常组织(距病灶边缘≥5 cm)行自体荧光内镜检查。将荧光内镜在白光照明下插入患者体内,通过改变胃镜前端位置,使其对准需检测的部位,经钳道孔导入光纤,开启主机双光照明功能,观察显示屏上的真彩色图像和荧光伪彩色图像。在相应检测点取活检行组织病理学检查。
五、统计学分析
应用SPSS 18.0统计软件,采用四格表分析计算自体荧光内镜离体和在体诊断的准确性、敏感性、特异性、阳性预测值(PPV)和阴性预测值(NPV),计算95%CI。率和构成比的比较采用χ2检验。自体荧光内镜与组织病理学诊断一致性的分析采用κ检验,κ≥0.75表示一致性较高,0.4<κ<0.75表示一致性一般,κ≤0.4表示一致性较低。P<0.05为差异有统计学意义。
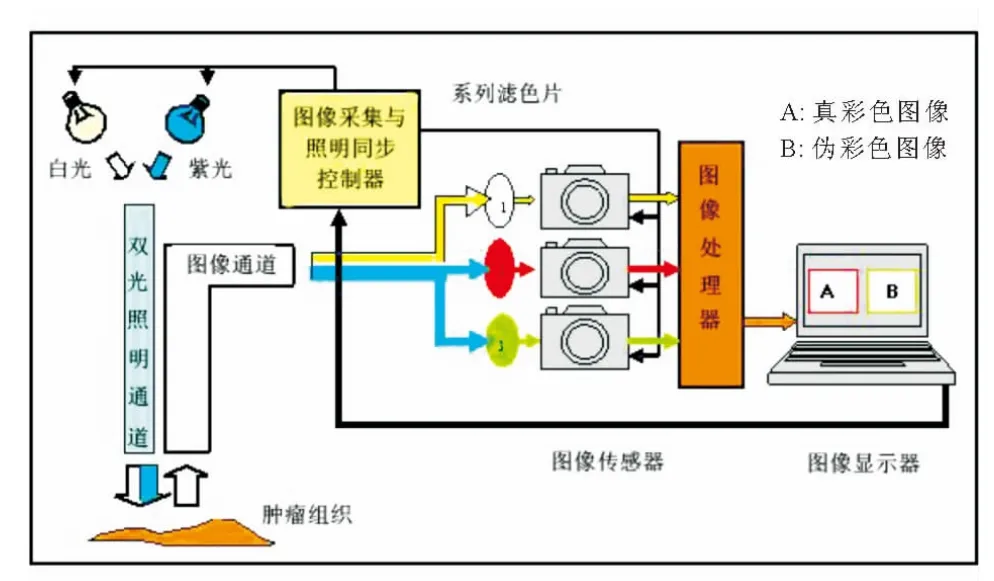
图1 自体荧光内镜工作原理示意图
结 果
一、一般资料
第一阶段共纳入患者170例,其中男103例,女67例,年龄21~86岁;病灶位于食管20例,胃107例,结直肠43例。第二阶段共纳入患者30例,其中男25例,女5例,年龄41~84岁;病灶位于食管1例,胃29例。
二、组织病理学诊断
第一阶段患者标本中,肿瘤或癌前病变159例(腺癌99例,印戒细胞癌36例,恶性间质瘤4例,鳞癌17例,神经内分泌癌1例,轻度异型增生1例,重度异型增生1例),其中癌前病变和早期癌17例,进展期癌142例;腺癌和印戒细胞癌中,分化型癌97例,未分化型癌38例。良性病灶11例,其中消化道溃疡4例,萎缩性胃炎5例,食管糜烂1例,横结肠腺瘤性息肉1例。170例癌旁正常组织均无异常表现。
第二阶段患者标本中,肿瘤或癌前病变26例(腺癌18例,印戒细胞癌4例,鳞癌1例,淋巴瘤1例,轻度异型增生2例);腺癌和印戒细胞癌中,分化型癌17例,未分化型癌5例。良性病灶4例,均为慢性炎症。30例癌旁正常组织均无异常表现。
三、自体荧光内镜诊断
两阶段分别获得340、60幅自体荧光内镜检查图像,其中病灶组织200幅,癌旁正常组织200幅。第一阶段159例肿瘤或癌前病变标本中,151例呈异型增生或癌组织特征图像(红色),8例未检出(腺癌2例,印戒细胞癌5例,鳞癌1例),呈正常或良性组织特征图像(绿色);11例良性病灶标本中,9例呈绿色图像,2例呈红色图像;170例癌旁正常组织标本中,8例呈红色图像,162例呈绿色图像。第二阶段26例肿瘤或癌前病变标本中,24例呈红色图像,2例未检出(腺癌1例,印戒细胞癌1例),呈绿色图像;4例良性病灶标本中,1例呈绿色图像,3例呈红色图像;30例癌旁正常组织标本中,1例呈红色图像,29例呈绿色图像。图像观察发现癌组织荧光强弱与肿瘤分化程度密切相关,分化程度越高,荧光越强,图像中红伪颜色越深;分化程度越低,荧光越弱,图像中红伪颜色越浅,甚至检测不出(见图2、图3)。
自体荧光内镜离体和在体诊断消化道恶性肿瘤和癌前病变的准确性、敏感性、特异性、PPV和NPV见表1,两种方法上述指标差异均无统计学意义(P>0.05)。将两组数据综合,结果显示自体荧光内镜诊断消化道恶性肿瘤和癌前病变的总体准确性、敏感性、特异性、PPV和NPV分别为94.0%(95%CI:92.0% ~ 96.6%)、94.6%(95%CI:90.0% ~ 97.2%)、93.5%(95% CI:89.1% ~96.3%)、92.6%(95%CI:87.6% ~ 95.7%)和95.3%(95%CI:91.2% ~97.6%)。自体荧光内镜与组织病理学诊断结果一致性较高,κ=0.880(95%CI:0.829 ~0.925),其中离体诊断 κ =0.894(95%CI:0.845 ~ 0.941),在体诊断 κ =0.798(95%CI:0.615 ~0.933)。
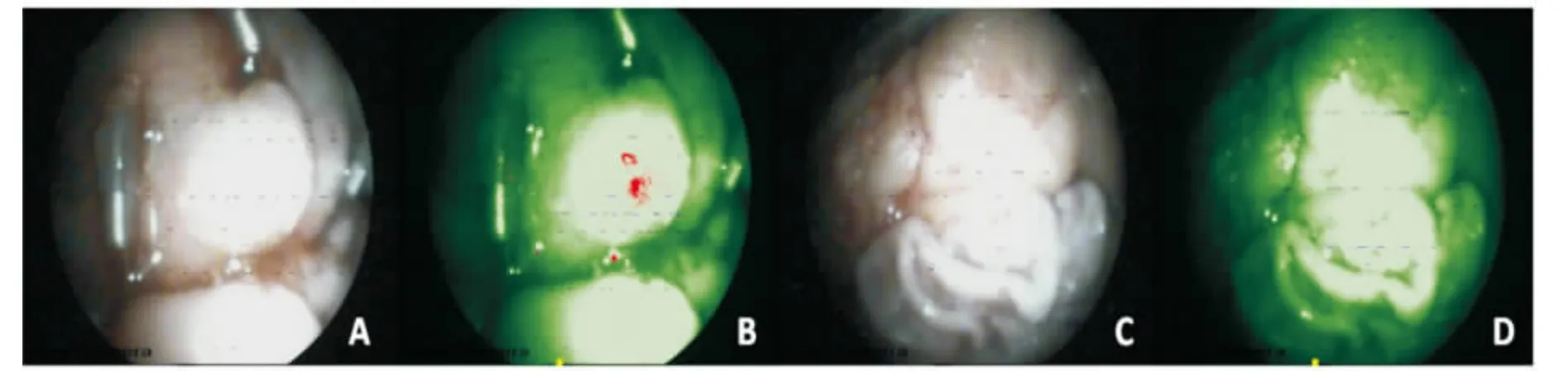
图2 胃体印戒细胞癌组织(低分化)和癌旁正常组织自体荧光内镜检查图像
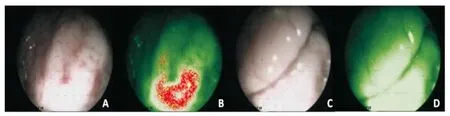
图3 胃体腺癌组织(高分化)和癌旁正常组织自体荧光内镜检查图像
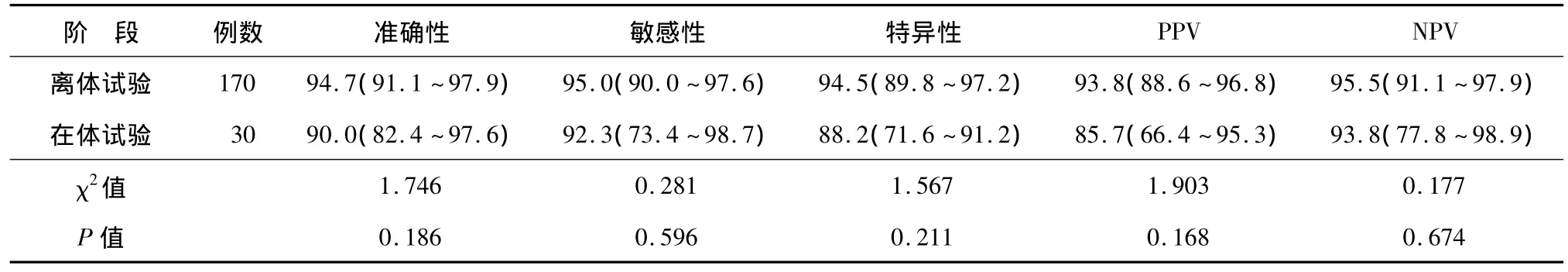
表1 离体和在体自体荧光内镜检查对消化道恶性肿瘤和癌前病变诊断价值的比较%(95%CI)
自体荧光内镜离体诊断对癌前病变和早期癌的检出率为88.2%(15/17),进展期癌为 95.8%(136/142),两者差异无统计学意义(χ2=1.395,P=0.238);对分化型癌的检出率为97.9%(95/97),未分化型癌为86.8%(33/38),两者差异显著(χ2=6.838,P=0.009)。自体荧光内镜在体诊断对分化型癌的检出率为94.1%(16/17),未分化型癌为80.0%(4/5),两者差异无统计学意义(χ2=0.794,P=0.373)。
讨 论
人体组织表面经紫外光或短波长光(400~500 nm)照射后,组织中的原子或分子由激发态跃迁返回至基态时会发出较激发光波长更长的荧光,称为自体荧光[3]。人体内自体荧光物质主要有胶原、弹性蛋白、色氨酸、烟酰胺腺嘌呤二核苷酸、黄素腺嘌呤二核苷酸、血卟啉衍生物等[4]。不同组织的荧光物质组成成分和形态结构不同,因而具有独特的光学特性和光谱特征。胃肠道由于黏膜层次复杂,不同荧光基团分布广泛,自体荧光光谱交错重叠,分类检测较为困难[5]。然而,正常组织与肿瘤组织的自体荧光波长在510 nm和630 nm处有明显差异[6]。根据不同组织的荧光光谱发射特征来区分组织类型,是自体荧光内镜诊断消化道恶性肿瘤的理论基础。
消化道恶性肿瘤和癌前病变的确诊主要依靠消化内镜下观察以及活检结合组织病理学检查。消化道早期和进展期恶性肿瘤预后完全不同,早期胃癌5年生存率>90%[7],而晚期胃癌5年生存率仅为10% ~20%[8]。因此,国内外学者不断将诸如窄带成像、共聚焦激光成像、自体荧光光谱等新技术引入消化内镜诊断学,以期提高消化道早期癌的诊断率。目前,国外已有三家公司将荧光内镜商业化,包括加拿大Xillix公司的LIFE-GI、德国Storz公司的D-Light和日本Olympus公司的AFI等系统。本研究所采用的自主研制的自体荧光内镜采用针对性强的单一波长激光作为激发光源,以双特征荧光比值成像技术捕捉荧光图像,对生物组织自体荧光强度和色彩的分辨率显著优于上述几种荧光内镜。癌变组织与正常组织自体荧光强度和色彩的微小差异在传统光学成像系统中很难分辨,且内镜在体内检查过程中很难与检测部位保持固定距离,而通过内镜传输的入射激发光的能量却与其距离的平方成反比,在不同位置检测时入射激发光的能量波动很大,从而使检测到的荧光强弱有很大变化。利用异型增生或癌组织红色荧光与正常或良性组织绿色荧光的相对比例因子不变的特点,采用双特征荧光比值成像技术将上述微小差异以不同伪彩色表示,这些差异将更易被稳定识别。另一方面,该荧光内镜采用单一图像传感器,以25帧/s的近乎动态速度扫描观察部位,一旦荧光伪彩色图像中出现红色像点,即可对当前位置进行定格,根据定格后的图像可实时分析癌变病灶和癌旁组织特征。本研究通过离体和在体检测,探讨自体荧光内镜诊断消化道恶性肿瘤和癌前病变的价值,结果显示自体荧光内镜诊断的总体准确性、敏感性和特异性高达 94.0%、94.6%和 93.5%,与 Kobayashi等[9]的研究结果相似,且诊断特异性略高(93.5%对86.0%)。离体诊断的各项评价指标虽高于在体诊断,但两者差异无统计学意义,可能与在体组织中黏液和其他杂质对荧光激发产生不良影响有关。癌前病变和早期癌与进展期癌的检出率亦无统计学差异,可能与前者样本量较少有关,尚需扩大样本量进一步验证。
本研究发现分化型癌的红伪颜色较未分化型癌深,与分化型癌的检出率高于未分化型癌相符。Abe等[10]采用自体荧光内镜成像系统 LIFE-GI对61例胃癌手术标本的429处部位进行分析,结果表明荧光内镜的胃癌检出率与肿瘤浸润深度和黏膜增厚程度呈正比,对分化型胃癌诊断率较高,但不适用于诊断黏膜增厚不明显且呈弥漫性浸润的未分化型胃癌,此结论与本研究结果一致。分析认为,其原因可能是未分化型癌细胞分化能力差、体积小、几乎不形成腺体结构,印戒细胞癌等黏液腺癌的细胞质内充满大量黏液,上述因素可能对自体荧光产生不良影响。此外,未分化型癌中微血管数量减少,肿瘤组织中最常见的荧光基团血卟啉的主要载体血红蛋白含量相应减少,导致自体荧光内镜检查产生假阴性结果。
本研究中两个阶段的试验均证实自体荧光内镜具有较高的敏感性,但其易受体内正常组织自身杂散光干扰,强杂散光会降低系统测量的信噪比,甚至发生测量结果失误,导致系统采集的荧光图像颜色偏差,最终造成图像数据处理结果失实,产生假阳性、假阴性结果。
本研究尚存在一定缺陷,第一阶段癌前病变和早期癌样本量较少,导致进展期癌比例偏高,对两者检出率的差异产生影响;第二阶段在体研究病例数虽达到最小样本量要求,但对于新研制的自体荧光内镜的临床验证显然不足;两阶段均包含诊断明确的病例,对最终研究结果可能产生部分偏倚。此外,自体荧光内镜的图像质量和抗干扰性能仍有待进一步提高。因此,未来需开展更多研究以探讨自体荧光内镜对不同病理类型、分期、部位消化道肿瘤的检出率,尤其是大规模多中心、随机、对照研究。
综上所述,本研究证实采用自主研制的自体荧光内镜通过伪彩色荧光成像能够准确、客观地反映消化道恶性肿瘤和癌前病变与正常组织的差异,且较少依赖内镜医师的经验,具有较高的诊断价值,同时亦可用于估计病变范围和指导靶向活检,有望成为诊断早期消化道恶性肿瘤的重要手段。
1 郝杰,陈万青主编.2012中国肿瘤登记年报[M].北京:军事医学科学出版社,2012:26-37.
2 萧树东,戈之铮,钟喨,等.胃癌的自体荧光光谱诊断[J].胃肠病学,2002,7(1):21-23,41.
3 Haringsma J,Tytgat GN.Fluorescence and autofluorescence[J].Baillieres Best Pract Res Clin Gastroenterol,1999,13(1):1-10.
4 Monici M.Cell and tissue autofluorescence research and diagnostic applications[J].Biotechnol Annu Rev,2005,11:227-256.
5 Wagnières GA,Star WM,Wilson BC.In vivo fluorescence spectroscopy and imaging for oncological applications[J].Photochem Photobiol,1998,68(5):603-632.
6 Dacosta RS,Wilson BC,Marcon NE.New optical technologies for earlier endoscopic diagnosis of premalignant gastrointestinal lesions[J].J Gastroenterol Hepatol,2002,17 Suppl:S85-S104.
7 Kikuchi S,Katada N,Sakuramoto S,et al.Survival after surgicaltreatmentof early gastric cancer:surgical techniques and long-term survival[J].Langenbecks Arch Surg,2004,389(2):69-74.
8 秦叔逵,龚新雷.晚期胃癌化疗的现状和新进展[J].临床肿瘤学杂志,2006,11(9):641-652.
9 Kobayashi M,Tajiri H,Seike E,et al.Detection of early gastric cancer by a real-time autofluorescence imaging system[J].Cancer Lett,2001,165(2):155-159.
10 Abe S,Izuishi K,Tajiri H,et al.Correlation of in vitro autofluorescence endoscopyimageswith histopathologic findings in stomach cancer[J].Endoscopy,2000,32(4):281-286.

