MT2-MMP基因沉默对缺氧条件下培养的胰腺癌AsPC-1细胞增殖、凋亡及侵袭力的影响
朱世凯 周玉 范平 王博 吴汉青 杨洪吉 熊炯炘 吴河水
·论著·
MT2-MMP基因沉默对缺氧条件下培养的胰腺癌AsPC-1细胞增殖、凋亡及侵袭力的影响
朱世凯 周玉 范平 王博 吴汉青 杨洪吉 熊炯炘 吴河水
目的利用特异性siRNA沉默人胰腺癌AsPC-1细胞的膜型金属蛋白酶2(MT2-MMP)基因表达,观察其对缺氧条件下培养的细胞增殖、凋亡和侵袭力的影响。方法采用脂质体转染法将插入MT2-MMP特异性siRNA的真核表达质粒转染至人胰腺癌AsPC-1细胞株(siRNA组),以转染过表达MT2-MMP质粒(过表达组)或阴性对照质粒(空载体组)的AsPC-1作为对照。实时定量PCR法和蛋白质印迹法检测转染细胞的MT2-MMP mRNA和蛋白的表达。在缺氧条件(37℃、1% O2、5% CO2、饱和湿度的三气培养箱)下培养后,应用CCK-8法检测转染细胞的增殖,流式细胞仪检测细胞的凋亡,Transwells小室检测细胞的侵袭能力。结果成功获取MT2-MMP基因沉默的AsPC-1细胞株和过表达的细胞株。缺氧条件下培养24 h后,空载体组、过表达组、siRNA组细胞增殖的吸光度值(A490值)分别为0.68±0.08、0.80±0.08、0.52±0.07;细胞凋亡率分别为(6.2±1.5)%、(2.8±1.1)%、(21.4±3.9)%;每个视野(200倍)的穿膜细胞数分别为(115.8±23.2)、(256.4±38.6)、(45.8±18.2)个。siRNA组较空载体组的细胞增殖显著被抑制,穿膜细胞数显著减少,而细胞凋亡率显著增加(P值均<0.05)。过表达组较 空载体组的细胞增殖显著增强,穿膜细胞数显著增加,而细胞凋亡率显著降低(P值均<0.05)。结论MT2-MMP基因沉默的AsPC-1细胞在缺氧条件下培养后细胞凋亡增加,增殖被抑制,侵袭力减弱。
胰腺肿瘤; 基质金属蛋白酶类; RNA,小分子干扰; 缺氧; 细胞凋亡; 肿瘤浸润
细胞外基质(extracelluar matrix,ECM)的降解是肿瘤发生侵袭和转移的最为关键的环节。基质金属蛋白酶(matrix metalloproteinases,MMPs)是人体内降解ECM的主要酶类。近来研究发现膜型基质金属蛋白酶(membrane type matrix metalloproteinase), MT-MMP)是MMPs家族中新近发现的一个跨膜蛋白,有MT1-MMP、MT2-MMP、MT3-MMP、MT4-MMP4个成员。能够直接作用于多种细胞外基质成分和细胞黏附分子,在多种恶性肿瘤组织中高表达,与恶性肿瘤的侵袭和转移密切相关[1-2]。目前研究发现,缺氧微环境的适应和细胞外基质降解在肿瘤早期发展过程中起着关键作用,且二者间存在着多种联系[3-4]。本研究通过沉默人胰腺癌AsPC-1细胞MT2-MMP的表达,探讨其对缺氧条件下胰腺癌细胞增殖、凋亡和侵袭作用的影响。
材料和方法
一、材料与试剂
人胰腺癌AsPC-1细胞株购自中国科学院上海细胞所;插入靶向MT2-MMP的siRNA的真核表达质粒pSilencer-MT2-MMP、过表达MT2-MMP的真核表达质粒pcDNA3.1/His-MT2-MMP和含阴性对照siRNA的质粒pSilencer-Control均由上海吉凯公司构建并测序鉴定;LipofectamineTM2000购自美国Invitrogen公司;胎牛血清(FBS)和DMEM购自美国Gibco公司;鼠抗人MT2-MMP单抗购自美国Abcam公司;HRP标记的羊抗小鼠二抗购自武汉博士德生物公司;CCK-8试剂购自美国sigma公司;细胞凋亡检测试剂盒购自南京凯基生物公司;Matrigel胶购自美国BD公司;Transwell小室(8 μm)购自美国Costar公司;BCA蛋白定量试剂盒和ECL化学发光试剂盒购自美国Pierce公司;蛋白预染Marker购自美国Fermentas公司;其余试剂均为分析纯。
二、方法
1.细胞培养与转染:AsPC-1细胞常规培养,取对数生长期细胞2.5×105个接种于35 mm培养皿中,置无抗生素的含有10% FBS的DMEM中培养,待细胞生长至80%融合时,采用LipofectamineTM2000将3种质粒分别转染细胞,命名为空载体组(转染pSilencer-Control)、过表达组(转染pcDNA3.1/His-MT2-MMP)和siRNA 组(转染pSilencer-MT2-MMP)。转染后24 h按1∶9的比例传代,48 h后开始用含500 μg/ml G-418的选择性培养液进行筛选,2~3周后克隆形成。以克隆环挑取细胞克隆转移至6 孔板扩大培养、传代,最后转入60 ml培养瓶继续培养。
2.MT2-MMP mRNA表达检测:提取各组细胞总RNA,取1 μg逆转录得到cDNA。MT2-MMP上游引物5′-CTGCGGCTTTATGGCTACCT-3′,下游引物5′-CTCATAGGGCACCTCCTGGAA-3′,扩增产物387 bp;内参β-actin上游引物5′-GTCCACCGCAAATGCTTCTA-3′,下游引物5′-TGCTGTCACCTTCACCGTTC-3′,扩增产物190 bp。引物由上海英俊公司合成。应用SYBR Green Ⅰ荧光染料技术行实时定量PCR,扩增条件:94℃ 4 min,94℃ 30 s、51℃ 30 s、72℃ 30 s,共40个循环,获取各组标本的标准曲线,采用计算机分析Ct值,采用2-△△Ct公式计算mRNA表达量。
3.MT2-MMP蛋白表达检测:提取各组细胞总蛋白,常规行蛋白质印迹法检测MT2-MMP 蛋白的表达,以β-actin为内参。兔抗人MT2-MMP单抗1∶1000稀释,最后加入ECL发光。采用电泳凝胶成像分析软件扫描,以目的条带与内参条带灰度比值代表蛋白表达量。
4.细胞增殖能力检测:取各组对数生长期细胞,用0.25% Trypsin消化成单细胞悬液,取100 μl接种于96孔板,每孔1×104个细胞,加入100 μl含10%FBS的高糖DMEM,置37℃、1% O2、5% CO2、饱和湿度的三气培养箱中孵育12、24、36、72 h,各孔内加入10 μl的CCK-8溶液,继续孵育4 h,测各孔在450 nm波长的吸光度值(A450值)。每组设3个复孔,取均值,绘制细胞生长曲线。
5.细胞凋亡检测:取各组对数生长期细胞接种于6孔板,置37℃、1% O2、5% CO2、饱和湿度的三气培养箱中孵育24 h,收集细胞,用4℃预冷的1×PBS洗涤细胞2次,取5~10万个细胞,加入195 μl Annexin V-FITC结合液轻轻重悬细胞,再加入5 μl Annexin V-FITC轻轻混匀,室温(20~25℃)避光孵育10 min,离心弃上清。加入190 μl Annexin V-FITC结合液(1×)轻轻重悬细胞,加入10 μl碘化丙啶染色液混匀,冰浴避光放置,随即上流式细胞仪检测。
6.体外细胞侵袭力检测:用Matrigel包被Transwell小室底部膜的上室面后,上室加入100 μl用无血清培养液培养12 h的细胞(1×104个),下室加入500 μl含10% FBS的DMEM,置37℃、1% O2、5% CO2、饱和湿度的三气培养箱中孵育24 h。取出Transwell小室,用棉签擦去上室内未穿膜的细胞,用甲醛固定穿膜细胞,0.1%结晶紫染色,显微镜下随机选取8个视野计数穿膜细胞数,取均值。
三、统计学处理
结 果
一、各组转染细胞MT2-MMP基因的表达
空载体组、过表达组、siRNA组AsPC-1细胞的MT2-MMP mRNA表达水平分别为0.30±0.11、0.72±0.16、0.10±0.04;蛋白表达量分别为0.32±0.10、0.74±0.15、0.12±0.05(图1)。过表达组细胞MT2-MMP mRNA及蛋白的表达量均显著高于空载体组(t值分别为4.867、 5.167,P值均=0.001),而siRNA组的表达量较空载体组显著下降(t值分别为3.918、4.069,P值均=0.004)。

图1空载体组、过表达组、siRNA组AsPC-1细胞MT2-MMP蛋白表达
二、缺氧条件培养下AsPC-1细胞增殖的变化
在缺氧条件培养下,空载体组细胞随培养时间的延长而稳定增殖;过表达组细胞的增殖较空载体组显著增加,24、36、72 h时的差异有统计学意义(t值分别为2.42、4.30、4.16,P值<0.05或<0.01);siRNA组细胞的增殖较空载体组显著减少,24、36、72 h时的差异有统计学意义(t值分别为3.381、7.936、13.643,P值均<0.01,表1,图2)。

表1 缺氧条件下3组AsPC-1细胞的A450值
注:与空载体组比较,aP<0.05;bP<0.01

图2 缺氧条件下3组AsPC-1细胞的生长曲线
三、缺氧条件培养下AsPC-1细胞凋亡的变化
在缺氧条件下培养24 h,空载体组、过表达组、siRNA组细胞的凋亡率分别为(6.2±1.5)%、(2.8±1.1)%、(21.4±3.9)%。过表达组细胞的凋亡率较空载体组显著下降(t=4.018,P=0.003),而siRNA组细胞的凋亡率较空载体组显著增加(t=8.077,P<0.01,图3)。

图3缺氧条件下培养24 h后空载体组、过表达组、siRNA组的凋亡细胞 (流式细胞法)
四、缺氧条件培养下AsPC-1细胞侵袭力的变化
在缺氧条件下培养24 h,空载体组、过表达组、siRNA组每个视野的穿膜细胞数分别为(115.8±23.2)、(256.4±38.6)、(45.8±18.2)个。过表达组的穿膜细胞数较空载体组显著增加(t=7.181,P<0.01),而siRNA组的穿膜细胞数较空载体组显著减少(t=5.979,P<0.01,图4)。
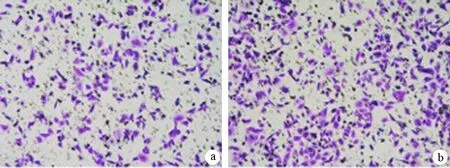

图4缺氧条件下培养24 h后空载体组(a)、过表达组(b)、siRNA组(c)的穿膜细胞(×200)
讨 论
恶性肿瘤的侵袭和转移是一个复杂、多步骤的过程。ECM的降解是肿瘤细胞突破基质屏障向周围组织浸润及远处转移的基础,与恶性肿瘤的生长、侵袭和转移密切相关[1]。金属蛋白酶-2(MMP-2)是降解ECM主要组分的关键酶之一,其激活取决于膜型基质金属蛋白酶(MT-MMP)与MMP抑制剂(tissue inhibitor of metalloproteinases, TIMP)间的平衡[5-6]。MT2-MMP高表达于多种人类恶性肿瘤组织,如胰腺癌、结肠癌和胶质母细胞瘤等,定位于癌细胞的表面,直接或间接激活MMPs降解ECM,还参与对多种细胞信号通路的调控,在肿瘤细胞增殖、凋亡、血管生成以及肿瘤侵袭和转移等过程中起着重要的作用[7-11]。Ellenrieder等[8]研究发现,MT2-MMP能够直接激活MMP-2,参与胰腺癌发生和恶性进展的过程。
缺氧微环境是存在人类实体瘤内部的一种较为普遍的现象。为了自身克服和适应缺氧微环境,肿瘤细胞会发生一系列适应性改变,包括调控大量涉及与肿瘤细胞增殖与凋亡、新生血管形成、能量与物质代谢以及肿瘤侵袭和转移等重要过程中关键基因的表达[12]。研究发现,缺氧同样也可调控多种MMPs家族成员的基因表达,参与肿瘤的侵袭与转移。本研究结果显示,MT2-MMP表达沉默的AsPC-1细胞在缺氧条件下培养后其凋亡增加,增殖被抑制,且细胞的侵袭力也被抑制;相反,MT2-MMP过表达的AsPC-1细胞的增殖与侵袭力显著增强,说明MT2-MMP是一种与胰腺癌发生、发展过程密切相关的癌基因,这为胰腺癌的基因治疗提供了一个新的切入点。
[1] Belkin AM, Akimov SS, Zaritskaya LS, et al. Matrix-dependent proteolysis of surface transglutaminase by membrane-type metalloproteinase regulates cancer cell adhesion and locomotion. J Biol Chem, 2001, 276:18415-18422.
[2] Hotary K, Allen E, Punturieri A, et al. Regulation of cell invasion and morphogenesis in a three-dimensional type I collagen matrix by membrane-type matrix metalloproteinases 1, 2, and 3. J Cell Biol, 2000, 149:1309-1323.
[3] Petrella BL, Brinckerhoff CE. Tumor cell invasion of von Hippel Lindau renal cell carcinoma cells is mediated by membrane type-1 matrix metalloproteinase. Mol Cancer, 2006, 5:66.
[4] Huang CH, Yang WH, Chang SY, et al. Regulation of membrane-type 4 matrix metalloproteinase by SLUG contributes to hypoxia-mediated metastasis. Neoplasia, 2009, 11:1371-1382.
[5] Peyri N, Berard M, Fauvel-Lafeve F, et al. Breast tumor cells transendothelial migration induces endothelial cell anoikis through extracellular matrix degradation. Anticancer Res, 2009, 29:2347-2355.
[6] Zucker S, Vacirca J. Role of matrix metalloproteinases (MMPs) in colorectal cancer. Cancer Metastasis Rev, 2004, 23:101-117.
[7] Sounni NE, Noel A. Membrane type-matrix metalloproteinases and tumor progression. Biochimie, 2005, 87:329-342.
[8] Ellenrieder V, Alber B, Lacher U, et al. Role of MT-MMPs and MMP-2 in pancreatic cancer progression. Int J Cancer, 2000, 85:14-20.
[9] Zhang J, Sarkar S, Yong VW. The chemokine stromal cell derived factor-1(CXCL12) promotes glioma invasiveness through MT2-matrix metalloproteinase. Carcinogenesis, 2005, 26:2069-2077.
[10] Curran S, Dundas SR, Buxton J, et al. Matrix metalloproteinase/tissue inhibitors of matrix metalloproteinase phenotype identifies poor prognosis colorectal cancers. Clin Cancer Res, 2004, 10:8229-8234.
[11] Van Meter TE, Broaddus WC, Rooprai HK, et al. Induction of membrane-type-1 matrix metalloproteinase by epidermal growth factor-mediated signaling in gliomas. Neuro Oncol, 2004, 6:188-199.
[12] Duffy JP, Eibl G, Reber HA, et al. Influence of hypoxia and neoangiogenesis on the growth of pancreatic cancer. Mol Cancer, 2003, 2:12.
EffectsofMT2-MMPsilencingontheproliferation,apoptosisandinvasionofpancreaticcancercellAsPC-1underhypoxiaculture
ZHUShi-kai,ZHOUYu,FANPing,WANGBo,WUHan-qing,YANGHong-ji,XIONGJiong-xin,WUHe-shui.
CenterofOrganTransplantation&HepatobiliaryandPancreaticSurgery,SichuanAcademyofMedicalSciences&SichuanProvincialPeople′sHospital,Chengdu610072,China
ZHUShi-kai,Email:zhushikai37@163.com
ObjectiveTo investigate the effects of MT2-MMP silencing by specific siRNA on pancreatic cancer cell AsPC-1 proliferation, apoptosis and invasion under hypoxia culture.MethodsMT2-MMP siRNA plasmids were stably transfected into AsPC-1 cells (siRNA group) by liposome transfection method, AsPC-1 cells tranfected with and over-expressed MT2-MMP siRNA plasmids (over-expression group) and negative control plasmid (empty vector group) were treated as control. Real-time RT-PCR and Western Blot assay were used to detect the expression of MT2-MMP mRNA and protein. Under culture with hypoxia (37℃, 1% O2, 5% CO2, three gas saturated humidity incubator), CCK-8, flow cytometry (FCM) and Transwell assays were applied to measure pancreatic cancer cell proliferation, apoptosis, and invasion.ResultsMT2-MMP silencing AsPC-1 and over-expressed AsPC-1 were successfully established. After culture with hypoxia for 24 h, the absorbance values (A490) in empty vector group, over-expression group and siRNA group were 0.68±0.08, 0.80±0.08, 0.52±0.07; the apoptotic rates were (6.2±1.5)%, (2.8±1.1)%, (21.4±3.9)%, and the numbers of invasion cells in each field (200 times) were (115.8±23.2), (256.4±38.6), (45.8±18.2). The proliferation in MT2-MMP siRNA group was significantly inhibited, the numbers of invasion cells was significantly decreased, but the apoptotic rates were obviously increased when compared with those in empty vector group (P<0.05). The proliferation in over-expression group was significantly enhanced, the numbers of invasion cells was significantly increased, but the apoptotic rates were obviously decreased when compared with those in empty vector group (P<0.05).ConclusionsAsPC-1 with MT2-MMP silencing could inhibit pancreatic cancer cells proliferation, induce cells apoptosis and attenuate tumor invasion under hypoxia culture.
Pancreatic neoplasms; Matrix metalloproteinases; siRNA; Anoxia; Apoptosis; Neoplasm invasiveness
2013-06-21)
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2013.06.005
610072 成都,四川省医学科学院 四川省人民医院器官移植中心肝胆胰外科(朱世凯、周玉、杨洪吉);华中科技大学同济医学院附属协和医院胰腺疾病研究所(范平、王博、吴汉青、熊炯炘、吴河水)
朱世凯,Email:zhushikai37@163.com
——一道江苏高考题的奥秘解读和拓展

