肝门部胆管癌预后因素分析
董海峰,董 星,梁马可,李仁锋,翟文龙,赵龙栓
(郑州大学第一附属医院肝胆胰外科,河南郑州450052)
肝门部胆管癌发病率近年来呈上升趋势,由于其特殊的解剖位置、毗邻关系及早期侵犯周围血管、神经、淋巴组织和邻近肝组织的生物学特性,肝门部胆管癌具有手术切除率、长期生存率低及术后肿瘤复发率高的特点,使得肝门部胆管癌的诊断和治疗成为外科难点之一。随着影像学检查方法及手术技能的进步,使肝门部胆管癌的手术切除率不断提高。本研究对2006年1月至2012年10月郑州大学第一附属医院肝胆外科收治的病历资料完整的65例肝门部胆管癌患者的临床资料进行回顾性分析,以探讨影响肝门部胆管癌预后的相关因素。
1 资料与方法
1.1 一般资料 65例肝门部胆管癌患者,男39例,女26例,男女比例 1.5∶1,年龄 34~79岁,平均年龄(60.2 ±10.1)岁。其中42 例(64.6%)患者表现为进行性皮肤、巩膜黄染伴不同程度纳差、消瘦、乏力;10例(15.4%)伴皮肤瘙痒;31例(47.7%)伴右上腹胀痛不适;3例(4.6%)伴有发热等胆道感染症状。病程1~15周不等。
1.2 试验室及影像学检查 术前总胆红素11.8~704.4 μmol·L-1,平均 231.0 μmol·L-1;γ-GT、ALP明显升高,ALT、AST均有不同程度的升高;血清CEA均正常,有45例(83.3%)患者血清CA19-9高于正常参考范围,平均值为393.8 u·L-1;B 超、CT、MRCP 检查确诊率分别为 84.6%(55/65)、90.7%(39/43)、94.7%(18/19)。
1.3 肿瘤临床分型、分期及病理 通过影像学资料及手术情况分析,按Bismuth-Corlette分型标准,本组Ⅰ型8例,Ⅱ型20例,Ⅲ型12例,Ⅳ型25例;按美国抗癌协会TNM分期法,Ⅰ、Ⅱ期11例,Ⅲ期15例,Ⅳa期27例,Ⅳb期12例;病理组织类型为高分化腺癌12例,中分化腺癌27例,低分化腺癌26例。
1.4 治疗方法 行手术切除者25例,手术切除率38.5%;非切除性手术40例,包括胆肠内引流术及单纯外引流术37例,剖腹探查并活检术3例。手术切除者中,根治性切除17例(26.2%),姑息性切除8例(12.3%)。手术切除方式主要为肿瘤的局部切除和联合肝叶切除2种,并常规行肝十二指肠韧带骨骼化。
1.5 观察因素及指标 观察性别、年龄、术前白蛋白水平、术前总胆红素水平、血清CA19-9水平、Bismuth-Corlette分型、手术方式、病理组织分化程度、淋巴结转移情况、周围血管浸润情况和TNM分期等11个因素。
1.6 随访情况 2012年11月对65例患者统一进行电话随访,失访11人,随访率83.1%。生存时间以手术日起至末次随访时间为准。
1.7 统计学处理 采用SPSS 13.0进行数据分析,用Kaplan-Meirer法进行生存率估计。累积生存率的比较用Log rank检验。对影响预后的指标进行单因素COX风险比例模型分析,将单因素分析有统计学意义的指标引入多因素COX风险比例模型进行统计学分析。检验水准α=0.05。
2 结果
2.1 手术方式与预后 不同手术方式术后1 a、2 a生存率及中位生存期差异有统计学意义(P<0.05)。根治性切除组、姑息性切除组、内引流组、外引流组、剖腹探查组中位生存期分别为14、10、7、5和2个月(表1)。
2.2 肿瘤情况与预后 比较Bismuth-Corlette分型、不同病理组织分化程度、淋巴结转移情况、周围血管浸润情况及不同TNM分期生存率及中位生存期的差异,显示不同Bismuth-Corlette分型的1 a、2 a生存率及中位生存期差异无统计学意义(P>0.05)。不同病理组织分化程度的1 a、2 a生存率及中位生存期差异有统计有统计学意义(P<0.05)。淋巴结转移情况的1 a、2 a生存率及中位生存期差异有统计学意义(P<0.05)。周围血管浸润情况的1 a、2 a生存率及中位生存期差异有统计学意义(P<0.05)。不同TNM分期1 a、2 a生存率及中位生存期差异有统计学意义(P<0.05)。
2.3 影响预后的因素分析 分别将性别、年龄、术前白蛋白水平、术前总胆红素水平、血清CA19-9水平、Bismuth-Corlette分型、手术方式、肿瘤组织分化程度、淋巴结转移情况、周围血管浸润情况和肿瘤TNM分期等11个单因素逐一引入COX风险比例模型进行单因素分析(表2)。结果显示:手术方式、淋巴结转移情况、周围血管浸润情况、肿瘤组织分化程度和肿瘤TNM分期是影响预后的因素,差异有统计学意义(P<0.05)。性别、年龄、术前白蛋白水平、术前总胆红素水平、血清CA19-9水平和Bismuth-Corlette分型等对预后无明显影响(P>0.05)。
将对预后有影响的因素代入多因素COX风险比例模型中,采用逐步法进行分析,结果显示,手术方式、肿瘤组织分化程度及淋巴结转移情况是影响预后的独立因素(表3)。

表1 65例肝门部胆管癌患者手术方式对预后的影响
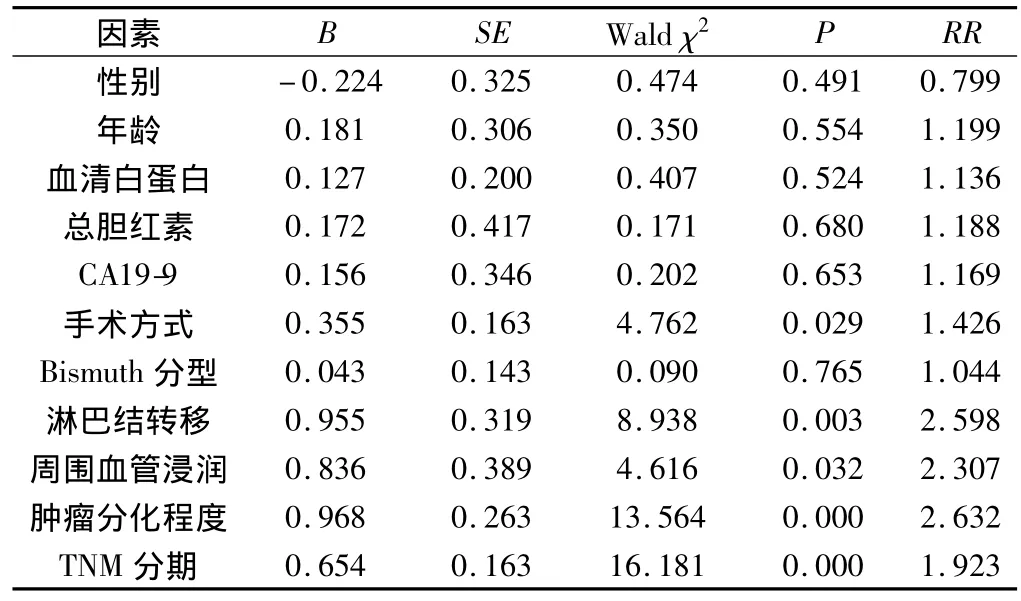
表2 65例肝门部胆管癌患者术后生存资料单因素COX回归分析结果
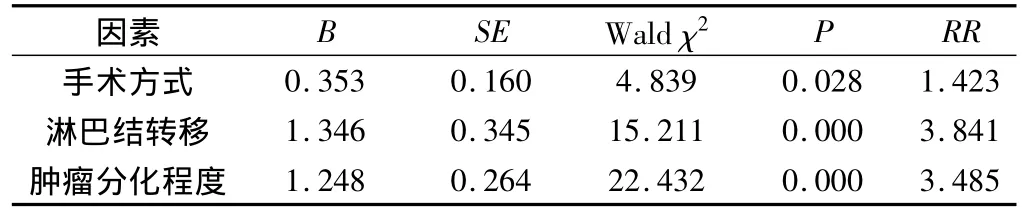
表3 65例肝门部胆管癌患者术后生存资料多因素COX回归分析结果
3 讨论
肝门部胆管癌占肝外胆管癌的58% ~75%,手术是肝门部胆管癌的首选治疗方法[1-2]。未行手术切除者平均生存期为3个月,其主要死亡原因为胆道感染和肝功能衰竭。由于肝门部胆管癌起病隐匿,早期多无特异性临床表现,患者多出现黄疸后就诊,血清总胆红素水平较高,给治疗带来困难,远期疗效不佳。手术虽然已成为肝门部胆管癌的首选治疗方法,但只有不到1/3的患者可行根治性手术切除,且术后5 a生存率低[3]。因此,有必要对影响肝门部胆管癌切除术后的预后因素进行深入探讨。
本研究结果显示,不同手术方式术后1 a、2 a生存率及中位生存期差异有统计学意义(P<0.05)。COX模型单因素分析显示,手术方式、淋巴结转移、周围血管浸润、肿瘤组织分化程度及肿瘤TNM分期是影响预后的因素;COX模型多因素分析显示,手术方式、肿瘤组织分化程度及淋巴结转移情况是影响预后的独立因素。
本组资料单因素及多因素分析均提示手术方式是影响预后的相关因素。采用Kaplan-Meirer法分析5种手术方式生存率,单因素Log rank检验比较根治性切除术组与姑息性切除组、内引流组、外引流组及剖腹探查组生存率,差异有统计学意义(P<0.05)。本组病例中行手术切除组患者1 a生存率及中位生存期均高于非根治性手术组,行根治性切除组患者1 a生存率及中位生存期均高于姑息性手术组,说明提高根治性切除率对肝门部胆管癌的预后具有积极作用。肝门部胆管癌根治性切除应达到R0切除(病理检查切缘无癌细胞),保证胆管断端、肝断面和血管壁无肿瘤细胞残留,彻底清扫肝十二指肠韧带内除血管外的所有淋巴、脂肪、神经组织,胆管必须离开肿瘤5~10 mm切断。对于累及肝叶者,酌情行肝方叶、肝尾状叶、左右半肝联合切除。对于无法达到根治性切除者应争取行姑息性切除(R1、R2),仍能取得较单纯引流术好的生存效果[4]。术前应做好充分准备,是提高手术切除率的关键,包括术前行彩超、CT、MRCP等影像学检查以了解肿瘤的大小、浸润范围、与周围血管的关系及有无转移。Chamberlain等[5]认为对所有的患者都应该持积极的手术态度,根治性手术切除可使患者获得长期生存。本组病例根治性切除率为26.2%,1例行根治性切除术的患者生存期已超过5 a。
本研究表明,肿瘤组织分化程度对预后亦有明显影响,高分化组患者生存率与中、低分化组患者生存率比较差异有统计学意义(P<0.05),胆管癌的分化程度越差,其浸润及转移特征越明显。
肝门部胆管癌主要沿胆管壁上下浸润及向周围神经、淋巴间隙播散,胆管周围重要结构如肝动脉、门静脉及肝实质易受侵犯,其中肝十二指肠韧带内癌细胞残留是肝门部胆管癌术后复发的重要因素[6]。因此,手术过程中应注重实现胆管、大血管的骨骼化,尽可能地切除区域淋巴结、神经纤维、周围脂肪及结缔组织。本组资料显示淋巴转移是影响预后的独立因素,术中规范化淋巴结清扫能改善患者预后。
对于不能行手术切除的患者应尽量行姑息性引流术[7]。对于内、外引流的选择,尽可能选择内引流术,内引流术可减少胆盐和电解质的丢失,维持正常胆盐肝肠循环,避免机体内环境紊乱,同时解除了外引流管给患者带来的不适。
总之,对于肝门部胆管癌的治疗,根治性切除和彻底的淋巴结清扫仍然是患者获得较长生存期的重要手段。肿瘤的组织分化程度是影响预后的重要因素。
[1]Lau SH,Lau WY.Current therapy of hilar cholangiocarcinoma[J].Hepatobiliary Pancreat Dis Int,2012,11(1):12 -17.
[2]Malhi H,Gores GJ.Review article:the modern diagnosis and therapoy of cholangiocarcinoma[J].Aliment Pharmacol Ther,2006,23(9):1287-1296.
[3]周宁新,黄志强,王敬,等.402例肝门部胆管癌临床分型、手术方式与远期疗效的综合分析[J].中华外科杂志,2006,44(23):1599-1603.
[4]Hasegawa S,Ikai I,Fujii H,et al.Surgical resection of hilar cholangiocarcinoma:analysis of survival and postoperative complications[J].World J Surg,2007,31(6):1256 -1263.
[5]Chamberlain RS,Blumgart LH.Hilar cholangiocarcinoma:a review and commentary[J].Ann Surg Oncol,2000,7(1):55 -66.
[6]Ikeyama T,Nagino M,Oda K,et al.Surgical approach to bismuth TypeⅠandⅡhilar cholangiocarcinomas:audit of 54 consecutive cases[J].Ann Surg,2007,246(6):1052 -1057.
[7]李强,李慧锴,郝希山.肝门部胆管癌的外科治疗和预后相关因素分析[J].中华外科杂志,2009,47(2):94 -97.

