盐酸去氢骆驼蓬碱诱导人胰腺癌AsPC-1细胞凋亡
张晓凯, 曹明溶, 张 鹏, 李 强, 刘志龙, 蒋建伟
(1.暨南大学附属第一医院外科,广东广州510632;2.暨南大学医学院生物化学与分子生物学教研室,广东广州510632)
盐酸去氢骆驼蓬碱(harmine hydrochloride)是一类生物碱,来源于蒺藜科骆驼蓬属植物骆驼蓬的种子,研究发现其具有较广的抗肿瘤谱,对多种体外培养的肿瘤细胞有明显的抑制作用[1-4]。在新疆、甘肃等地区已经开始把骆驼蓬粗提物应用于肿瘤临床治疗。对骆驼蓬碱类化合物的抗肿瘤机制认识还不是很深入,目前较多认可的是以下几种机制:(1)抗肿瘤增殖和诱导肿瘤细胞凋亡[5];(2)对DNA拓扑异构酶(DNA topoisomerase)Ⅰ和Ⅱ具有抑制作用,尤其是对DNA拓扑异构酶Ⅱ的抑制是骆驼蓬碱类化合物抗肿瘤的可能机制之一[6];(3)对细胞周期蛋白依赖性激酶产生特异性抑制作用,从而发挥抗癌作用[7]。本研究观察了盐酸去氢骆驼蓬碱诱导人胰腺癌AsPC-1细胞死亡的过程,并探讨其抗胰腺肿瘤作用的可能机制。
1 材料与方法
1.1 材料
人胰腺癌AsPC-1细胞由中山大学附属肿瘤医院提供。盐酸去氢骆驼蓬碱购自四川省维克奇生物科技有限公司,盐酸去氢骆驼蓬碱质量分数大于98%。噻唑蓝(MTT)、膜连蛋白-异硫氢酸荧光素(Annexin-V/FITC)、碘化丙锭(PI)购自Sigma公司。Caspase-3,基因组检测和 DNA修复酶(PARP),LC3,P62抗体均购自 Cell Signaling Technology公司,甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自 Proteintech Group公司。化学发光试剂(ECL)发光液购自南京凯基生物科技发展有限公司。
1.2 方法
(1)细胞培养及处理 人胰腺癌AsPC-1细胞以含质量分数5%胎牛血清的RPMI-1640培养基培养于37℃、体积分数5%CO2的培养箱中,细胞融合达到80%时,质量分数0.25%胰酶消化传代。
(2)MTT法 取对数生长期人胰腺癌AsPC-1细胞,将细胞以5×103/孔的密度接种于96孔板,每组设5 个复孔,分别加入浓度为 0、10、20、40、60、80、100、120、140 及 160 μmol·L-1的盐酸去氢骆驼蓬碱,终体积为150 μL。置于37℃、体积分数5%CO2培养箱培养48 h,取出孔板,每孔加入20 μL MTT试剂,放入培养箱中继续孵育6 h,取出孔板吸净孔内液体,每孔加入150 μL二甲基亚砜(DMSO),微板振荡器振荡10 min,立即于酶标仪570 nm波长检测各孔吸光度。计算各组增殖抑制率,增殖抑制率(%)=(1-A实验组/A对照组)×100%。
(3)克隆形成抑制试验 取对数生长期人胰腺癌AsPC-1细胞,用含质量分数5%胎牛血清的RPMI-1640培养液稀释细胞悬液,接种于12孔培养板,每孔加入300个细胞,每组设2个复孔,分别加入浓度分别为 0、2、4、8、12 及 16 μmol·L-1的盐酸去氢骆驼蓬碱。置37℃、体积分数5%CO2培养7 d后,吸去培养液,磷酸盐缓冲液(PBS)洗涤2次后,V 甲醇∶V 冰醋酸 =3∶1,固定 10 min,结晶紫染色,30 min后,流水冲洗5 min,拍照。
(4)Annexin V-FITC/PI双染色流式细胞仪检测细胞凋亡 取对数生长期的AsPC-1细胞,以1×105/mL的密度接种于6孔板,加入盐酸去氢骆驼蓬碱浓度分别为 0、10、20、40 及 60 μmol·L-1。置于37℃、体积分数5%CO2培养箱内培养48 h,消化收集细胞,1 000 r/min离心6 min,弃上清。PBS洗涤2次,以染色缓冲液重悬,分别加入10 μL Annexin V-FITC和 5 μL PI,轻轻混匀,室温避光反应 15 min。加入200 μL染色缓冲液,流式细胞仪检测,分析早期和晚期凋亡细胞的百分率,每个样本分析10 000个细胞。
(5)免疫印迹法 盐酸去氢骆驼蓬碱处理后收集悬浮及贴壁的AsPC-1细胞,1 000 r/min离心10 min,用PBS洗2次,吸尽PBS;细胞裂解液于冰上裂解15 min,12 000 r/min离心15 min,收集上清液。经BCA法测蛋白浓度后,等量样品以质量分数12%的十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)分离蛋白质。电泳后将蛋白转印至聚偏二氟乙烯(PVDF)膜上,质量分数5%脱脂奶粉封闭后,一抗封闭过夜,再以辣根过氧化物酶标记的二抗封闭液封闭1 h,加入ECL发光液,显影,保存。
1.3 统计学方法
采用SPSS 13.0统计软件处理数据,采用完全随机设计的单因素方差分析(One-way ANOVA),统计组间差异的显著性,P<0.05有统计学意义。
2 结果
2.1 盐酸去氢骆驼蓬碱对人胰腺癌AsPC-1细胞增殖的抑制作用
MTT法检测发现,盐酸去氢骆驼蓬碱作用于人胰腺癌AsPC-1细胞后,与细胞对照组相比,不同浓度的盐酸去氢骆驼蓬碱对胰腺癌细胞均有抑制作用(P<0.01),且随着药物浓度的增加,抑制作用增强,呈明显的剂量依赖性。24、48及72 h的IC50分别约为 116.5、66 及22.3 μmol·L-1(图 1)。
2.2 盐酸去氢骆驼蓬碱对胰腺癌 AsPC-1细胞克隆形成的影响
与空白对照组比较,随着盐酸去氢骆驼蓬碱作用于胰腺癌细胞的药物浓度的增加,细胞克隆逐渐减少,有统计学意义(P<0.05),盐酸去氢骆驼蓬碱浓度为4 μmol·L-1时,产生明显的克隆形成抑制作用,当浓度达到 16 μmol·L-1时,几乎没有克隆细胞株形成(图2)。

图1 不同浓度盐酸去氢骆驼蓬碱对AsPC-1细胞增殖抑制作用Fig.1 Inhibition of harmine hydrochloride on Aspc-1 cells determined by MTT assay

图2 不同浓度的盐酸去氢骆驼蓬碱对AsPC-1细胞克隆形成作用Fig.2 Clone formation assay was used to evaluate the effects of harmine hydrochloride on the proliferation of Aspc-1 cells
2.3 Annexin V-FITC/PI双染色检测细胞凋亡
各组药物作用于胰腺癌AsPC-1细胞48 h后,利用Annexin V-FITC/PI双染流式细胞术检测,左下象限(LL)为正常细胞群,右下象限(LR)为早期凋亡细胞群,左上象限(UL)为自噬性死亡和非特异性死亡细胞群,右上象限(UR)为晚期凋亡细胞及坏死细胞群,与对照组相比,各组细胞的晚期凋亡及坏死细胞群均显著增多(图3)。
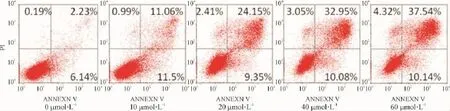
图3 不同浓度的盐酸去氢骆驼蓬碱对AsPC-1细胞凋亡的影响Fig.3 Distinguishing and quantitatively determineing the percentage of apoptotic cells using Staining cells with Annexin V-FITC and PI
2.4 Western blotting免疫印迹检测凋亡及自噬相关蛋白的表达
各组药物(浓度分别为 0、10、20、40及 60 μmol/L)作用于人胰腺癌 AsPC-1细胞48 h后,Western blotting检测凋亡和自噬相关蛋白的表达,结果显示凋亡执行蛋白Caspase-3前体表达减少,PARP表达减少并被切割,提示凋亡的发生;自噬标志蛋白LC3-Ⅱ表达水平增加,P62泛素化,表达减少,提示了自噬的发生(图4A,4B)。
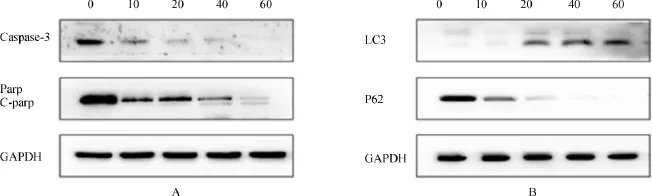
图4 Western blotting检测AsPC-1细胞Caspase-3,PARP,LC3和P62蛋白表达水平Fig.4 Harmine hydrochloride activated Caspase-3 and PARP,LC3 AND P62
3 讨论
目前,许多体内外实验研究及临床应用都证明了骆驼蓬碱类化合物具有抗肿瘤谱广,抑制肿瘤作用强等特点,对其作用机理已进行了一定的研究但不够深入。本实验通过研究盐酸去氢骆驼蓬碱对人胰腺癌AsPC-1细胞的增殖抑制作用,表明盐酸去氢骆驼蓬碱除可以诱导人胰腺癌细胞凋亡外,也发生细胞自噬,从而发挥抗肿瘤作用。
Jahaniani[8]等采用 MTT法检测去氢骆驼蓬碱的抗癌活性,发现其对人类肿瘤细胞(HL60、K562、HeLa、KB、A549、Saos-2、A2780-CP、A2780-S、MCF-7、A375及 A172等)具有广泛的细胞毒性,其中对HL60和 K562细胞的细胞毒性最强。本研究中MTT和克隆形成抑制试验表明,盐酸去氢骆驼蓬碱对人胰腺癌AsPC-1细胞有强烈的增殖抑制作用,随着药物浓度的增加,AsPC-1细胞的增殖抑制越明显,差异有统计学意义(P<0.01),表明盐酸去氢骆驼蓬碱以剂量依赖性的方式抑制AsPC-1细胞的增殖。
研究表明去氢骆驼蓬碱可诱导人白血病细胞U937、HL-60、Jurket、人胃腺癌细胞 SGC-7901 及人肝癌细胞 HepG2 凋亡[5,9-10]。本试验中 Annexin V-FITC/PI双染流式细胞检测表明了盐酸去氢骆驼蓬碱诱导了人胰腺癌AsPC-1细胞的凋亡。Annexin V-FITC/PI双染流式细胞检测盐酸去氢骆驼蓬碱药物组,晚期凋亡和坏死性死亡的细胞较多。
Caspase(cysteine aspartate-specific protease)属于半胱氨酸蛋白酶,是引起细胞凋亡的关键酶,激活后能将细胞内的蛋白质降解,诱导细胞凋亡。其中Caspase-3是凋亡级联信号通路中的效应分子,是凋亡的执行蛋白,其执行凋亡的功能依赖于底物蛋白的酶解活性,细胞在各种凋亡信号诱导下,通过激活依赖 Caspase 凋亡途径导致细胞凋亡[11-12]。而PARP作为基因组检测和DNA修复酶,在凋亡中由Caspase-3和其他半胱氨酸蛋白酶降解,被认为是细胞凋亡的一个早期分子标志。在本研究中盐酸去氢骆驼蓬碱作用于人胰腺癌AsPC-1细胞后可见Caspase-3蛋白表达随着药物浓度的增加逐渐减少,PARP表达减少并被切割,提示了凋亡的发生。
自噬是一种普遍存在于大部分真核细胞中的现象,从真核细胞酵母到人类均存在着相似的自噬调控机制,参与自噬的基因被统一命名为酵母自噬相关基因ATG(AuTophaGy-related)。其中有两个主要的系统,一个是Atg12-Atg5结合系统,另一个是Atg8脂化系统。微管轻链相关蛋白 LC3(MAPLC3)是Atg8在哺乳动物中的同源物,LC3经过翻译修饰后形成主要位于胞浆的LC3-Ⅰ和主要位于自噬体和自噬溶酶体膜上的LC3-Ⅱ,其中LC3-Ⅱ定位于自噬泡膜表面,是细胞自噬性死亡的特异性分子标记物[13-14]。P62蛋白是一种具有泛素结合域的蛋白,它可以与LC3蛋白结合,使其作为一个连接蛋白,介导被泛素标记的蛋白底物结合到自噬体膜上,自噬发生时P62被降解[15]。本试验中,Western blot检测表明,相对于内参GAPDH,LC3-Ⅱ蛋白表达水平随着盐酸去氢骆驼蓬碱作用浓度的增加而增加,P62表达逐渐减少,提示了自噬的发生。
程序性细胞死亡(proguammed cell death,PCD)在肿瘤的发生、发展和治疗中起到重要的作用。目前把程序性细胞死亡分为凋亡性细胞死亡和自噬性细胞死亡[16]。近年来的研究表明,诸多抗肿瘤药物的作用机制都与它们能诱导肿瘤细胞凋亡有关[17-18]。自噬具有维持细胞自我稳态、促进细胞生存的作用,但自噬的过度激活或者持续激活也可以引起细胞死亡[19]。一些抗肿瘤药物,如已用于乳腺癌化疗的药物他莫昔芬可激活细胞自噬,三氧化二砷、甲磺酸伊马替尼等抗癌药均可诱导自噬性死亡[20]。已有研究证明在相同诱导因素下细胞中可分别诱发自噬和凋亡;近年来也有研究提示两者在某些情况下可能相互拮抗或者促进。本实验表明,盐酸去氢骆驼蓬碱可诱导人胰腺癌AsPC-1细胞发生凋亡,表明人胰腺癌细胞AsPC-1的增殖抑制是因为凋亡的发生,同时发现盐酸去氢骆驼蓬碱诱导肿瘤细胞自噬发生。但具体的信号传导通路和药理作用的靶点,以及两者的相互作用尚不清楚,还有待进一步的研究。
[1]潘启超,杨小平,李春杰,等.骆驼蓬总碱药理作用的研究[J].中山医科大学报,1997,18(3):1652-1671.
[2]潘启超,杨小平,利国威,等.骆驼蓬种子混合生物碱5L抗肿瘤作用[J].广东医学,1985,6(5):402-411.
[3]杨小平,潘启超,李春杰,等.骆驼蓬总碱体内外对人肝癌和胃癌瘤株的抑制作用[J].癌症,1991,10(6):4632-4651.
[4]杨小平,潘启超.去氢骆驼蓬碱对体外人宫颈癌Hela细胞的作用[J].中山医科大学学报,1986,7(1):442-461.
[5]SONG Z Y,LIU J,LU X L,et al.Harmine induces apoptosis in human SGC-7901 cells[J].J Chin Med Materials,2006,29(6):571 -573.
[6]王长虹,程雪梅,刘忠渊,等.骆驼蓬种子提取物及其β-咔保啉生物碱对DNA拓扑异构酶Ⅱ活性的抑制作用[J].中国临床药理学杂志,2008,24(5):422-425.
[7]SONG Y,KESUMA D,WANG J,et al.Specific inhibition of cyclin-dependent kinases and cell proliferation by harmine[J].Biochem Biophys Res Commun,2004,317(1):128-132.
[8]JAHANIAN F,EBRAHIMI S A,RAHBAR-ROSHANDEL N,et al.Xanthomicrol is the main cytotoxic component of Dracocephalum kotschyii and a potential anticancer agent[J].Phytochemistry,2005,66(13):1581-1592.
[9]CAO M R,LI Q,LIU Z L,et al.Harmine induces apoptosis in HepG2 cells via mitochondrial signaling pathway[J].Hepatobiliary Pancreat Dis Int,2011,10(5):346-351.
[10]刘俊玲,乌庆超,范传波,等.去氢骆驼蓬碱诱导白血病细胞凋亡的实验研究,中国中医药科技,2011,18(3):202-203.
[11]PARK S,KIM J A,CHOS S,et al.Superoxide is a potential culprit of caspase-3 dependent endothelial cell death induced by lysophosphatidylcholine[J].Physiol Pharmacol,2010,61(4):375 -381.
[12]CHOI Y J,KANG J S,PARK J H,et al.Polyphenolic flavonoids differ in their antiapoptotic efficacy in hydrogen peroxide-treated human vascular endothelial cells[J].J Nutr,2003,133(4):985 -991.
[13]KLIONSKY J,ABDALLA C,ABELIOVICH H,et al.Guidelines for the use and interpretation of assays for monitoring autophagy[J].Autophagy,2012,8(4):445 -544.
[14]王威,陈景红,王新宁,等.葡萄籽原花青素诱导人肝癌HepG2细胞凋亡及自噬性死亡[J].暨南大学学报:医学版,2011,32(2):181-187.
[15]PANKIV S,CLAUSEN T H,LAMARK T,et al.p62/SQSTM1 binds directly to Atg8/LC3 to facilitatedegradation of ubiquitinated protein aggregates by autophagy[J].J Biol Chem,2007,282(33):24131-24145.
[16]KIM K W,MUTER R W,CAO C,et al.Autophagy for cancer therapy through inhibition of pro-apoptotic proteins and mammalian target of rapamycin signaling[J].J Biol Chem,2006,281(48):36883-36890.
[17]LAH J J,CUI W,HU K Q.Effects and mechanisms of silibinin on human hepatoma cell lines[J].World J Gastroenterol,2007,13(40):5299 -5305.
[18]EDDERKAOUI M,ODINOKOVA I,OHNO I,et al.Ellagic acid induces apoptosis through inhibition of nuclear factor kappa B in pancreatic cancer cells[J].World J Gastroenterol,2008,14(23):3672 -3680.
[19]MIZUSHIMA N,YOSHIMORI T,OHSUMI Y.Role of the Apg12 conjugation system in mammalian autophagy[J].Inter J Biochem & Cell Biol,2003,35(5):553-561.
[20]KANZAWA T,GERMANO I M,KOMATA T,et al.Role of autophagy in temozolomide-induced cytotoxicity for malignant glioma cells[J].Cell Death & Differention,2004,11(4):448-457.

