创伤后应激障碍大鼠模型的建立及其有效性探讨
晋 翔,王 文,王化宁,谭庆荣,郑 红
创伤后应激障碍(post trauma stress disorder,PTSD)是一种创伤后心理失衡状态,临床表现包括反复重现创伤性体验、情感麻木、回避、警觉过强所致持续性焦虑、惊恐逃避以及易激惹症状等症候群[1]。多数研究认为应激强度与PTSD的发病率存在“剂量-效应”关系,应激强度越高患病的可能性越大[2]。由于缺少合适的动物模型使PTSD的研究受到很大的限制,因此对其神经生物学致病机制研究及临床治疗带来很大的困难。单次延长应激(single prolonged stress,SPS)动物模型由心理应激(束缚应激)和生理应激(强迫游泳、乙醚麻醉)构成。本实验采用SPS的方法建立PTSD大鼠模型,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 成年雄性SD大鼠24只,第四军医大学动物实验中心提供,体质量(200±20)g,光亮/黑暗周期为12 h/12 h,光照时间7:00—19:00,环境温度为22~24℃,相对湿度60%,正常摄食摄水,饲养1周开始实验。实验动物的操作和处理按照《第四军医大学关于利用实验动物开展研究的规定》执行。
1.1.2 实验药物及器材 乙醚(分析纯,中国医药集团上海化学试剂公司),松下微型摄像机(HDCSD10,日本),Morris 水迷宫(Morris water maze,MWM)视频分析系统(上海吉量软件科技有限公司),自制束缚器、游泳缸。
1.2 方法
1.2.1 实验设计
1.2.1.1 实验分组 SD大鼠随机分为空白对照组(control组,n=12)、单次延长应激组(SPS组,n=12),分组当天完成模型组单次延长应激实验。
1.2.1.2 实验流程 SPS组和control组大鼠不受打扰饲养15 d,第16天行旷场(open-field,OF)和高架十字迷宫(elevated plus maze,EPM)实验;第16天起行连续6 d的MWM实验,其中5 d为空间学习能力测试,最后1 d为记忆能力测试。
1.2.2 应激方法 首先将大鼠置于束缚器束缚2 h,随后将其放入23~25℃水温的游泳缸(直径24 cm,高50 cm)强迫游泳20 min;游泳缸侧面置一数码摄像头,动态记录大鼠在强迫游泳装置中游泳的录像资料;设定分析参数,进行在线或离线数据分析。休息15 min后乙醚麻醉失去知觉。麻醉后将大鼠置于通风处至自然苏醒,后放回饲养笼不受打扰饲养15 d。
1.2.3 观察指标
1.2.3.1 利用EPM、OF实验观察动物的高警觉性、焦虑/抑郁、恐惧行为
(1)EPM 实验:参照 Cohen等[3]的方法,利用不透明有机玻璃制成0.5 m高的高架十字迷宫,中间为8 cm×8 cm的平台。将大鼠放于EPM的中央平台上,鼠头统一朝向同一方向,10 s适应后,记录其行动5 min,记录大鼠在开臂停留时间以及大鼠进入开臂的次数等行为学指标。然后采用高架十字迷宫视频分析系统分析动物的各项行为指标。
(2)OF实验:参照 kalynchuk等[4]的方法,在直径47 cm×47 cm的黑暗旷场上用摄像头监视大鼠的活动情况,采集视频后分析各项行为指标。具体方法:将大鼠放于旷场行为观察箱中,10 s适应后,开始记录大鼠行为15 min,分析大鼠的活动次数、水平运动距离。
1.2.3.2 利用MWM实验观察动物的学习、记忆能力MWM为一直径120 cm、高55 cm的圆形水池,水池内壁被漆为黑色,池内水深42 cm,水温保持在(22±2)℃,房间内光照恒定,无光线直射在水池内。池壁上以4个等距离点将水池分为4个象限,在靶象限(设为第一象限)内距离池壁35 cm处放有一个直径为8 cm、高40 cm的圆形黑色站台,站台位于水面下2 cm。池壁内贴有不同形状及颜色的标记物。迷宫上方安置连接摄像机,同步记录大鼠运动轨迹。采用MWM视频分析系统进行信息处理,提供大鼠上台潜伏期、靶象限活动时间百分比、穿台次数等多个指标。
(1)定位航行实验:实验前任意选定一个目标象限将大鼠置于站台上适应20 s,随后将大鼠随机从不同位置(靶象限除外)面壁置入池内。大鼠登上站台5 s后终止记录,最长记录时间为60 s,若大鼠在60 s内不能上台,引导其登上站台适应10 s,最后将大鼠擦干放入鼠笼。如此将大鼠置入游泳池4次。测量平均上台潜伏期,以评判大鼠的空间学习能力。在第1~5天分别重复上述步骤。
(2)空间探索实验:在第6天撤掉水面下的站台,然后将大鼠面壁置入池内1次,记录大鼠在60 s内游泳轨迹并进行分析,最后将大鼠擦干放入鼠笼。记录穿台次数并计算大鼠在靶象限活动时间的百分比,评判大鼠的空间记忆能力。
1.3 统计学处理 采用SPSS 14.0统计软件对数据进行方差分析,数据用均数±标准差(±s)表示,各组动物之间的均数采用最小显著差异法(least significant difference,LSD)检验,P<0.05 为差异有统计学意义。
2 结果
2.1 SPS应激后对大鼠EPM行为的影响 SPS组开臂进入次数的百分比(23.55±3.79)%和开臂停留时间百分比(11.45±2.77)%显著低于control组[(37.83±4.07)%,(17.85±3.45)%],差异具有统计学意义(P<0.05,表1)。提示单次延长应激有明显的长时间致焦虑效应。
2.2 SPS应激后对大鼠OF行为的影响 应激15 d后,两组大鼠5 min内水平活动距离、中央停留时间存在差异(P<0.05),SPS组大鼠的水平活动距离[(4 557.35)mm、中央停留时间(37.12±4.10)s]均较 control组[(8 775.85)mm,(22.65±1.54)s]明显减少(表1)。提示单次延长应激导致大鼠活动性和探索性抑制,警觉水平、焦虑状态增强。
2.3 SPS应激后对大鼠MWM空间学习能力及空间记忆能力的影响
2.3.1 SPS应激后对大鼠MWM空间学习能力的影响 SPS组与control组第1~5天随着时间的延长上台潜伏期逐渐缩短。SPS组第1~5天的上台潜伏期分别为(49.27±2.78)、(33.04±3.85)、(29.18±3.51)、(20.98±2.76)、(19.67±2.66)次;control组第1~5天的上台潜伏期分别为(44.6±5.46)、(25.59±4.76)、(13.21±2.68)、(10.23±1.08)、(9.63±0.94)次。SPS组与control组相比第3~5天上台潜伏期明显延长,差异有统计学意义(P<0.05,图1),提示其学习和记忆的获得与巩固过程受到显著影响。

图1 SPS应激后对大鼠Morris水迷宫空间学习能力的影响
2.3.2 SPS应激后对大鼠MWM空间记忆能力的影响 SPS组在Morris水迷宫4个象限无目的漫游,在靶象限花费时间的百分比(32.15±2.82)%和穿台次数(1.15±0.26)次与control组靶象限花费时间的百分比(51.68±4.38)%和穿台次数(2.87±0.35)次相比均明显减少,差异具有统计学意义(P<0.05,表1)。提示单次延长应激记忆的读出或提取受到显著损害。
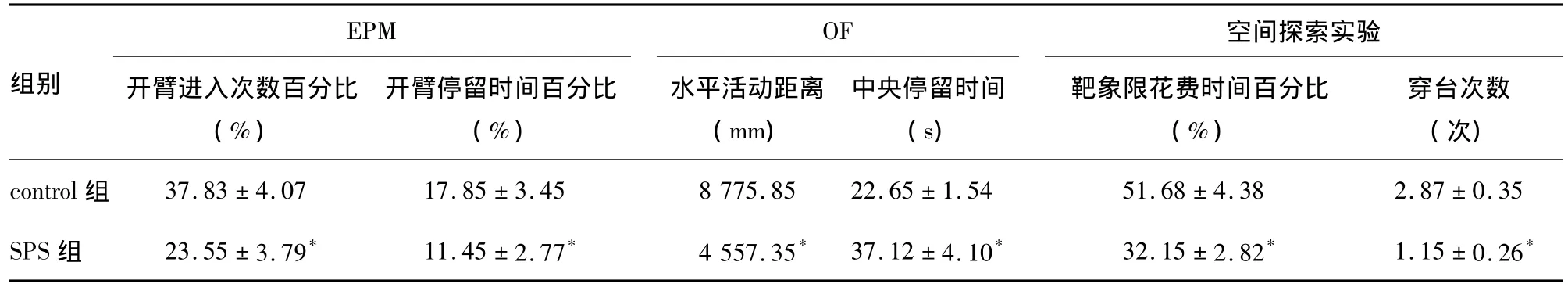
表1 大鼠EPM、OF、空间探索实验数据
3 讨论
PTSD是一组与应激密切相关的精神疾病,突发性、威胁性或灾难性生活事件是引发PTSD的首要因素。无论是人类或其他生物在面临不适于其生存的重大应激时,必然产生紧张、焦虑、恐惧、抑郁的情绪反应。但目前无理想的动物模型复制PTSD用以机制及药物干预研究,因此建立标准的PTSD的动物模型有重要的基础研究及应用价值。
EPM实验是利用动物对新异环境的探究性,以及对高悬开臂的恐惧感而形成矛盾冲突状态来评价实验动物焦虑素质特征[5]。SPS大鼠在EPM实验中表现为开臂进入次数的百分比和开臂停留时间百分比较空白对照组显著降低(P<0.05)。说明受到单次延长应激后的大鼠被置于EPM的中央区时,探究、好奇的天性减弱,与外界相通的开臂对其带来的威胁性增强,焦虑、恐惧水平明显增高,大鼠很快从中央区逃跑,离开开臂退缩到闭臂中。而空白对照组大鼠则在开臂停留更多的时间,对开臂的探究次数也相对较多。提示SPS可致大鼠较长时间的焦虑反应,大鼠探究行为抑制、回避和恐惧、焦虑水平增高。
OF实验是检测动物焦虑、恐惧水平的经典方法,用来评定动物的警觉水平、焦虑状态和环境适应能力[6-7]。如果大鼠的焦虑、恐惧水平高则倾向于停留在外周区,对中央区的探究次数及时间就会减少;反之,对中央区的探究次数及时间就会增多。SPS大鼠在OF实验中表现为水平活动度、活动次数、中央停留时间明显减少。说明SPS大鼠对中心区域的恐惧水平明显增高,较快退避至相对安全的外周区。
MWM通过测量动物的空间学习、记忆能力,可以更全面地了解动物空间认知的加工过程[8-9],观察应激的影响作用。在MWM实验中SPS大鼠的寻台时间明显延长,而在靶象限花费时间的百分比和穿台次数明显减少。提示SPS可以引发大鼠长期的学习和记忆能力受损,与临床PTSD患者存在的长期认知功能受损颇为相似。
从进化的角度讲,SPS大鼠所表现的防御反应是人类恐惧和焦虑反应的原始成分。因此,本实验中SPS大鼠所表现的对环境探究行为的抑制、回避反应与人类经历重大应激事件后的焦虑、恐惧反应是相似的。人类的焦虑反应主要表现为逃避现实、逃跑行为、警觉性提高,同样的行为反应也可从本实验SPS大鼠身上观察到。本模型成功模拟了PTSD的系统症状,如明显和较长时间对SPS的恐惧、高警觉性、逃跑行为、环境适应能力下降以及焦虑行为、空间学习记忆能力障碍。模型制作过程中,单次足够强度的应激源及不可预测性是模型成功的关键,多种不可预测的应激因子联合应用可产生理想的效果[10]。本研究通过SPS成功诱发了动物多种PTSD样精神和行为异常表现。该模型与PTSD有相似的致病因素与发生过程,效应持久,为进一步研究PTSD发病机制及药物干预提供了必要条件。
[1]Fortuna LR,Porche MV,Alegría M.A qualitative study of clinicians'use of the cultural formulation model in assessing posttraumatic stress disorder[J].Transcult Psychiatry,2009,46(3):429-450.
[2]Wang M,Armour C,Li X,et al.The factorial invariance across gender of three well-supported models:further evidence for a five-factor model of posttraumatic stress disorder[J].J Nerv Ment Dis,2013,201(2):145-152.
[3]Cohen H,Matar MA,Buskila D,et al.Early post-stressor intervention with high-dose corticosterone attenuates posttraumatic stress response in an animal model of posttraumatic stress disorder[J].Biol Psychiatry,2008,64(8):708-717.
[4]Kalynchuk LE,Pinel JP,Meaney MJ.Serotonin receptor binding and mRNA expression in the hippocampus of fearful amygdala-kindled rats[J].Neurosci Lett,2006,396(1):38-43.
[5]Golub Y,Mauch CP,Dahlhoff M,et al.Consequences of extinction training on associative and non-associative fear in amousemodelofPosttraumaticStressDisorder(PTSD)[J].Behav Brain Res,2009,205(2):544-549.
[6]Rubin DC,Berntsen D,Bohni MK.A memory-based model of posttraumatic stress disorder:evaluating basic assumptions underlying the PTSD diagnosis[J].Psychol Rev,2008,115(4):985-1011.
[7]Yamamoto S,Morinobu S,Takei S,et al.Single prolonged stress:toward an animal model of posttraumatic stress di-sorder[J].Depress Anxiety,2009,26(12):1110-1117.
[8]Unceta N,Barrondo S,Ruiz de Azúa I,et al.Determination of fluoxetine,norfluoxetine and their enantiomers in rat plasma and brain samples by liquid chromatography with fluorescence detection[J].J Chromatogr B Analyt Technol Biomed Life Sci,2007,852(1/2):519-528.
[9]Pinna G,Rasmusson AM.Up-regulation of neurosteroid biosynthesis as a pharmacological strategy to improve behavioural deficits in a putative mouse model of post-traumatic stress disorder[J].J Neuroendocrinol,2012,24(1):102-116.
[10]Yu H,Watt H,Kesavan C,et al.Lasting consequences of traumatic events on behavioral and skeletal parameters in a mouse model for post-traumatic stress disorder(PTSD)[J].PLoS One,2012,7(8):e42684.

