肝内胆管癌的病因学研究及预后分析
张 东
(江苏省常州市第一人民医院肝胆外科, 江苏 常州 213003)
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)又称胆管细胞癌或周围型胆管癌,是来自肝内二级分支以下胆管树上皮的肿瘤。ICC是仅次于肝细胞癌的原发性肝脏恶性肿瘤,约占原发性肝癌的5%[1],在世界范围内,ICC约占原发性肝脏恶性肿瘤的10%-20%[2],其发病率近年来呈现上升趋势。我国ICC的发病率占全球ICC发病率的55%[3]。由于ICC具有发生隐匿、恶性程度高、发展迅速等特点,患者就诊时往往已经处于病程晚期,从而影响了治疗和预后以及病人的生活质量和生存率。了解其发病的高危因素对其防治和预后疗效都具有极其重要的意义。本研究回顾分析了本院2000年1月至2007年12月期间经病理证实的46例ICC病理及其相关临床资料,并且探讨ICC的病因学以及影响治疗和预后的重要因素。
1 资料与方法
1.1 一般资料:收集2000年1月至2007年12月期间本院收治的46例经影像学或病理学确诊的肝内胆管癌病理资料。本组46例患者中男性29例(63.0%),女性17例(37.0%),年龄34-76岁,中位年龄为55.8岁;有乙型肝炎病史11例(23.9%);肝硬化14例(30.4%);肝囊肿4例(8.7%);肝内外胆管结石10例(21.7%),其中4例行胆道取石术;胆囊结石2例(4.3%);寄生虫病感染1例(2.2%);临床表现为腹胀腹痛等症状者36例(78.3%);伴随发热6例(13.0%);伴有黄疸 26例(56.5%);伴有乏力、消瘦等症状8例(17.4%);2例经体检B超发现肝内占位(4.3%),见表1。
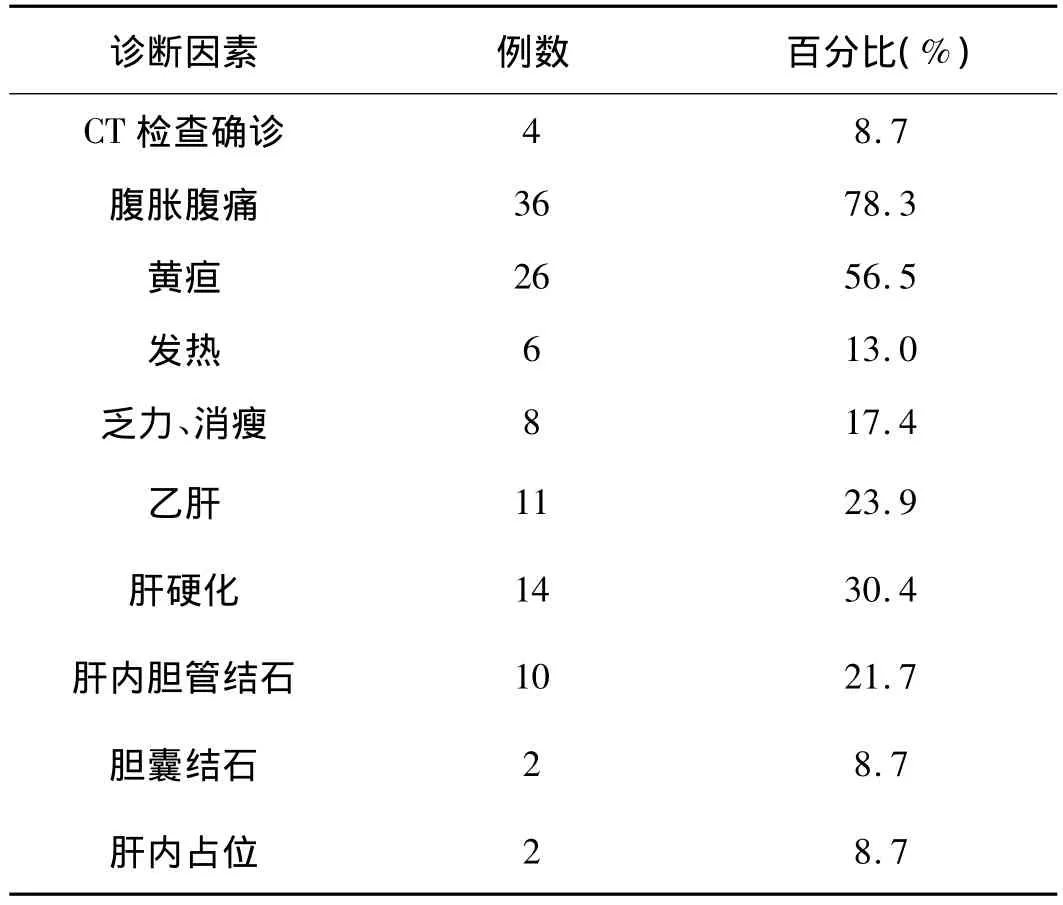
表1 46例肝内胆管癌的临床特征
1.2 病理表现及治疗策略:肿瘤大小在1-12cm,平均直径为4.9cm。46例ICC中31例为低分化腺癌,9例为中分化腺癌,高分化腺癌6例。所有病例分为三组:根治性手术组(包括规则性肝段、肝叶切除以及规则性肝叶切除联合区域淋巴结清扫)40例(87.0%)、姑息手术组(包括肝管空肠吻合加胃肠吻合,胆总管切开引流、介入手术)4例(8.7%)、无法手术者采用对症及营养支持治疗2例(4.3%)。本组46例患者中局部淋巴结转移24例(52.2%),门静脉转移8(17.4%),联合门静脉及淋巴结转移4例(8.7%),腹膜转移3 例(6.5%),见表2。

表2 单因素分析ICC患者预后影响因素
1.3 随访:采用电话或信件的方式,本组患者中位随访时间为6(2-60)个月。46例患者随访资料完整。
1.4 统计学分析:所有数据均采用SPSS16.0统计学软件进行处理,行单因素及Cox多因素分析影响预后的因素,包括性别、年龄、血清 CA19-9浓度、肿瘤大小、组织学分化程度、门静脉、淋巴结、腹膜转移等,P<0.05视为差异有统计学意义。
2 结果
2.1 生存状况:本组随访46例患者中13例术后1年左右出现复发转移,10例发生肝内复发转移,3例出现腹腔转移。1、3、5 年总生存率分别为 70.1%、41.6%、20.4%,中位生存时间为29个月。2.2 预后影响因素分析:单因素分析预后结果显示:肿瘤直径大小、组织学分化程度、门静脉、淋巴结、腹膜转移、手术方式为影响肝内胆管癌预后的相关危险因素。淋巴结转移的患者1、3、5年生存率分别为46.5%,10.7%,3.7%,与无淋巴结转移者的 1、3、5 年生存率相比 88.3%,50.2%,29.8%有显著性差异(P<0.05)。其中根治性手术组1、3、5年生存率分别为89.6%,49.8%,27.9%;相比较其他两组有显著性差异(P<0.05)(表2)。Cox多元回归分析表明,组织学分化程度、是否有门静脉转移、淋巴结转移、腹膜转移以及手术方式均是影响ICC患者预后的独立危险因素,见表3。

表3 46例肝内胆管癌预后因素Cox模型多因素分析
3 讨论
ICC属于原发性肝癌,其发病率仅次于肝细胞肝癌,为常见的原发性肝癌,国外有研究显示其发病率正呈现逐年递增趋势[4]。肝内胆管结石、原发性硬化性胆管炎(PSC)、寄生虫感染、病毒性肝炎和先天性肝内胆管扩张症(Caroli病)是目前国际上公认的导致ICC发病的危险因素[5-7]。其中ICC与肝胆管结石的关系甚为密切。关于肝内胆管结石伴发ICC的发病机制,一般认为是肝胆管结石对胆管壁的长期机械刺激以及所引起的慢性胆道感染和胆汁滞留等因素导致胆管壁的慢性增生性炎症,继而引起胆管黏膜上皮的不典型增生,并逐渐移行成腺癌[8]。PSC是一种与炎症性肠病密切相关的慢性胆汁淤积性肝病,其中自身免疫机制作用于基因易感个体诱发PSC的观点已被广泛接受,而胆管癌是其最为严重的并发症[9]。寄生虫感染的致癌机制可能与成虫在胆管内蠕动的机械性刺激,虫体代谢产物和胆汁成分的化学性刺激有关[10]。传统观点认为病毒性肝炎与肝细胞癌密切相关而与ICC无关。近年来流行病学和实验研究结果显示HBV和HCV感染与胆管癌的发生存在关系,但是确切发病机制尚不清楚[11,12]。Caroli病是一种较为少见的先天性胆道疾病,文献报道其促进癌变的机制可能是先天性细胞畸变的结果,同时经胆汁排出的某些代谢产物淤积在囊肿内,在并发感染的情况下有较强的致癌性。总之,ICC起病隐匿,早期无明显临床症状,由于检测缺乏特异性标志物很容易造成被漏诊、误诊,患者就诊时往往已经处于病程中晚期。血清CA19-9、AFP、B超、CT和MRI是目前诊断和鉴别ICC的重要手段。
ICC的预后较差,术后的5年生存率不理想。本组研究的病例中ICC患者的中位生存时间为29个月,行根治性切除后的5年生存率仅为27.9%。本研究参考文献报道的与病因学和预后相关的指标,将肿瘤直径大小、是否有血管转移、肿瘤数目等因素纳入到预后因素分析,结果显示肿瘤直径、肿瘤数目、淋巴结转移是影响ICC预后的相关危险因素。
ICC的发病率正在不断上升,相关的研究工作也将进行深入的研究。目前手术切除仍然是ICC患者的最佳治疗方案,有时需要扩大肝切除或者肝外胆道系统的切除和重建,为减少术后复发和改善预后,术中应该进行淋巴结清扫,对无法手术切除的患者可以考虑姑息性手术。对于化疗、放疗等治疗方法的治疗效果仍然需要进一步的研究。分子靶向研究近年来已经成为研究的热点,针对ICC的癌基因或是抑癌基因的表达异常的研究也将在未来为ICC的综合治疗提供一种新的思路。
[1]Casavilla FA,Maesh JW,Jwatsuki S,et al.Hepatic resection and transplantation for peripheral cholangiocarcinoma[J].Am Coll Surg,1997,185(5):429-436.
[2]Aljiffry M,Abdulelah A,Wslsh M,et al.Evidence-based approach to cholangiocarcinoma:a systematic review of the current literature[J].Am Coll Surg,2009,208(1):134 -147.
[3]黄志强.肝胆管外科的发展方向[J].外科理论与实践,2011,16(4):329-331.
[4]Tsuji T,Hiraoka T,Kanemistu K,et al.Lymphatic spreading pattern of intrahepatic cholangiocarcinoma[J].Surgery,2001,129(4):401-407.
[5]Wu ZY,Luo M.New views upon intrahepatic cholangiocarcinoma[J].Journal of Surgery Concepts & Practice,2009,14(2):135-139.
[6]陈平,何振平,别平,等.肝内胆管结石并发肝内胆管癌的诊断和外科治疗[J].中华肝胆外科杂志,2003,9(12):762-765.
[7]殷正丰,周彦明.肝内胆管癌的相关危险因素[J].实用肿瘤杂志,2007,22(2):93-95.
[8]Hur H,Park IY,Sunq GY,et al.Intrahepatic cholangiocarcinoma associated with intrahepatic duct stones[J].Asian Surg,2009,32(1):7-12.
[9]Kawaquchi T,Kaji R,Horiuchi H,et al.Development of intrahepatic cholangiocarcinoma after a 14-year follow-up of a patient with primary sclerosing cholangitis and ulcerative colitis[J].Hepatol Res,2011,41(12):1253-1259.
[10]De Martel C,Plummer M,Franceschi S.Cholangiocarcinoma:descriptive epidemiology and risk factors[J].2010,34(3):173-180.
[11]Zhou Y,Zhao Y,Li B,et al.Hepatitis viruses infection and risk of intrahepatic cholangiocarcinoma:evidence from a meta-analysis[J].BMC Cancer,2012,16(12):289 -291.
[12]Liu W,Chen JR,Hsu CH,et al.A zebrafish model of intrahepatic cholangiocarcinoma by dual expression of hepatitis B virus X and hepatitis C virus core protein in liver[J].Hepatology,2012,56(6):2268-2276.