乳腺癌外周血标记物FAM83A的检测及临床意义*
许亚娜, 许 倩, 刘 镭
(1.河北省承德市妇幼保健院, 河北 承德 067000 2.承德医学院基础医学研究所, 河北 承德 067000 3.承德医学院免疫学教研室, 河北 承德 067000)
乳腺癌是女性最常见的恶性肿瘤之一,治疗失败的主要原因是具有转移潜能的肿瘤细胞在术前或术中脱离原发灶随血行转移。还有学者提出微转移是一个独立的预后指标,其价值优于肿瘤的分级和分期。因此,及时发现肿瘤的血行微转移,对减少日后转移性肿瘤的发生、改善预后、提高生存率,具有重要的意义。FAM83A是一种新鉴定的肿瘤特异性抗原[1],研究发现其在肺癌患者外周血中高表达,对肺癌的预后和治疗评价具有指导意义[2]。本文通过肿瘤基因组解剖计划(CGAP)SAGE(Serial Analysis of Gene Expression)数据库发现FAM83A基因在乳腺癌外周血中也高表达。以该基因作为分子标记物,测定了乳腺癌患者外周血的微转移情况,并进一步分析该基因与乳腺癌发生和转移的关系。
1 材料和方法
1.1 材料:收集2009年11月至2012年8月在承德医学院附属医院肿瘤科病历资料完整的乳腺癌外周血标本84例,均为女性,年龄21-82岁,中位年龄52岁。
抽血前均未接受化学治疗和放射治疗。所有患者均经手术治疗证实,手术后均经病理确诊。其中59例浸润性导管癌,4例单纯癌,3例湿疹样癌,11例髓样癌,7例浸润性小叶癌。淋巴结转移阳性53例,淋巴结转移阴性31例。Ⅰ和Ⅱ期乳腺癌患者56例,Ⅲ和Ⅳ期乳腺癌患者28例。雌激素受体(ER)阳性51例,阴性33例。孕激素受体(PR)阳性39例,阴性45例。HER2阳性43例,阴性41例。正常捐献者外周血60例,均为女性,年龄22-76岁,中位年龄为49岁,与乳腺癌组比较无统计学差异。经胸片和B超检查未发现乳腺相关和其它疾病。
1.2 差异基因的筛选:利用CGAP提供的SAGE Genie数据库(http://cgap.nci.nih.gov/SAGE),选取数字基因表达演示(DGED)工具。选择乳腺癌组织和正常白细胞两个池,设置F值为16,即表达差异大于16倍以上,P值设置为0.01。差异表达的基因按差异显著性高低排序,比对出在短序列标签文库和长序列标签文库中都出现的差异基因,作为候选基因。
1.3 总RNA提取和cDNA合成:将3-5mL外周血置于淋巴细胞分离液上,密度梯度离心法分离单个核淋巴细胞。细胞计数后,按106个细胞/mL在1.5 mL eppendorf管中加入适量TRIzol试剂,提取总RNA。分光光度法测定纯度后取5μg,按逆转录试剂盒(QIAGEN)操作步骤进行逆转录获得cDNA。
1.4 实时半定量巢式PCR方法检测外周血癌细胞:第一轮PCR反应体系包括:2.5μL外周血的cDNA模板,0.2μmol/L 外侧引物(上游序列为:5’CACTTCTTGGAGGTGCCCTGCACG 3’;下游序列为:5’TAGAGGCAGCCAACAAGCGTG 3’),0.2 mM dNTP,50 mM Tris-HCl(pH 8.3),10 mM KCl,5mM(NH4)2SO4,2 mM MgCl2,0.75 U of Taq polymerase ,总体积为25μL。反应条件为:94℃变性 20s,62℃30s,72℃延伸 80s,35个循环后,再72℃延伸10min。
取2μL第一轮PCR的产物作为第二轮的模板,20μL PCR反应体系还包括:0.25μmoL/L内侧引物(上游序列为:5’CACTTTGGTTCCTGATGGCTT 3’;下游序列为:5’CTCCCAAGCCCAGCTTTCCAAAGG 3’),SYBR Green PCR master mix(上海基康生物技术有限公司)。反应条件:94℃变性4min,然后94℃15s,60℃30s,再72℃40s,共40个循环扩增。GAPDH 为内参照,每个样本的每个待测项目均测3次,取平均值。记录各样品的Ct值,并计算各组目的基因的相对表达量。计算公式为:△CtFAM83A=CtFAM83A-CtGAPDH;△△Ct=△Ct肿瘤-△Ct正常人平均值;目的基因的相对量 Q为:2-ΔΔCt。将特异性为100%时的-△Ct值作为界限值。
1.5 统计学处理:采用SPSS13.0统计软件包进行统计分析。乳腺癌病例对照的比较采用t检验,病例按临床病理特征分组后不同组的比较采用方差分析。
2 结果
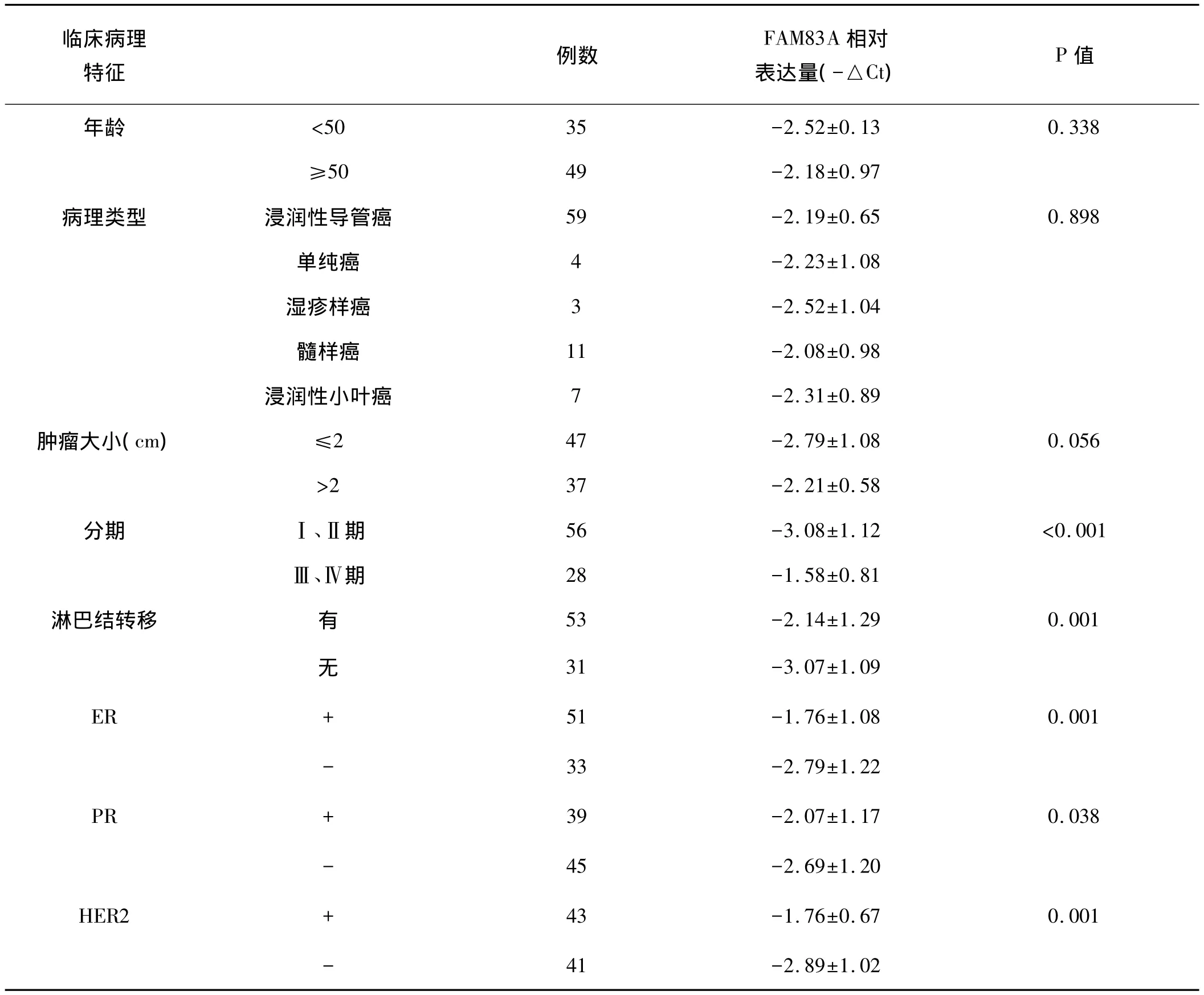
表1 乳腺癌外周血FAM83A表达水平与临床病理特征的关系(mean±SD)
2.1 乳腺癌外周血高表达基因FAM83A的鉴定:在 SAGE文库中,比对出在10bp的短标签文库(short tags)和17bp的长标签文库(long tags)中共同出现的基因,最终筛选出22个在乳腺癌中高表达的基因。其中FAM83A高度差异表达,并经RT-PCR验证其在10乳腺癌外周血标本中有5例表达,而10例正常人外周血中无1例表达,可作为外周血检测乳腺癌的标记物。
2.2 乳腺癌外周血FAM83A的表达水平:实时半定量巢式PCR检测外周血FAM83A mRNA表达水平,测得乳腺癌组患者-△Ct为 3.84±2.2,显著高于正常组-△Ct(-8.11±2.5),P<0.001,见图 1。乳腺癌患者FAM83A mRNA 相对表达量为:53.24±22.7。根据界限值,得到FAM83A在乳腺癌中的阳性表达率为40.5%(34/84)。
2.3 FAM83A表达与临床病理特征的关系:外周血肿瘤标记物FAM83A表达与临床分期(P<0.001)、淋巴结是否转移(P=0.001)和 ER(P=0.001)、PR(P=0.038)、HER2(P=0.001)相关。而与年龄(P=0.338)、病理类型(P=0.898)和肿瘤大小(P=0.056)无相关性。详见表1。

图1 FAM83A在乳腺癌和正常组外周血中的表达比较
3 讨论
大部分乳腺癌患者均经历手术为主的综合治疗,但许多病例甚至相当部分早期患者仍出现肿瘤的复发和转移。具有转移潜能的肿瘤细胞在术前或术中已脱离原发灶,以非常少的数量转移到淋巴结、骨髓、血液或远处器官中,普通的检测手段却不能发现,称为“肿瘤微转移”[3]。通过检测血液循环中癌细胞,可发现最低限度残留病灶,提高肿瘤分期的准确性,对肿瘤的转移与否和预后判断有重要意义,而且还可了解综合治疗疗效,指导进一步治疗。及时发现肿瘤的血行播散并给予有效治疗,将有助于杀灭血中播散的肿瘤细胞,减少日后转移性肿瘤的发生,改善预后,提高生存率[4]。但由于播散到外周血中的实体肿瘤细胞数目非常少,需要高度敏感、特异的技术对其进行检测。RT-PCR检测特异性标志蛋白mRNA的表达已被证明是检查外周血、淋巴结和骨髓中循环癌细胞和检测隐匿性癌转移的高度敏感方法。其基础是转移的恶性肿瘤细胞仍然表达具有起源组织特征的特异标记,主要用于检测实体肿瘤的微转移。如果采用巢式PCR技术则敏感性更高,10mL全血中有10个癌细胞就能被检测出,而常规PCR技术10mL全血中含1000个以上癌细胞时才可检测出[5]。本实验,我们采用了荧光半定量巢式PCR方法,第一轮为普通PCR反应,结束后取扩增产物2μL作为模板加入到第二轮体系中,而第二轮PCR检测则采用荧光定量技术,对扩增产物进行相对的定量检测。这样既保证了检测的敏感性,又兼具有real-time PCR定量的优势。
有效的微转移的检测,仅仅敏感的方法还不够,还需要特异性好的标志物基因。由于目前在实体瘤中尚无特异明确的肿瘤标记物,因此,主要采用组织特异mRNA转录物为标记物。生物信息学是综合计算机科学、信息技术和数学的理论和方法来研究生物信息的交叉学科。利用现有的分析工具和各种公共数据库,提供一条快速发现和研究新基因的新途径。而基因表达系列分析(SAGE)是通过快速和详细分析成千上万个EST(express sequenced tags)来寻找出表达丰富度不同的SAGE标签序列,发现新的未知的序列。CGAP SAGE计划建立了SAGE数据库网站(http://cgap.nci.nih.gov/SAGE),可以分析代表某条基因名称的SAGE标签表达水平。随着“肿瘤基因组解剖工程”的进行,CGAP SAGE可以通过网站分析和展示SAGE数据,并自动的将基因名称和SAGE转录物水平联系起来。因此,SAGE技术对于全面分析肿瘤组织基因表达谱、寻找肿瘤特异性表达新基因、发现肿瘤组织特异标志物和揭示肿瘤发病的分子机制发挥重要的作用[6]。本试验中,为了寻找检测乳腺癌外周血循环癌细胞的肿瘤标记物,我们在SAGE文库中选择了乳腺癌组织和正常白细胞两个池。最终筛选出23个短序列标签和长序列标签所共同代表的差异基因,然后用RT-PCR方法,对这些基因进行验证。选取10例乳腺癌和10例正常人外周血标本,理想的肿瘤标记物要求在10例乳腺癌标本中至少有两例表达,而在10例正常人标本中≤2例表达。研究结果显示在筛选过程中,主要出现以下两种情况:①有的肿瘤基因虽然在组织中高表达,但在外周血中检测阳性率非常低;②有的肿瘤基因虽然在乳腺癌外周血单个核细胞上高表达,但其在正常人外周血单个核细胞上的表达也很高,因此不能作为诊断的标记物。最后,我们得到了一个在乳腺癌外周血中高表达的新的肿瘤标记物基因NPY1R。本文中的结果也进一步证实了生物信息学分析的可靠性。
FAM83A是最新发现的肿瘤特异性抗原,在肺癌、乳腺癌和结肠癌中呈高表达,而在正常组织中均不表达。有文献[1]报道其在肺癌的外周血中大约有34%的检出率,而本研究发现,其在乳腺癌外周血中阳性检出率高达40.5%(34/84)。并且,与临床分期,淋巴结转移以及ER、PR和HER2的水平相关,提示该肿瘤标记物可用于辅助临床分期,预测转移的发生和指导乳腺癌的治疗。但是,有关该基因与乳腺癌的发病机制目前尚无报导,有待我们进一步研究。
[1]Li Y,Dong X,Yin Y,et al.BJ-TSA-9,a novel human tumor-specific gene,has potential as a biomarker of lung cancer[J].Neoplasia,2005,7(12):1073-1080.
[2]L Liu,GQ Liao,P He,H Zhu,et al.Detection of circulating cancer cells in lung cancer patients with a panel of marker genes[J].Biochem Biophys Res Commun,2008,372(4):756-760.
[3]Goldhirsch A,Glick J H,Gelber,et al.Meeting Highlights:International consensus panel on the treatment of primary breast cancer.Seventh International Conference on Adjuvant Therapy of Primary Breast Cancer[J].Clin Oncol,2001,19(18):3817-3827.
[4]Rahbari NN,Bork U,Motschall E,et al.Molecular detection of tumor cells in regional lymph nodes is associated with disease recurrence and poor survival in node-negative colorectal cancer:a systematic review and meta-analysis[J].Clin Oncol,2012,30(1):60-70.
[5]Zhang Y,Li Q,Liu N,et al.Detection of MAGE-1,MAGE-3 and AFP mRNA as multimarker by real-time quantitative PCR assay:a possible predictor of hematogenous micrometastasis of hepatocellular carcinoma[J].Hepatogastroenterology,2008,55(88):2200-2206.
[6]Ersen Kavak,Mustafa nlü,Monica Nistér,et al.Meta-analysis of cancer gene expression signatures reveals new cancer genes,SAGE tags and tumor associated regions of co-regulation[J].Nucleic Acids Res,2010,38:7008-7021.