黄芪注射液对大鼠失血性休克并内毒素所致急性肺损伤的影响
张增峰, 陈晓静, 刘 郁, 段绍斌, 居来提,吾买尔江, 于 亮, 仝传志, 董扬帆
(1.新疆医科大学附属中医医院普外一科, 新疆 乌鲁木齐 830000 2.新疆医科大学附属中医医院幸福路分院, 新疆 乌鲁木齐 830000)
失血性休克后,由于肠道缺血引起肠道粘膜屏障受损,以致细菌移位进入血液,导致肠源性菌血症和内毒素血症,这是诱发急性肺损伤(ALI)或急性呼吸窘迫综合征(ARDS)的重要因素。也是导致MODS的常见及主要原因。目前对急性肺损伤的治疗主要是病因治疗,如早期进行机械通气,或应用地塞米松、超氧化物歧化酶等激素或抗氧化剂,但目前这些药物的疗效尚不肯定。现代药理研究表明黄芪可以清除体内氧自由基、双向调节机体免疫、抗病毒、扩张血管,减少血栓形成,增加肾血流量,利尿等多种药理作用。且黄芪目前己经用于ALI的临床治疗[1],但其机制目前尚不清楚。本研究通过建立失血性休克合并内毒素所致肺损伤动物模型,采用黄芪注射液治疗急性肺损伤,探讨其作用机制,为临床治疗急性肺损伤提供一定的理论依据。
1 材料与方法
1.1 动物与分组:SD雄性大鼠(由新疆医科大学实验动物中心提供)36只,雌雄不限,体重(260±10)g,将动物随机分为三组,每组12只。A组生理盐水对照组,B组黄芪注射液低剂量组,C组黄芪注射液高剂量组。
1.2 材料与设备:黄芪注射液(每支10mL相当原生药20g,批号Z23020786)由黑龙江珍宝岛制药有限公司生产、TNF-α试剂盒 (上海西唐生物科技有限公司),IL-6试剂盒(上海西唐生物科技有限公司),高速台式离心机(LD25-2北京医用离心机厂),肝素钠、粗制大肠杆菌内毒素(1×1014个死菌/L)。手术器械及动脉插管、多导生物分析仪,输液泵等。
1.3 模型的制作及方法:大鼠标准条件喂养,实验环境温度25℃。大鼠用10%水合氯醛腹腔麻醉(3mL/kg),左侧颈总动脉并插管,外接三通,分别连接压力传感器和注射器,用于放血和监测血压,采集血标本,尾静脉置管用于给药和复苏,尾静脉注入肝素后(500μ/kg),15min内从颈动脉放血至平均动脉压(MAP)35mmHg,维持休克45min后,然后在2h内一组由尾静脉回输全部采集的血液及2倍生理盐水,另两组由尾静脉回输全部采集的血液及黄芪注射液,两组黄芪注射液皆用生理盐水稀释至所采集血液量的两倍。其中分黄芪低剂量组(黄芪注射液10g/kg)和黄芪高剂量组(黄芪注射液20g/kg),复苏结束后,从尾静脉给注入LPS1.4mg/kg,通过多导生物分析仪监测实验动物的心率、血压。2h后留取肺组织标本。
1.4 肺组织切片制备:大鼠腹腔麻醉,胸部去毛,消毒后无菌剪剪开胸腔,取右肺,剔除结缔组织,滤纸吸干表面渗液及血迹。称湿重后,置于80℃的烤箱中烘烤48h至衡重,称干重,计算湿重/干重比值(W/D)。同时取左肺组织(0.8-0.9)g,加9倍的4℃无菌生理盐水,低温制备体积分数为10%的组织匀浆,3500 r/min(离心半径8cm)离心10 min,取上清液置于-80℃冰箱内冷冻备测。分别采用大鼠TNF-α、IL-6酶联免疫吸附(ELISA)试剂盒(美国Sigma公司),严格按照说明书要求测定肺组织匀浆液TNF-α、IL-6的含量。
1.5 统计学处理:采用SPSS13.0统计软件进行统计学处理。所有数据以均数±标准差(±s)表示,采用单因素方差分析(one-way ANOVA)进行组间比较,以最小显著差异法(LSD法)进行不同组别之间的两两比较,检验水准为 а=0.05。
2 结果
黄芪注射液高剂量组肺组织匀浆中TNF-α、IL-6含量和肺W/D各项指标低于低剂量组,且两组均低于对照组。具体结果(见表1)。
表1 三组肺组织匀浆中TNF-α、IL-6含量和肺W/D的变化(±s,n=12)
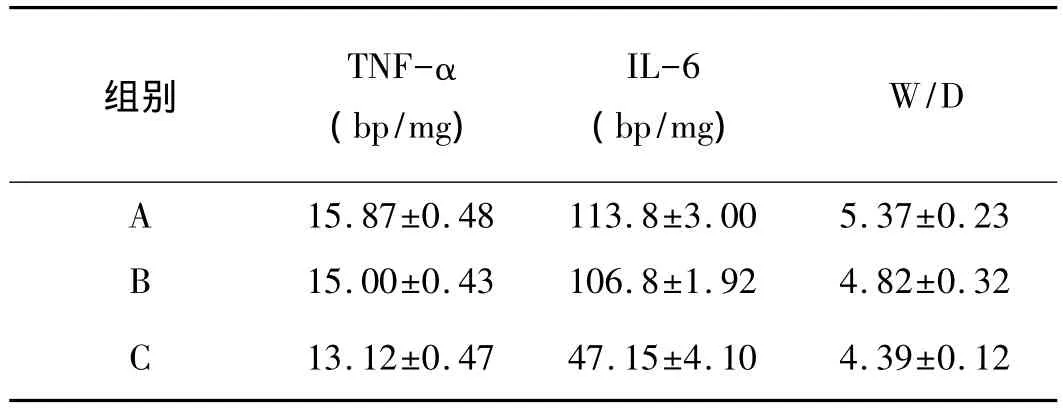
表1 三组肺组织匀浆中TNF-α、IL-6含量和肺W/D的变化(±s,n=12)
组别 TNF-α(bp/mg)IL-6(bp/mg)W/D A 15.87±0.48 113.8±3.00 5.37±0.23 B 15.00±0.43 106.8±1.92 4.82±0.32 C 13.12±0.47 47.15±4.10 4.39±0.12
3 讨论
急性肺损伤(acute lung injury,ALI)是指由严重创伤或感染等所引起的肺实质细胞损伤为主要表现的临床综合征。细菌感染所致的脓毒血症是引起急性肺损伤(ALI)的主要原因[2]。TNF-α可以激活损伤的粒细胞、内皮细胞、血小板等进一步释放氧自由基、脂质代谢产物、溶酶体酶等介质,形成瀑布样连锁反应,引起组织细胞损害,因此被认为是引起ARDS的最重要细胞因子之一[3]。多项研究说明IL-6可以作为监测炎症治疗后指标,用于评价全身性感染患者炎症反应的程度,全身性感染患者血清IL-6水平与疾病的严重程度成正相关[4]。
通过实验我们本发现黄芪注射液组肺组织匀浆中TNF-α、IL-6含量和肺W/D低于对照组,且高剂量组各项指标低于低剂量组。说明黄芪注射液对失血性休克合并内毒素所致急性肺损伤具有保护作用,且大剂量组优于低剂量组。现代药理研究表明,黄芪对机体非特异性细胞免疫和体液免疫功能有增强作用,可明显提高T细胞的增殖,促进吞噬功能[5,6]。黄芪的活性成分中黄芪总黄酮为黄芪抗氧化的主要活性成分,对多种自由基均有良好的清除作用,可预防生物膜的脂质过氧化[7]。黄芪甙可抑制内毒素引起的内皮细胞呼吸爆发和氧自由基释放,可减轻内毒素对内皮细胞膜的损伤,对细胞间连接起保护作用。黄芪多糖可抑制创伤后体内自由基诱发的脂质过氧化反应,可增强创伤小鼠体内的SOD活性[8]。
通过本实验研究结果,黄芪注射液在对失血性休克合并内毒素所致急性肺损伤起明显的保护作用,减轻了创伤后由炎性介质所介导的肺损伤,通过黄芪注射液的药理作用,可初步考虑其保护作用可能与黄芪注射液的非特异性细胞免疫、体液免疫及其活性成分对多种自由基的清除作用有关,为临床应用黄芪注射液治疗急性肺损伤提供实验依据,提高抢救成功率。
[1]顾俭勇,黄配志.黄芪对脂多糖致急性肺损伤的保护机制[J].中国临床医学,2005,12(6):1147-1149.
[2]Rene R C.The patlmgenasis of sepsis[J].Ann Intern Med,1991,115(6):457.
[3]邱海波,陈德昌.急性呼吸窘迫综合征与肿瘤坏死因子[J].国外医学:呼吸系统分册,1995,15(4):183.
[4]卞建民,王书奎,江滨,等.多种细胞因子监测对严重感染患者的意义[J].中国危重病急救医学,2002,14(6):353.
[5]储大同,孙燕,林娟如,等.黄芪提取成分对癌症患者淋巴细胞免疫功能恢复及对大鼠免疫抑制逆转的作用[J].中西医结合杂志,1998,9(6):351-354.
[6]沈美玲,翟世康,罗英德,等.黄芪多糖生物活性的初步研究[J].中西医结合杂志,1984,4(10):615-617.
[7]陈聪颖,陆阳,陈泽乃.内蒙黄芪的研究概况[J].中草药,2001,32:567-569.
[8]孙成文,钟国赣,江岩,等.中国药理学通报,1996,12(2):161-163.