人尿激肽原酶治疗急性脑梗死临床疗效观察
王 静 赵月月
1)解放军第四六三医院神经内科 沈阳 110042 2)解放军95895部队卫生所 新民 110315
急性脑梗死是中老年患者多发的一种常见疾病,其发病率有逐年增高趋势,因其致残率高、治愈率低、恢复慢,严重影响病人生活质量。目前用于治疗该病的药物及治疗方法较多,但疗效不一[1]。人尿激肽原酶(human urinary kallikrein)是一种通过激肽原酶-激肽系统而发挥治疗作用的药物,我科从2009-01—2010-01采用人尿激肽原酶注射剂治疗60例急性脑梗死患者,取得较理想治疗效果,现将结果报道如下。
1 资料与方法
1.1入选标准(1)首发急性脑梗死,4≤NIHSS≤20;(2)≥18岁的住院病人,性别不限;(3)发病后48h内;(4)脑CT排除出血可能;(5)签署知情同意书。排除标准:(1)NIHSS≤3或NIHSS≥21;(2)以往有脑肿瘤、脑外伤及其他脑部病变者,2a内有脑出血病史;(3)心功能不全者,慢性肝病(A/G倒置),ALT升高(大于正常值1.5倍),血肌酐升高(大于正常值1.5倍);(4)近期患出血性疾病或有出血倾向者;(5)过敏体质或对多种药物过敏者,妊娠期或哺乳期妇女。
1.2一般资料用随机数字法将2009-01—2010-01住院的急性脑梗死患者随机分为2组,实验组60例,年龄45~80岁,平均(61±10)岁;对照组60例,年龄48~81岁,平均(62±9)岁。
1.3治疗方法实验组采用人尿激肽原酶(通用名:尤瑞克林,商品名:凯力康,广东天普生化医药股份有限公司)0.15 PNAU加入生理盐水100mL静滴(1h滴完)共14d,以及丹参川芎嗪(贵州拜特制药有限公司)10mL加入生理盐水250mL静滴,qd,14d;对照组则采用丹参川芎嗪联合奥扎格雷钠氯化钠注射液(石家庄四药有限公司)80mg,qd,共14 d。观察期根据患者的病情,可酌情使用脱水剂、利尿药、降压药、他汀类调脂药物和抗血小板药物。在用药前24h和整个用药周期内,禁止使用血管紧张素转化酶抑制剂(ACEⅠ)类降压药物,治疗前后监测血压、血尿常规、血糖、血脂、肝肾功能,并详细记录不良反应。
1.4疗效评定于治疗前后采用NIHSS评定患者神经功能缺损程度,mRS评定患者残障程度。临床疗效根据治疗前后NIHSS评分的变化及残障水平评定:(1)基本痊愈,NIHSS评分减少90%~100%,残障水平0级;(2)显著进步,NIHSS评分减少46%~89%,残障水平1~3级;(3)进步,NIHSS评分减少18%~45%;(4)无变化,NIHSS评分减少或增加<18%;(5)恶化,NIHSS评分增加≥18%;(6)死亡。
1.5统计学处理数据采用SPSS 13.0统计软件处理,所有数据用(s)表示,治疗前后NHISS和mRS的评分采用t检验,2组的治疗效果比较采用四格表卡方检验,P<0.05认为差异有统计学意义。
2 结果
2组患者的年龄、性别及治疗前神经功能缺损程度经统计学检验无显著差异性(P>0.05),具有可比性。治疗14d后,实验组和对照组平均NIHSS评分及mRS评分均较治疗前明显降低(P<0.01),见表1;但2组疗效经卡方检验,实验组总有效率83.3%较对照组46.7%治疗效果更好,差异具有统计学意义(P<0.01),见表2。治疗期间实验组1例患者出现上腹部不适、恶心症状,经减慢滴速后症状缓解;另1例在静滴尤瑞克林期间自行上卫生间,站立后突然出现言语不清、偏瘫加重,急测血压80/50mmHg,立即给予心电、血压监护,多巴胺静推,血压升至130/70mmHg后上述症状逐渐缓解。治疗前、后2组的实验室各项指标(血常规、尿常规、大便常规、肝肾功能、空腹血糖)均无显著性变化。
表1 2组治疗前后NIHSS和mRS的变化 (s)
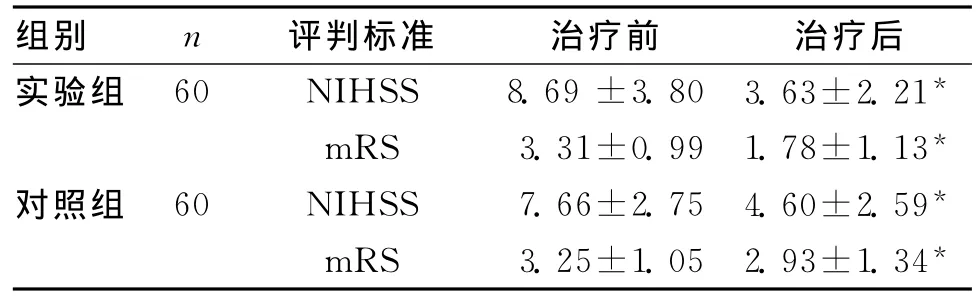
表1 2组治疗前后NIHSS和mRS的变化 (s)
注:*P<0.01
组别 n 评判标准 治疗前 治疗后实验组 60 NIHSS 8.69±3.80 3.63±2.21*mRS 3.31±0.99 1.78±1.13*对照组 60 NIHSS 7.66±2.75 4.60±2.59*mRS 3.25±1.05 2.93±1.34*

表2 治疗后2组疗效比较 [n(%)]
3 讨论
尤瑞克林是由健康男性尿液中提取的糖蛋白,它通过激肽-激肽原酶系统(kallikrein-kinin system,KKS)发挥作用,该系统在动物体内广泛存在,参与机体的炎症与应激等病理生理反应。近来的研究发现,KKS系统在脑卒中患者体内被异常激活,使脑卒中患者的激肽水平明显高于正常人,提示该系统在缺血性脑损伤中具有一定作用[2]。尤瑞克林作为组织型激肽原酶作用于激肽原,产生十肽物质(KBK),十肽物质在激肽酶的作用下产生九肽调节物(DK),从而发挥功效。其机制可能有:(1)选择性扩张脑缺血部位血管,增加血液区血液灌注,改善缺血脑组织能量和氧供应[3]。激肽原酶-激肽系统是通过受体发挥其活性的,受体有B1、B2两类。而B1受体可在组织缺血损伤后,由损伤组织血管内皮细胞诱导,大量生成。而九肽调节物(DK)对B1受体具有高亲和性,从而高选择性的作用于B1受体,靶向性扩张脑梗死缺血区细小动脉,改善缺血和损伤部位的血供、氧供[4]。(2)促进脑缺血后局部血管再生。激肽原酶-激肽系统在血管发育和血管修复等方面具有重要作用[5-8]。组织型激肽原酶被证明是一种促血管再生因子,局部组织缺血后,内源性组织型激肽原酶水平上升,外源性补充激肽原酶能更有效地促进局部血管再生[9-11]。有研究表明,遗传性激肽受体缺乏症能使缺血区无法形成新生血管,故激肽受体在促进缺血组织新生血管形成中起着重要作用[12-13]。在急性缺血性脑卒中时,激肽受体常处于高表达状态,能使新生血管的形成增多,有效建立侧支循环,改善缺血区血液灌注。(3)促进脑缺血后的神经再生。体内实验已证实,组织型激肽原酶基因治疗能促进局部缺血脑组织内的胶质细胞存活并从缺血半暗带向核心区迁移,以及促进局部缺血脑组织内增殖细胞核抗原标记的细胞表达增多。体外实验进一步发现,激肽能以剂量依赖方式显著增加能与Brdu结合的神经元数量,提示激肽可刺激原代培养的神经元增殖,即激肽原酶-激肽系统具有促进脑缺血后神经再生的作用[14]。(4)对缺血脑组织的神经保护作用。激肽原酶-激肽系统可能通过激活内皮型一氧化氮合酶使NO产生增加,后者在缺血脑组织中能抑制NADPH氧化酶的活性,减少活性氧生成,并由此减少缺血诱导的神经细胞凋亡,从而提高胶质细胞的存活率,促使其从缺血半暗带向缺血核心区迁移,最终对缺血性卒中起神经保护作用[14-15]。
本临床实验中,1例出现上腹部不适、恶心症状,减慢滴速后症状缓解,考虑与滴速过快有关;另1例去卫生间时出现体位性低血压,经静推多巴胺升压治疗后症状缓解,因未合用ACEI类降压药,故该反应考虑与输液速度过快、体位突然改变有关。有实验用同样剂量人尿激肽原酶给麻醉狗作静脉注射和滴注,比较二者对血压和脉率的影响,发现静脉注射能明显降低血压和增加脉率,但滴注则反应轻微[16]。故建议控制输液速度在60min以上,且要求患者静滴时及静滴后30min卧床,禁止下地活动。尤瑞克林治疗急性脑梗死安全、有效,给临床医生提供了一个新的治疗方案,值得推广应用。
[1]潘更毅,史岩 .急性脑梗死个体化早期康复治疗的临床分析[J].中国实用神经疾病杂志,2008,11(2):81-82.
[2]Wagner S,Kalb P,LukosavaM,et al.Activation of the tissue kallikrein-kinin system in stroke[J].J Neurol Sci,2002,202:75-76.
[3]Nagano H,Suzuki T,Tomoguri T,et al.Pharmacological studies on human urinary kallidinogenase(SK-827):effects on cerebral metabolism[J].Yakugaku Zasshi,1993,113:825-828.
[4]Campbell DJ.The kallikrein-kinin system in humans[J].Clin Exp Pharmacol Physiol,2001,28:1 060-1 065.
[5]Perez V,Leiva-Salcedo E,Acuna-Castillo C,et al.T-kininogen induces endothelial cell proliferation[J].Mech Ageing Dev,2006,127:282-289.
[6]Milkiewicz M,Ispanovic E,Doyle JL,et al.Regulators of angiogernesis and strategies for their therapeutic manipulation[J].Int J Biochem Cell Biol,2006,38:333-357.
[7]Emanueli C,Madeddu P.Angiogenesis therap with human tissue kallikrein for the treatment of ischemic diseases[J].Arch Mal Coeur Vaiss,2004,97:679-687.
[8]Emanuelia C,Madeddu P.Human tissue kallikrein:a new bullet for the treatment of ischemia[J].Curr Pharm Des,2003,9:589-597.
[9]Porcu P,Emanueli C,Kapatsoris M,et al.Reversal of angiogenic growth factor upregulation by revascularization of lower limb ischemia[J].Circulation,2002,105:67-72.
[10]Emanueli C,Minasi A,Zacheo A,et al.Local delivery of human tissue kallikrein gene accelerates spontaneous angiogenesis in mouse model of hindlimb ischemia[J].Circulation,2001,103:125-132.
[11]Emsnueli C,Salis MB,Stacca T,et al.Rescue of impaired angiogenesis in spontaneously hypertensive rats by intramuscular human tissue kallikreingene transfer[J].Hypertension,2001,38:136-141.
[12]Emanueli C,Bonaria SalisM,Stacca T,et al.Targeting kinin B1receptor for therapeutic neovascularization[J].Circulation,2002,105:360-366.
[13]Lumenta DB,Plesnila N,Klasner B,et al.Neuroprotective effects of a postischemic treatment with a bradykinin B2receptor antagonist in a rat model of temporary focal cerebral ischemia[J].Brain Res,2006,1 069:227-234.
[14]Xia CF,Yin H,Yao YY,et al.Kallikrein protects against ischemic stroke by inhibiting apoptosis and inhibiting apoptosis and promoting angiogenesis and neurogenesis[J].Hum Gene Ther,2006,17:206-219.
[15]Xia CF,Yin H,Borlongan CV,et al.Kallikrein gene transfer protects against ischemic stroke by promoting glial cell migration and inhibiting apoptosis[J].Hypertension,2004,43:452-459.
[16]Suzuki T,Hirooka K,Nakamura S,et al.Pharmacological studies of human urinary kallidinogenase(SK-827):effects on arterial and regional blood flow[J].App Pharmacol,1993,45:367-373.

