老年患者腹腔镜与开腹远端胃癌D2根治术的疗效比较
金太欣,肖新波
(武汉市第一医院,湖北 武汉,430022)
胃癌是我国常见的消化道恶性肿瘤,随着年龄的增加,胃癌患病率逐渐增高[1-2]。自1994年日本学者Kitano等[3]首次报道为早期胃癌患者行腹腔镜胃癌根治术后,由于具有明显的微创优势,且取得了与开腹手术相当的近、远期疗效,腹腔镜胃癌根治术开展得越来越多,手术适应证逐渐放宽。由于老年胃癌患者全身机能储备降低,且并存多系统的慢性内科疾病,手术耐受力较低,而且腹腔镜胃癌根治术手术切除范围大,手术难度高,目前在老年胃癌患者中开展顾虑较多。本研究通过回顾分析2009年3月至2013年3月我院胃肠外科为老年远端胃癌患者行腹腔镜或开腹D2根治术的临床资料,评价两种术式治疗老年远端胃癌患者的安全性及有效性。
1 资料与方法
1.1 临床资料 老年远端胃癌患者96例中男58例,女38例;65~87岁,均行远端胃癌D2根治术。病例选择标准:术前患者均经胃镜病理确诊为胃癌,并行胸片、腹部CT、盆腔超声进行临床分期,病变部位均为日本胃癌学会《胃癌处理规约》(JGCA14版)[4]的胃下部癌或胃中下部癌,临床TNM病理分期在ⅢB分期以内。采用随机对照原则,结合患者意愿选择行腹腔镜手术或开腹手术。38例患者行腹腔镜手术(腹腔镜组),58例患者行开腹手术(开腹组)。病例纳入标准:(1)一般情况可耐受手术;(2)无远处转移;(3)肿瘤直径<10 cm,浆膜层受侵面积<10 cm2;(4)无淋巴结转移灶融合并包绕重要血管和(或)肿瘤与周围组织器官广泛浸润[4];(5)患者知情同意。病例排除标准:(1)伴远处转移;(2)未行D2淋巴结清扫;(3)腹腔镜手术中转开腹;(4)由于肿瘤侵犯周围组织而行联合脏器切除术。两组患者一般资料见表1,两组相比差异无统计学意义(P>0.05),具有可比性。
表1 两组患者一般资料的比较(±s)
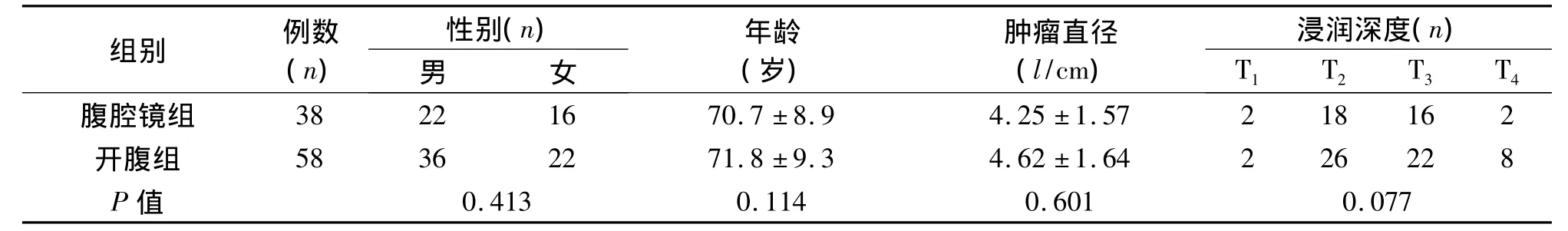
表1 两组患者一般资料的比较(±s)
组别 例数(n)性别(n)(岁)肿瘤直径(l/cm)年龄 浸润深度(n)男 女T1 T2 T3 T4腹腔镜组0.413 0.114 0.601 0.077 38 22 16 70.7 ±8.9 4.25 ±1.57 2 18 16 2开腹组 58 36 22 71.8 ±9.3 4.62 ±1.64 2 26 22 8 P值
1.2 手术方法 两种术式均严格遵循无瘤原则[5]:(1)强调肿瘤及周围组织的整块切除;(2)肿瘤操作的非接触原则;(3)足够的切缘;(4)足够的淋巴结清扫。两组手术均由胃外科手术经验丰富的同一团队完成。
1.2.1 腹腔镜组 均气管插管全麻,患者取平卧分腿位。脐下缘为观察孔,切开皮肤约10 mm,建立CO2气腹,压力维持在13 mmHg,穿刺10 mm Trocar,置入30度腹腔镜,探查腹腔。左侧腋前线肋缘下2 cm处穿刺10 mm Trocar为主操作孔,左锁骨中线平脐水平偏内侧穿刺5 mm Trocar为牵引孔;分别于右侧腋前线偏内侧肋缘下2 cm及右锁骨中线平脐水平偏内侧穿刺5 mm Trocar为助手的牵引孔。术者常规立于患者左侧。剥离横结肠系膜前叶,依次清除结肠中动脉旁淋巴结(N15)、肠系膜根部淋巴结(N14)。剥除胰腺被膜,切断胃网膜右血管根部并清除第6组淋巴结(N6)。近肝游离肝胃韧带,裸化肝十二指肠韧带,清除第12组(N12a、N12b和N12p)及第5组、第8组淋巴结。游离、切断十二指肠后壁与胰头间的小血管,用腔镜直线切割缝合器切断十二指肠球部。掀起胃体及大网膜,清除第7组、第11组淋巴结,切断胃左动脉,向下游离腹腔干,清除第9组淋巴结。闭合切断胃短及胃后血管,清除第1组、第3组淋巴结。关闭气腹,取上腹正中小切口入腹,距癌肿上缘5.0~8.0 cm处横断胃体,行胃空肠吻合重建消化道。
1.2.2 开腹组 均气管插管全麻,患者取平卧位。取上腹正中切口左绕脐,常规进腹,探查腹腔。根据日本胃癌协会制定的《胃癌处理规约》(JGCA14版)第14版胃癌淋巴结分组分站,进行D2淋巴结清扫,清扫范围及重建消化道方式同腹腔镜组。
1.3 观察指标 (1)一般指标:性别、年龄、肿瘤直径、肿瘤浸润深度;(2)手术安全性及可行性的相关指标:手术时间,术中出血量,术后肛门排气时间,术后住院时间,术后第3天白细胞计数、C反应蛋白、谷丙转氨酶,术后并发症;(3)肿瘤根治性指标:清扫淋巴结数量。
1.4 统计学处理 采用SPSS 17.0统计软件包进行统计分析,计量资料以(±s)表示,计数资料以率表示,进行t检验及χ2检验(Chi-square test),P<0.05为差异有统计学意义。
2 结果
2.1 两组患者术中及术后情况的比较 两组患者均无术中死亡病例,标本切缘均为阴性。两组手术时间差异无统计学意义(P>0.05);腹腔镜组术中出血量、肛门排气时间及术后住院时间均低于开腹组,差异有统计学意义(P<0.05),见表2。
2.2 两组患者术后白细胞计数、C反应蛋白及谷丙转氨酶的比较 腹腔镜组患者术后第3天白细胞计数、C反应蛋白及谷丙转氨酶均低于开腹组,差异有统计学意义(P<0.05),见表2。
2.3 两组患者淋巴结清扫情况的比较 根据14版日本胃癌规约(JGCA14版)分站方法,两组患者淋巴结清扫总数、第一站及第二站淋巴结数量差异均无统计学意义(P>0.05)。见表3。
2.4 两组术后并发症 两组患者均无死亡病例。腹腔镜组术后切口并发症、肺部及总并发症发生率均低于开腹组,差异有统计学意义(P<0.05)。见表3。其他并发症,如尿路感染、术后肠梗阻、胃瘫、淋巴漏等,因例数较少,未进行统计。
表2 两组患者手术指标及术后第3天白细胞计数、C反应蛋白、谷丙转氨酶的比较(±s)
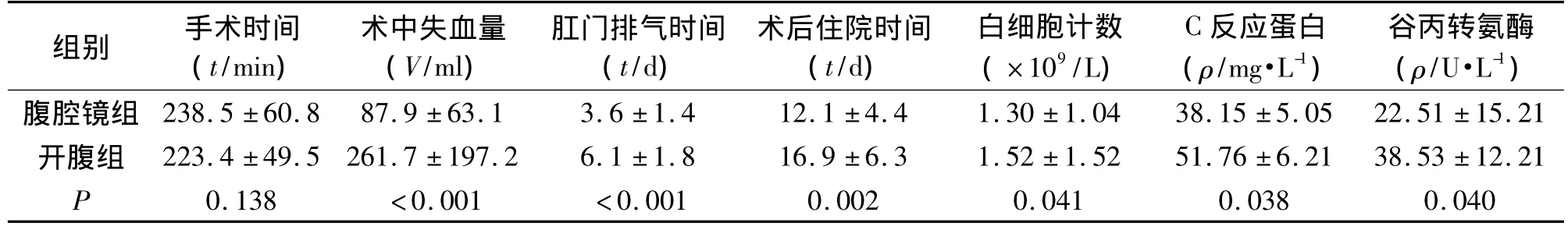
表2 两组患者手术指标及术后第3天白细胞计数、C反应蛋白、谷丙转氨酶的比较(±s)
组别 手术时间(t/min)术中失血量(V/ml)肛门排气时间(t/d)术后住院时间(t/d)白细胞计数(×109/L)C反应蛋白(ρ/mg·L-1)谷丙转氨酶(ρ/U·L-1)腹腔镜组 238.5 ±60.8 87.9 ±63.1 3.6 ±1.4 12.1 ±4.4 1.30 ±1.04 38.15 ±5.05 22.51 ±15.21开腹组 223.4 ±49.5 261.7 ±197.2 6.1 ±1.8 16.9 ±6.3 1.52 ±1.52 51.76 ±6.21 38.53 ±12.21 P 0.138 <0.001 <0.001 0.002 0.041 0.038 0.040
表3 两组患者淋巴结清扫数量及术后并发症的比较(±s)
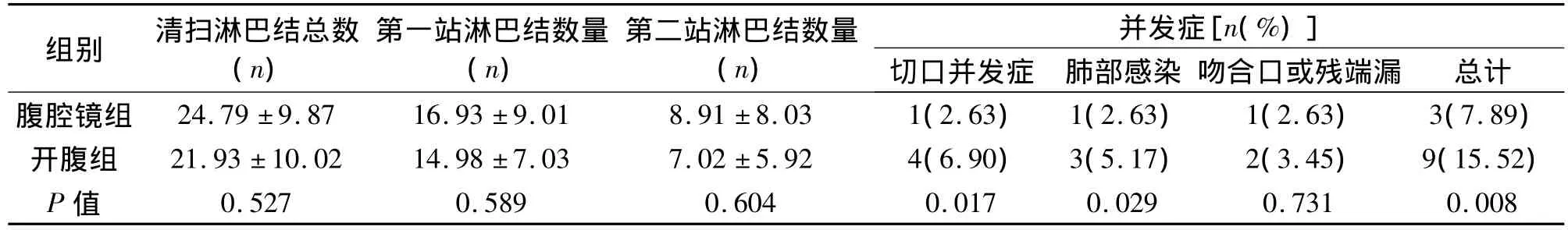
表3 两组患者淋巴结清扫数量及术后并发症的比较(±s)
并发症[n(%)]切口并发症 肺部感染 吻合口或残端漏 总计腹腔镜组 24.79 ±9.87 16.93 ±9.01 8.91 ±8.03 1(2.63) 1(2.63) 1(2.63) 3(7.89)组别 清扫淋巴结总数(n)第一站淋巴结数量(n)第二站淋巴结数量(n)开腹组 21.93 ±10.02 14.98 ±7.03 7.02 ±5.92 4(6.90) 3(5.17) 2(3.45) 9(15.52)P值0.527 0.589 0.604 0.017 0.029 0.731 0.008
3 讨论
近几十年,虽然西方国家的胃癌发病率持续下降,但在以中国、日本、韩国为代表的东亚国家,其发病率及肿瘤死亡率仍居高不下,2008年全球新发胃癌患者接近100万,居于最常见恶性肿瘤第四位、肿瘤死亡原因的第二位。令人遗憾的是,全球胃癌患者约一半在中国,其发病率随患者年龄的增长而升高,中老年人高发。随着我国老龄化进程的加快,老年胃癌患者的预防诊治已成为需高度关注的重大公共卫生问题。
胃癌微创治疗的目的是在确保外科根治性治疗的前提下,将手术创伤最小化及术后生命质量最大化。1992年Goh等[6]首次报道采用腹腔镜行远端胃切除术(毕Ⅱ式吻合)。随着腹腔镜技术的不断发展,腹腔镜胃癌根治术在日本、韩国等得到较广泛的开展,日本已将腹腔镜胃癌根治术作为早期胃癌的标准术式之一[7]。但对于老年胃癌患者,由于进展期胃癌的比例高,患者心肺功能较差,合并症较多,尤其对气腹耐受性差,手术时间较长,限制了腹腔镜胃癌根治术在老年胃癌患者中的应用。自2008年以来我院逐渐开展了腹腔镜胃癌根治术,取得良好的效果,在老年人腹腔镜胃癌根治术方面获得了丰富的经验。
本研究结果显示,腹腔镜组术中出血量、肛门排气时间及术后住院时间均低于开腹组,术后白细胞计数、C反应蛋白、谷丙转氨酶数值也低于开腹组,充分体现了腹腔镜胃癌D2根治术的微创优势。腹腔镜手术并不增加并发症的发生率,Park等[8]报道300例腹腔镜胃癌手术,其中4例发生肺部并发症,发生率为1.3%。Lee等[9]对24例腹腔镜胃癌手术、23例开腹手术进行了前瞻性随机对比分析,认为腹腔镜组肺部并发症发生率为8.3%,而开腹组为30.4%,差异有统计学意义。老年患者胃癌根治术,由于切口大,手术创伤大,组织愈合能力差,再加之患者常合并慢性支气管炎,术后由于疼痛、咳嗽无力等因素导致排痰不畅,因此肺部感染及切口并发症较多见。本研究中,腹腔镜组切口并发症、术后肺部感染率及总并发症发生率均低于开腹组,差异有统计学意义。我们考虑这与腹腔镜手术创伤小、切口疼痛轻、患者康复快、完全卧床时间短等因素有关。
我们认为,腹腔镜具有良好的放大作用,可显示更为精细的脉管、神经及筋膜等结构,不但创伤小、出血少,而且镜下淋巴清扫较开腹手术更精细、彻底。对于传统开腹手术中较困难的操作,如保留脾脏的脾门淋巴结清扫、贲门及胃底区的显露、深在位置血管的暴露等,腹腔镜手术甚至优于开腹手术。Tanimura等[10]发现,进展期胃癌行开腹手术与腹腔镜手术在清扫淋巴结数量方面差异无统计学意义,且两组治愈率相似,因此他们认为,腹腔镜手术治疗进展期胃癌可达到与开腹手术相同的根治效果。本研究中,腹腔镜组淋巴结清扫总数、第一及第二站淋巴结数量与开腹组相比差异无统计学意义,相信随着腹腔镜胃癌手术的广泛开展,术者对腹腔镜下解剖层次的进一步熟悉,手术技巧的不断提高,“学习曲线”的延长,镜下淋巴清扫效果会更加满意。
随着微创器械设备的不断进步及微创外科医师手术经验的积累,腹腔镜胃癌手术的适用范围也在逐渐拓展。目前已被认可的腹腔镜胃癌根治性手术的适应证为肿瘤浸润深度在T2以内的胃癌患者,本研究中腹腔镜组38例胃癌患者按TNM分期为Ⅰ期2例、Ⅱ期18例、Ⅲ期16例、Ⅳ期2例,与开腹组相比,近期淋巴结清扫效果及吻合口漏、残端漏无明显差异。因此我们认为,在现有的腹腔镜设备条件下,对于具有丰富胃肠外科经验及熟练腹腔镜操作技巧的医师而言,腹腔镜胃癌根治术的指征可适当放宽,T4以内的胃癌行腹腔镜手术是安全、可行的。
由于老年患者自身的生理特点,腹腔镜老年胃癌根治术需采取特殊对策。因老年患者肺顺应性下降,气腹可引起体内CO2的吸收,引发高碳酸血症、酸中毒,因此气腹压力应维持在12~13 mmHg;避免压力过大,以免导致CO2过量吸收,同时术中采用PEEP正压通气,术后予以适当的支持治疗,利于通气障碍在术后短期内恢复。老年患者常伴有动脉硬化,组织较脆,牵拉组织力度应适当,分离血管时脉络化即可,以防渗血严重。术中避免触碰、挤压肿瘤,如肿瘤侵犯浆膜层,镜下可喷洒“福爱乐”凝胶,以减少肿瘤播散转移。在腹腔镜胃癌根治术中,如切割分离已被肿瘤浸润的组织,清扫已发生转移的淋巴结,应尽可能将超声刀设置在较低功率(3档以下),每次切割的时间最好控制在8 s以内。我们术中常规放置空肠营养管,将鼻肠营养管插入距屈氏韧带或吻合口下方30~40 cm远端空肠处,术后进行肠内营养支持治疗。方法简单有效,可明显促进肠功能恢复,对改善机体的营养状况具有积极作用。在消化道重建时,注意保证吻合口处食管、空肠血运良好且无张力,充分引流腹腔,保证食管空肠吻合口周无渗液积存、感染,有助于吻合口漏的预防。
本研究显示,年龄因素并非老年胃癌患者行腹腔镜手术的禁忌证,通过术前系统评估、多学科联合确定治疗与并发症的防治方案,仔细筛选患者,掌握中转开腹的时机与指征是对腹腔镜手术的完善及提高手术安全性的重要手段。我院常规进行术前多系统评估,包括心脏超声、肺功能检查(不论是否合并心、肺、脑疾病)、积极控制糖尿病与心脑血管基础疾病、多学科综合制定个体化的围手术期治疗方案与应急预案,术后常规在病房进行严密监护与心肺功能恢复,最大限度地降低了手术相关并发症发生率与死亡率。
总之,老年远端胃癌患者行腹腔镜D2根治术微创优势明显,淋巴清扫效果满意,符合肿瘤根治原则,其近期疗效优于传统开腹手术,远期疗效尚在继续观察中。相信随着操作经验的不断积累及新技术设备的不断涌现,老年患者腹腔镜远端胃癌D2根治术会更加成熟。
[1]Edge SB,Compton CC.The American Joint Committee on Cancer:the 7th edition of the AJCC cancer staging manual and the future of TNM[J].Ann Surg Oncol,2010,17(6):1471-1474.
[2]Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277-300.
[3]Kitano S,Iso Y,Moriyama M,et al.Laparoscopy-assisted Billroth I gastrectomy[J].Surg Laparosc Endosc,1994,4(2):146-148.
[4]郑民华,藏路.腹腔镜胃癌根治术的现状[J].腹腔镜外科杂志,2010,15(3):161-163.
[5]李国新,余江.腹腔镜胃癌手术的无瘤技术[J].腹腔镜外科杂志,2010,15(3):164-165.
[6]Goh P,Tekant Y,Isaac J,et al.The technique of laparoscopic Billroth Ⅱ gastrectomy[J].Surg Laparosc Endosc,1992,2(3):258-260.
[7]Shiraishi N,Yasuda K,Kitano S.Laparoscopic gastrectomy with lymph node dissection for gastric cancer[J].Gastric Cancer,2006,9(3):167-176.
[8]Park JM,Jin SH,Lee SR,et al.Complications with laparoscopically assisted gastrectomy:multivariate analysis of 300 consecutive cases[J].Surg Endosc,2008,22(10):2133-2139.
[9]Lee JH,Han HS,Lee JH.A prospective randomized study comparing open vs laparoscopy-assisted distal gastrectomy in early gastric cancer:early results[J].Surg Endosc,2005,19(2):168-173.
[10]Tanimura S,Higashino M,Fukunaga Y,et al.Laparoscopic gastrectomy with regional lymph node dissection for upper gastric cancer[J].Br J Surg,2007,94(2):204-207.

