二氢杨梅素对MDA-MB-231人乳腺癌细胞端粒酶活性的影响
赛 娜,周防震
湖北民族学院生物科学与技术学院(湖北恩施445000)
近年来一些国内学者对藤茶活性成分二氢杨梅素(Dihydromyricetin,DMY)的体外抗肿瘤作用进行了研究,其抗肿瘤作用基本得以肯定[1-4],但对其作用机制的认识尚不完全清楚。端粒酶是合成染色体末端的端粒酶,由RNA和蛋白质亚基组成,是基本的核蛋白逆转录酶,在细胞染色体复制过程中,能够以自身RNA为模板,在染色体3’末端合成重复序列,维持端粒的长度。端粒酶在正常体细胞中的活性被抑制,但是大量的资料表明在一些恶性肿瘤中的表达高达85%。端粒酶在肿瘤的发生发展中有着重要作用,成为现代肿瘤研究的一个新热点。本文采用端粒重复序列扩增法(Telomeric repeat ampli-cation protocol,TRAP)法和实时定量 PCR(Real-Time PCR)法检测DMY对人乳腺癌细胞MDA-MB-231端粒酶活性的影响。
1 材料与方法
1.1 材料及主要设备 人MDA-MB-231乳腺癌细胞株由暨南大学生物工程研究所提供;PCR仪为BioRad公司产品;DMY为华南理工大学工业研究院张晓元副教授提供(HPLC,96.3%);BCA蛋白质定量试剂盒购于碧云天生物公司;PrimeScript RTPCR kit、SYBR Premix Ex Taq和DL2000 DNA Marker购于TaKaRa大连宝生物工程有限公司。BIORAD Chrom4 Real-timePCR System和BioPhotometer生物分光光度计分别为BIORAD和Eppendorf公司产品。
1.2 细胞培养 收集对数生长期MDA-MB-231细胞,以1.0×105/2 mL传代于6孔细胞培养板中,待细胞50%铺满时,加入含0、10、20和40 μg/mL的DMY的DMEM培养液(含10%FBS),继续培养48h。
1.3 细胞端粒酶的提取 用0.25%的胰酶消化细胞,用PBS洗涤细胞2次,2000 r/min,5 min离心收集细胞(1×106-2×106);将细胞沉淀物重悬于200 ul预冷的细胞裂解液中,冰浴30 min;4℃离心(20 000 g,30 min);转移上清,分装3~4管,每管约10 μl。其中一份样品进行蛋白质浓度测定,其余迅速冷冻,-80℃保存。
1.4 TRAP 分析
1.4.1 蛋白质定量分析 对抽提的产物进行蛋白定量,将蛋白的浓度稀释至 0.5 μg/μl,以便使各处理组TRAP分析比较时蛋白质总量保持在同一水平。
1.4.2 端粒酶活性测定 按文献报道,利用TRAP方法测定端粒酶活性[5]。逆转录:5 μg/25 μl反应体系(其中 10 ×TRAP buffer 2.5 μl、Ts Primer 1.8 μl、dNTP 0.5 μl、端粒酶提取物 0.5 μl,DEPC 水19.7 μl),30 ℃ 60 min,94℃ 120 s,进行引物延伸。循环体系:在第一步的体系中加入10×TRAP buffer 2.5 μl、Ts 和 Acx Primer各 1.8 μl、dNTP 0.5 μl、Taq酶 0.4 μl、DEPC 水 18 μl,体系总体积为 50 μl,进行PCR 扩增:94 ℃ 预变性 1 min,94℃ 30 s,60℃ 60 s,72℃ 60 s,共45循环,72℃继续延伸5 min。
1.4.3 TRAP产物的非变性聚丙烯酰胺凝胶电泳制备15%非变性聚丙烯酰胺凝胶6 mL(37%Acr-Bis(29∶1)3 mL、ddH2O 1.752 mL、5×TBE 1.2 mL、10%APS44 μL、TEMED 4 μL),取 20 μl PCR 产物加5 μl10×上样缓冲液,点样于15%非变性聚丙烯酰胺凝胶中,0.5×TBE电泳缓冲溶液80V恒压电泳1~2 h。
1.4.4 银染 将凝胶置50%冰醋酸固定10min,然后用重蒸水漂洗3次,每次10 s;将凝胶置于2%的硝酸中5 min,然后用超纯水漂洗3次,每次10 s;将凝胶置于硝酸银染液中30min,然后用超纯水漂洗3次,每次10s;将凝胶置于显色液中,显色5min,直到出现条带,10%冰醋酸终止反应10 min,观察结果。
1.5 Real-time PCR 分析
1.5.1 总RNA提取及cDNA反转录 各处理组细胞培养同3,按试剂盒说明,进行总RNA提取。取2 μl RNA 溶液于198 μl DEPC水,于BioPhotometer生物分光光度计下测定260 nm吸光值,以公式:RNA浓度(μg/μl)=OD260×40 ÷1000 ×100,计算 1 μg总RNA的模板需要量(μl)=1/(OD260×4)。各处理组均取1 μg总RNA进行cDNA反转录反应。所有cDNA样本-20℃保存备用。
1.5.2 引物设计及Real-time PCR 根据NCBI网站公布的序列设计端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)基因扩增引物,引物跨内含子(具体序列及扩增片段大小见表1),并由上海生工进行引物合成。
以18 S rRNA作为内部参照物,采用20 μl反应体系,其中SYBR Premix Ex TaqTM10μl,上下游引物(10μM)各0.4μl,cDNA 模板 8ng(1.6μl),超纯水7.6 μl。Real-time PCR 反应条件如下:95℃ 35 s;60℃ 15 s;72℃ 15 s;Plate read;Goto 2,39 more times;72℃ 5 min;Melting curve from 55℃ to 95℃0.5℃/s;End。每个样品重复3次。采用2-△△Ct方法[6]分析数据h TERT基因相对表达量。
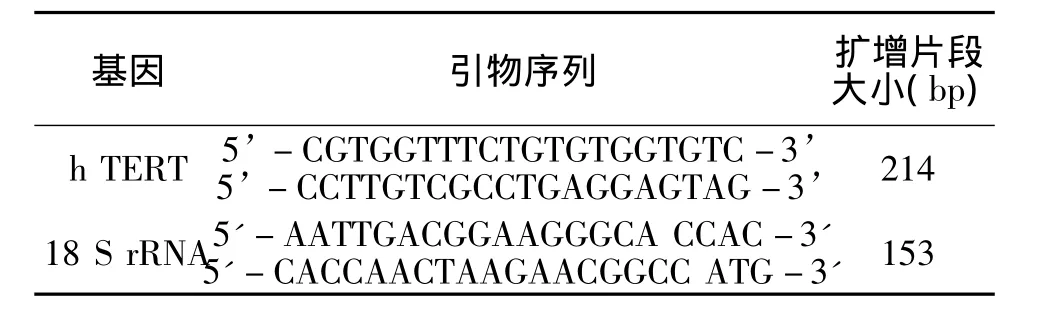
表1 Real-time PCR所用引物及序列
2 结果
2.1 TRAP法检测DMY对MDA-MB-231细胞端粒酶活性的影响 用不同浓度(10、20和40 μg/ml)的DMY处理MDA-MB-231细胞48 h后,利用TRAP银染法分别检测MDA-MB-231细胞的端粒酶活性,结果发现,随着 DMY浓度的增加,DMY抑制MDA-MB-231细胞端粒酶活性的作用增强,且具有明显浓度依赖关系。阴性对照处理组未见端粒酶的扩增条带,而阳性对照(细胞培养过程中,未加DMY处理)组扩增条带最多,表现出强的端粒酶活性(图1)。
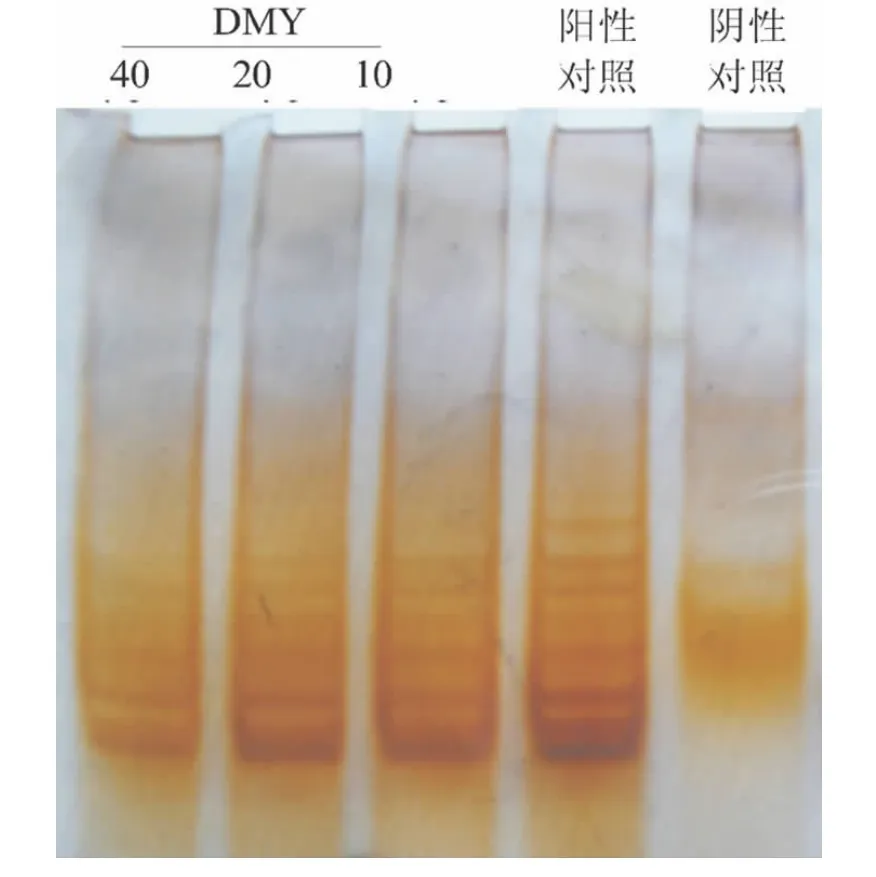
图1 DMY对MDA-MB-231细胞端粒酶活性的影响
2.2 Real-time PCR法检测DMY对MDA-MB-
231细胞hTERT mRN表达的影响 各处理组端粒酶催化亚单位hTERT cDNA扩增产物专一性良好;将Real-time PCR扩增的产物进行1.8%琼脂糖凝胶电泳检测PCR产物专一性及大小,结果显示扩增片段长度为214 bp,与设计长度一致,无非特异扩增(图2)。
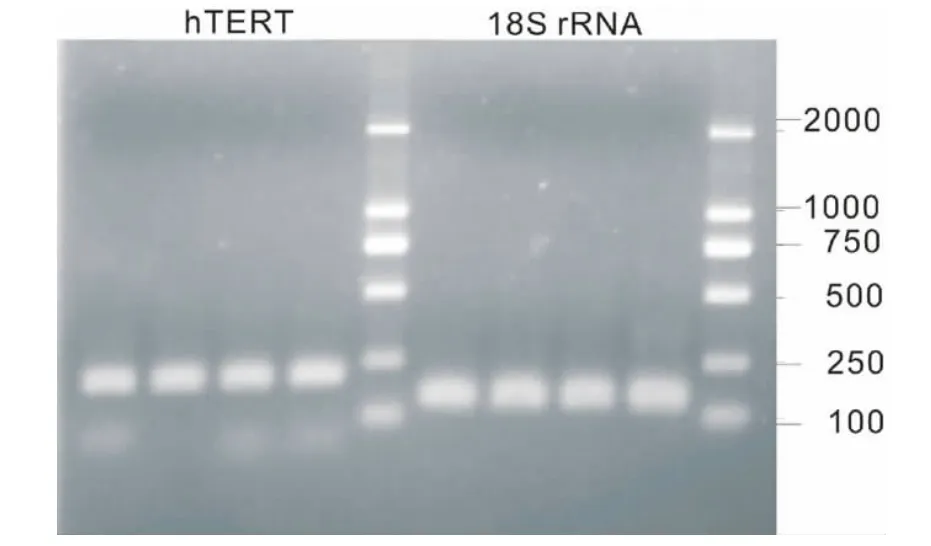
图2 hTERT及18 S rRNA cDNA的Q-PCR产物琼脂糖凝胶电
相对对照组,10、20和40 μg/mLDMY 处理48 h,hTERT mRNA 相对表达量分别为 0.82、0.67 和0.38,即基因表达分别下降了18%、33%和62%,提示DMY可能通过下调端粒酶催化亚单位(hTERT)基因表达而影响肿瘤细胞的端粒酶活性。见图3。
3 讨论
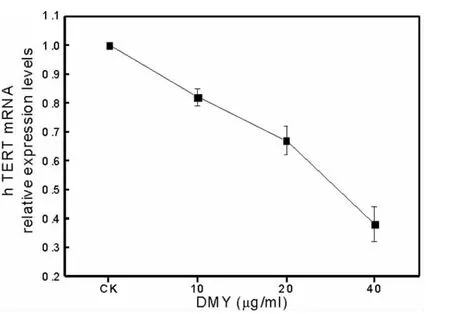
图3 DMY对hTERT mRNA表达量的影响
端粒酶是一种主要由RNA和蛋白质组成的核糖核蛋白,能够维持端粒的长度,使细胞得以持续分裂,从而成为永生化细胞,即恶性肿瘤细胞。研究表明85% ~95%的恶性肿瘤细胞端粒酶阳性[7-8],正常的体细胞几乎阴性[9],端粒酶的活化可能是各种基因改变导致肿瘤细胞绕过无限增生的限制获得永生化的共同通路,是肿瘤细胞克隆繁衍,使癌症得以发展的重要因素[10]。因此,如何调节端粒酶的活性成为治疗肿瘤的一个新的探索途径,以限制端粒酶活性为目标的肿瘤治疗可能具有更广阔的临床应用前景。
蒋才武等[11]利用G-四链Tm值和圆二色光谱对G-四链体进行了表征,利用电子吸收光谱和竞争性结合实验研究了DMY与G-四链体的相互作用,结果显示DMY是通过外部堆积结合到G-四链体,并通过稳定G-四链体结构而抑制端粒酶活性,起到抗肿瘤的作用。本实验中不同浓度(10、20和40μg/mL)的DMY处理MDA-MB-231细胞,利用TRAP法和Real-time PCR法两种方法从端粒酶活性和端粒酶催化亚单位hTERT基因表达两个方面检测DMY对MDA-MB-231细胞端粒酶活性的影响,结果均发现随着DMY浓度的增加,MDA-MB-231细胞端粒酶活性及端粒酶催化亚单位hTERT基因表达水平均呈不同程度的下调反应,且具有明显的剂量依赖性(图1和图3)。这些结果进一步拓展了DMY抗肿瘤作用机制的新认识,提示DMY可能通过下调端粒酶催化亚单位hTERT基因表达水平而影响MDA-MB-231细胞端粒酶的活性。
[1] 尹梅梅,潘振伟,蔡本志,等.二氢杨梅素诱导人肺腺癌细胞系AGZY-83-a凋亡的实验研究[J].中国药理学通报,2008,24(5):626-630.
[2] 曾飒,刘德育,叶燕丽,等.蛇葡萄素对人肺癌GLC-82裸鼠移植瘤的抑制作用[J].中药材,2004,27(11):842-845.
[3] Zhou F Z,Zhang X Y,Zhan Y J,et al.Dihydromyricetin inhibits cell invasion and down-regulates MMP-2/-9 protein expression levels in human breast cancer cells[J].Progress in Biochemistry and Biophysics,2012,39(4):352-358.
[4] 周防震,黄敏,张晓元,等.二氢杨梅素对小鼠移植性肉瘤S180化疗的增效减毒作用[J].中国医院药学杂志,2012,32(2):107-109.
[5] Kim N W,Prowse K R,Harley C B,et al.Specific association of human telomerase activity with immortal cells and cancer[J].Science,1994,266:2011-2015.
[6] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTmethod[J].Methods,2001,25(4):402-408.
[7] Zhu R,Xiao WD,Xiong YY,et al.The expression of telomerase and nm 23 in gastric adenocarcinoma and its prognosis[J].Shijie Huaren Xiaohua Zazhi,2000,8:1305-1306.
[8] Fan GR,Wang Y,Wu GH,et al.Expression of telomerase activity in primary liver carcinoma[J].Shijie Huaren Xiaohua Zazhi,2000,8:573.
[9] Meyerson M.Role of telomerase in normal and cancer cells[J].J Clin Oncol 2000,18:2626-2634.
[10] Shay JW,Zou Y,Hiyama E,et al.Telomerase and cancer[J].Hum Mol Genet,2001,10:677 -685.
[11] 蒋才武,李炳超,唐乾利.双氢杨梅素与G-四链体的相互作用研究[J].化学学报,2007,65(19):2159-2162.

