限制性应激在实验性牙周炎牙槽骨吸收中的作用*
周阳明,卫光曦,倪 灵,万朝霞
(1.重庆医科大学附属口腔医院正畸科 401147;2.重庆医科大学附属口腔医院牙体牙髓科 400015)
牙周炎(periodontitis)是人类最常见的口腔感染性疾病之一,是造成牙槽骨吸收、牙松动脱落的主要原因,对口腔组织的健康有很大的危害。大量研究发现,牙周微生物在牙周病的发病中是必需的始动因素,但单纯的细菌因素不足以解释疾病的复杂性和严重性。易感的宿主及某些能增加宿主易感性的因素是影响牙周病发生、发展和对治疗反应的重要因素[1]。应激指机体在遭受各种有害刺激时所处的一种状态,此状态的基础是体内出现一系列神经内分泌反应[2-4]。许多心理免疫学和流行病学研究证实,免疫系统作为牙周病的调节因素,可被心理应激反应通过神经内分泌系统影响并调节牙周炎的发生[5-6]。
本研究拟通过建立大鼠应激牙周炎实验动物模型,探讨限制性应激在实验性牙周炎发生、发展过程中的作用,从而为进一步阐明应激在牙周炎发生过程中的作用提供实验依据和理论基础。
1 材料与方法
1.1 建立大鼠实验性牙周炎动物模型 清洁级雄性SD大鼠48只,6周龄,体质量160~180g,购于重庆医科大学实验动物中心。无特殊致病菌的环境中适应性饲养1周后实验。这项研究中所有大鼠的处理得到中国重庆医科大学动物伦理委员会同意。
实验性牙周炎模型的建立:参照Kimura等[7]的方法,选定大鼠左上颌第一磨牙为实验牙,在其颈部用浸有牙周致病菌的0.012mm不锈钢结扎丝进行结扎,并使结扎丝尽量位于龈沟内,结扎丝在整个实验过程中一直保留作为口腔微生物的滞留装置(图1)。右上颌第一磨牙不做任何处理,作为阴性对照。
1.2 实验分组 结扎后随机分为应激组和非应激组,每组分2个亚组,各12只。空白组(G1组):非应激大鼠右上颌第一磨牙;单纯性牙周炎组(G2组):非应激大鼠左上颌第一磨牙;限制性应激组(G3组):应激大鼠右上颌第一磨牙;限制性应激+牙周炎组(G4组):应激大鼠左上颌第一磨牙。应激刺激方案执行后第2、3、4、5周,在应激大鼠和非应激大鼠中随机处死6只。
1.3 牙龈指数的测量 参照文献[8]报道对牙龈情况进行分级。0表示牙龈健康;1表示牙龈轻度炎症:牙龈的颜色有轻度改变并轻度水肿,探诊不出血;2表示牙龈中等炎症:牙龈色红,水肿光亮,探诊出血;3表示牙龈严重炎症:牙龈明显红肿或有溃疡,并有自动出血倾向。栓丝后1、2、3、4周后,使用钝头牙周探针检查大鼠牙周情况,探诊检查实验牙牙龈的颊侧中部、颊侧远中和腭侧中部、腭侧远中,这4个点的均值代表该牙的分数。
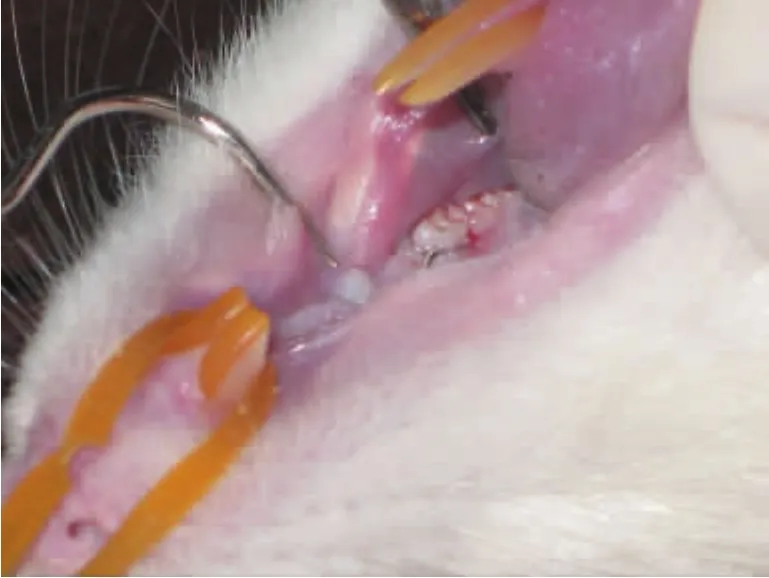
图1 结扎左上颌第一磨牙
1.4 应激刺激方案 牙周炎实验动物模型建立成功后,随机选取24只大鼠进行限制性应激刺激:将大鼠用自制的大鼠制动器(图2)固定身体,动物不能随意移动,不能进食,可以进水,每天制动12h。

图2 大鼠制动器
1.5 促肾上腺皮质激素(ACTH)、皮质酮(CORT)的测定各组大鼠处死前于非麻醉状态下取尾部末梢血0.5mL置于肝素抗凝管,冰冻保存待测;麻醉后心脏穿刺取血2mL置于肝素抗凝管,37℃恒温水浴2h,3 000r/min离心20min,取上清液(血浆),冰冻保存待测;将血液和血浆标本采用放射免疫分析法分别测定ACTH、CORT。
1.6 检测牙槽骨丧失程度(AL) 各组大鼠处死后取上颌骨,去净软组织,用1%亚甲基蓝液显示牙槽嵴顶的位置。测量上颌第一磨牙颊侧中部、颊侧远中、腭侧中部、腭侧远中的釉牙骨质界至牙槽嵴顶的距离,这4个位点测量值的均值作为该牙的AL。
1.7 统计学处理 采用SPSS10.0软件进行数据处理,以P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠牙周炎动物模型牙龈指数 在各个时间段,牙周结扎侧牙龈指数明显高于未结扎侧(P<0.01)。证实牙周结扎能造成大鼠实验性牙周炎,见表1。
表1 牙龈指数()

表1 牙龈指数()
*:P<0.01,与牙周未结扎侧比较。
组别 第1周 第2周 第3周 第4周牙周未结扎侧0.33±0.11 0.44±0.14 0.41±0.21 0.38±0.17牙周结扎侧 0.64±0.14*1.22±0.22*1.76±0.25*2.38±0.17*
2.2 ACTH和CORT检测结果 应激组大鼠体内的ACTH和CORT水平明显高于同时期非应激组大鼠(P<0.01),见表2。在前3周,应激组大鼠ACTH水平呈递增趋势,但第5周ACTH水平含量较第4周有所下降。从第2周开始,应激组大鼠CORT含量逐渐增高,并且第5周应激组大鼠CORT含量与非应激组相比差距最明显(P<0.01),见表3。
表2 ACTH含量比较(,pg/mL)

表2 ACTH含量比较(,pg/mL)
*:P<0.01,与非应激组比较。
组别 第2周 第3周 第4周 第5周非应激组 40.62±6.98 46.18±9.80 46.12±8.84 49.62±4.40应激组 66.72±7.08*91.44±4.59*96.48±14.01*85.94±5.99*
表3 CORT含量比较(,pg/mL)

表3 CORT含量比较(,pg/mL)
*:P<0.01,与非应激组比较。
分组 第2周 第3周 第4周 第5周非应激组 207.38±19.49 217.76±52.28 215.90±11.01 241.62±32.83应激组 370.18±28.15*347.88±40.33*383.10±31.58*411.66±9.78*
2.3 AL检测结果 通过对G1组和G2组大鼠上颌第一磨牙AL的比较可以发现,栓丝后的G2组大鼠的AL均高于未栓丝的G1组大鼠(P<0.01)。从第2周开始,AL逐渐增高,证明牙周炎大鼠的模型建立成功。与G2组比较,在给予限制性应激处理后的G4组大鼠的AL均明显高于在同一时间检查的G2组大鼠(P<0.01),并且第5周两组间差距最大。通过对G4组大鼠不同时间内检测的AL数据进行分析可以发现,从第2周开始,随着应激时间的增加,AL也会有所增加(P<0.01)。G1组和G3组之间没有明显差异(P>0.05),见表4。
表4 各组AL检测结果(,mm)
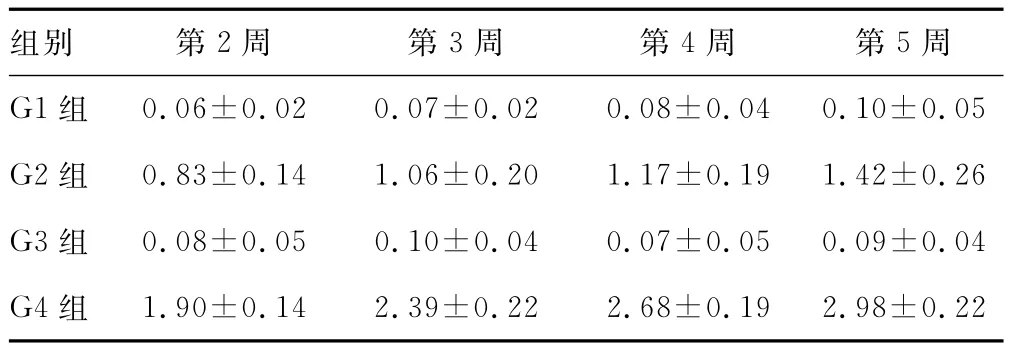
表4 各组AL检测结果(,mm)
组别 第2周 第3周 第4周 第5周G1组0.06±0.02 0.07±0.02 0.08±0.04 0.10±0.05 G2组 0.83±0.14 1.06±0.20 1.17±0.19 1.42±0.26 G3组 0.08±0.05 0.10±0.04 0.07±0.05 0.09±0.04 G4组1.90±0.14 2.39±0.22 2.68±0.19 2.98±0.22
3 讨 论
3.1 模型建立的评价 国外有研究结果证明,大鼠是啮齿类动物,其牙槽骨、牙龈及牙周组织学特征与人类相似,适合作为牙周炎动物模型。SD大鼠的生物学特性还包含:(1)是昼伏夜动杂食动物;(2)喜啃咬,性情较温顺,抗病力强;(3)大鼠汗腺不发达;(4)嗅觉灵敏;(5)对噪声敏感;(6)垂体、肾上腺功能发达,应激反应敏感,行为表现多样等。基于上述这些特性,SD大鼠非常适合建立牙周炎应激模型[9]。牙颈部结扎是诱发大鼠牙周炎的传统方法,通过结扎促进局部菌斑、牙石堆积形成,从而引发牙周组织的破坏,已是一种较成熟的方法。本实验通过对大鼠结扎侧和未结扎侧牙龈指数及AL结果的对比可以证明,牙颈部结扎可以有效导致大鼠结扎区牙周炎的发生。
3.2 限制性应激牙周炎的影响 任何躯体或心理的刺激,只要达到一定强度,除了引起与刺激因素直接相关的特异性变化外,还可以引起一组与刺激因素非直接关系的全身非特异反应,这种反应就是应激。关于应激对牙周炎影响的临床研究已有很多报道,但基于动物实验的研究不多,尤其是在国内,很少有相关研究。
从目前的研究结果可以得知,应激反应通过神经和神经-内分泌调节免疫系统的途径至少有3条[10-12]。(1)下丘脑-下垂体-肾上腺素(HPA)轴:应激使HPA加强了促进促进脑垂体分泌ACTH,从而使糖皮质激素产生并释放进入体循环[13]。糖皮质激素的增多不仅使血糖升高,并且抑制从Th1到Th2的炎症反应。(2)交感神经系统:应激激活了支配免疫系统的交感神经纤维,释放儿茶酚胺导致肾上腺分泌去甲肾上腺素和肾上腺素。(3)感觉肽能神经途径:应激促进感觉神经纤维释放P物质、生长激素抑制素及神经生长因子等神经肽,从而介导神经源性的炎症反应,并调节免疫系统的活性和细胞素的释放。因此,应激可以通过这3条途径对牙周病发挥各种不同的作用。在以往的国内外研究中[14-15],尝试构建心理应激的方式有很多,如冰敷法、减尾法、高温刺激等不同方式来尝试使实验样本产生并达到预期的心理应激反应。但是,通过制动来引发的限制性应激在强度、频率、持续的时间等方面便于控制,所以目前被国内外广大学者所采纳。
本实验所采用的制动器是根据限制性应激所需要的条件自制的一个制动器。它在不会过分加压的情况下,可以限制大鼠的自由活动(力量可以调节),同时不会影响到大鼠呼吸和进水。在将大鼠从制动器放回笼中后方便对其进行冲洗保持里面环境的清洁,完全符合限制性应激制动的要求。ACTH和CORT是提示机体是否发生应激反应的最重要、最经典的指标之一。本实验在对大鼠牙周炎模型加入限制性应激后,检测出大鼠体内应激指标ACTH和CORT含量在应激组均增高,表明实验动物内分泌系统对应激刺激发生了反应,证明应激牙周炎动物模型建立成功。再通过对本实验中各组AL的测量和比较,可以发现在加入限制性应激这一条件后,应激组大鼠结扎侧AL明显高于非应激组大鼠结扎侧AL,说明限制性应激会加重已发生牙周炎的大鼠牙周组织的牙槽骨吸收,而应激组大鼠未结扎侧AL与非应激组大鼠未结扎侧AL无明显差异,这说明应激这一因素对未发生牙周炎的大鼠牙周组织没有影响。通过对应激组大鼠结扎侧前4周的AL进行比较可以发现,随着应激时间的增加,AL也会增加,证明应激时间的长短与大鼠牙周组织的AL呈正相关。而应激加重牙周炎的原因可能在于在应激状态下,宿主的免疫机制发生改变,各种炎症介质释放增加,使得宿主对局部菌斑等不良刺激更加敏感,从而加重了炎症进程。
很显然,大鼠适合用牙颈部结扎的方法建立限制性牙周炎模型来研究应激与牙周炎的关系。应激对没有发生牙周炎的牙周组织无任何影响,但对已发生了牙周炎的牙槽骨吸收有促进作用,可以加重牙周炎的发展。随着应激时间的增加,牙槽骨的吸收程度也会加重。但是,目前关于应激与牙周组织炎症的联系在分子生物学水平上的解释仍然是模糊不清的,还需对其进行更加深入的研究。
[1]Kornman KS.Mapping the pathogenesis of periodontitis:a new look[J].J Periodontol,2008,79(8):1560-1568.
[2]Castro GD,Oppermann RV,Haas AN,et al.Association between psychosocial factors and periodontitis:a casecontrol study[J].J Clin Periodontol,2006,33(2):109-114.
[3]Weik U,Herforth A,Kolb-Bachofen V,et al.Acute stress induces proinflammatory signaling at chronic inflammation sites[J].Psychosomatic Med,2008,70(8):906-912.
[4]Peruzzo DC,Benatti BB,Antunes IB,et al.Chronic stress may modulate periodontal disease:a study in rats[J].J Periodontol,2008,79(4):697-704.
[5]Nakajima K,Hamada N,Takahashi Y,et al.Restraint stress enhances alveolar bone loss in an experimental rat model[J].J Periodontal Res,2006,41(6):527-534.
[6]Chiou LJ,Yang YH,Hung HC,et al.The association of psychosocial factors and smoking with periodontal health in a community population[J].J Periodontal Res,2010,45(1):16-22.
[7]Kimura S,Nagai A,Onitsuka T,et al.Induction of experimental periodontitis in mice with porphyromonas gingivalis-adhered ligatures[J].J Periodontol,2000,71(7):1167-1173.
[8]Löe H.The gingival index,the plaque index and the retention index systems[J].J Periodonotol,1967,38(6):610-616.
[9]Takada T,Yoshinari N,Sugiishi S,et al.Effect of restraint stress on the progression of experimental periodontitis in rats[J].J Periodontol,2004,75(2):306-315.
[10]Goyal S,Jajoo S,Nagappa G,et al.Estimation of relationship between psychosocial stress and periodontal status using serum cortisol level:a clinico-biochemical study[J].Indian J Dent Res,2011,22(1):6-9.
[11]Gaspersic R,Stiblar-Martincic D,Skaleric U.Influence of restraint stress on ligature-induced periodontitis in rats[J].Eur J Oral Sci,2002,110(2):125-129.
[12]Semenoff SA,Semenoff TA,Borges AH,et al.Methodological model of chronic stress associated with ligature-induced periodontitis in rats:a radiographic study[J].Braz Oral Res,2010,24(4):455-459.
[13]Seiffert K,Hosoi J,Torii H,et al.Catecholamines inhibit the antigen-presenting capability of epidermal Lan-gerhans cells[J].J Immunol,2002,168(12):6128-6135.
[14]Huang S,Lu F,Zhang Z,et al.The role of psychologic stressinduced hypoxia-inducible factor-1αin rat experimental periodontitis[J].J Periodontol,2011,82(6):934-941.
[15]Nicola G,Wesley K,Seema B.Struggling behavior during restraint is regulated by stress experience[J].Behavioural Brain Res,2008,191(2):219-226.

