重庆永川地区人乳头瘤病毒感染亚型、年龄分布及多重感染影响的研究*
代红莹,张晓静
(重庆医科大学附属永川医院检验科 402160)
人乳头瘤病毒(human papilloma virus,HPV)是一种嗜黏膜和皮肤上皮的双链闭合环状的小DNA病毒,相对分子质量约为8×103。目前100多种亚型已被鉴定,其中约40余种与人类生殖器皮肤黏膜病变相关[1]。HPV亚型可分为高危型和低危型两类,低危型以HPV-6、11最为常见,主要引起尖锐湿疣等良性病变;高危型以 HPV-16、18、31、52、58最为常见,常引起宫颈癌等恶性病变[2]。HPV亚型在不同地区不同人群分布情况不一[3]。目前,HPV在非洲和拉丁美洲的感染率较高,
绝大多数性活跃女性至少感染了一种HPV。本研究主要对重庆永川地区的适龄妇女进行23种常见亚型检测,以确定重庆永川地区HPV感染的常见类型,为后续研究打下基础。
1 资料与方法
1.1 一般资料 本研究所有样本均来源于重庆医科大学附属永川医院,采集对象为2007年1月至2010年10月随机前来医院就诊的患者。样本采集后隔离保存于宫颈脱落细胞收集管中,并尽可能于样本到达后的当天进行DNA分离处理,少数来不及处理的样品置于-20℃冰箱中保存,1周内进行处理。
1.2 仪器和试剂 FYY-3型分子杂交仪(兴化市分析仪器厂)、PCR扩增仪(杭州朗基有限公司)、HPV DNA分型基因芯片检测系统(亚能生物技术有限公司)、其他试剂(国产分析纯)。
1.3 方法
1.3.1 样品HPV DNA获取和处理 用宫颈脱落细胞采集器取得宫颈表皮脱落细胞,对于生殖器或肛周疣体增生(怀疑为尖锐湿疣)患者,用湿棉拭子采集疣体表皮脱落细胞或疣体组织。将取样后的棉拭子或采集器放入备有1mL无菌生理盐水的试管中,充分漂洗后将棉拭子贴壁挤干,安全丢弃。将漂洗过的生理盐水或洗脱液全部转移到1.5mL微量离心管中,13 000r/min离心10min,弃去上清,保留管底的细胞块,加入50mL细胞裂解液悬浮沉淀,沸水浴10min,13 000r/min离心10min,-20℃保留上清待用。疣体组织DNA的提取用组织DNA提取试剂盒按使用说明书方法提取。
1.3.2 HPV DNA片段的PCR扩增 取PCR反应管于5 000 r/min离心2s,根据HPV L1基因设计23种亚型的特异性探针,针对这一片段设计通用引物,同时以人类基因组的看家基因beta-globin作为PCR对照。按以下条件进行扩增:50℃15 min,95℃10min,94℃30s,42 ℃ 90s,72℃ 30s,40个循环,72℃5min。PCR反应体系为:ddH2O 14.2μL,反应缓冲液(含 MgCl2)2.5μL,三磷酸脱氧核糖核苷(dNTP)2μL,引物0.5μL/条,样品DNA 5μL,Taq酶0.3μL,反应总体系25μL。
1.3.3 杂交和显色 取15mL塑料离心管,标明编号,放入标有同样编号的膜条,加入A液5mL(2×SSC,0.1%SDS,pH 7.4)及所有PCR产物。将塑料管放入沸水浴中加热10min,放入杂交箱51℃杂交1.5h。同时取50mL塑料管,加入40 mL B液(0.5×SSC,0.1%SDS,pH 7.4)于杂交箱或水浴箱中预热至51℃。取出膜条,移至装有预热B液的50mL管中,于51℃轻摇洗涤15min。A液配制1∶2 000的过氧化物同工酶(POD)溶液,室温轻摇浸泡膜条15min。弃去POD溶液,用A液室温轻摇洗2次,每次5min,然后再用C液室温洗膜1~2 min。同时配制显色液,将膜条浸泡于显色液中避光显色15min左右,即可见斑点显现,若显色较弱可适当延长显色时间,显色完毕将膜条浸泡在水中清洗,最后取出膜条于4℃保存。
1.3.4 结果判定 膜条上有24个方格,依次排列着23种HPV型别,另一个方格为质控点。结果判定时,首先看膜条的质控点是否有蓝色圆点出现,若有则判本次实验成功,然后看哪些方格有蓝色圆点出现,哪个方格有蓝色圆点出现则判定与其相对应的HPV型阳性,每次实验都设有阴性和阳性对照。
1.4 统计学处理 用Micro EXCEL软件建立数据库,制作表单进行数据的录入,最后得到成型的数据库,用SPSS13.0软件进行统计分析,对目前公认的18种高危型,5种低危型在不同人群中的分布进行统计描述和分析。
2 结 果
2.1 HPV感染的型别分布 在检测出的955例阳性标本中,除HPV-44、MM4未检测出来外,其他各型均有检出。其中高危型感染 HPV-16最多为(34.45%),其次为HPV-58(11.52%);低危型感染HPV-43为首(9.84%),其次为 HPV-11(8.69%)。高危型检出数是低危型检出数的3.5倍。
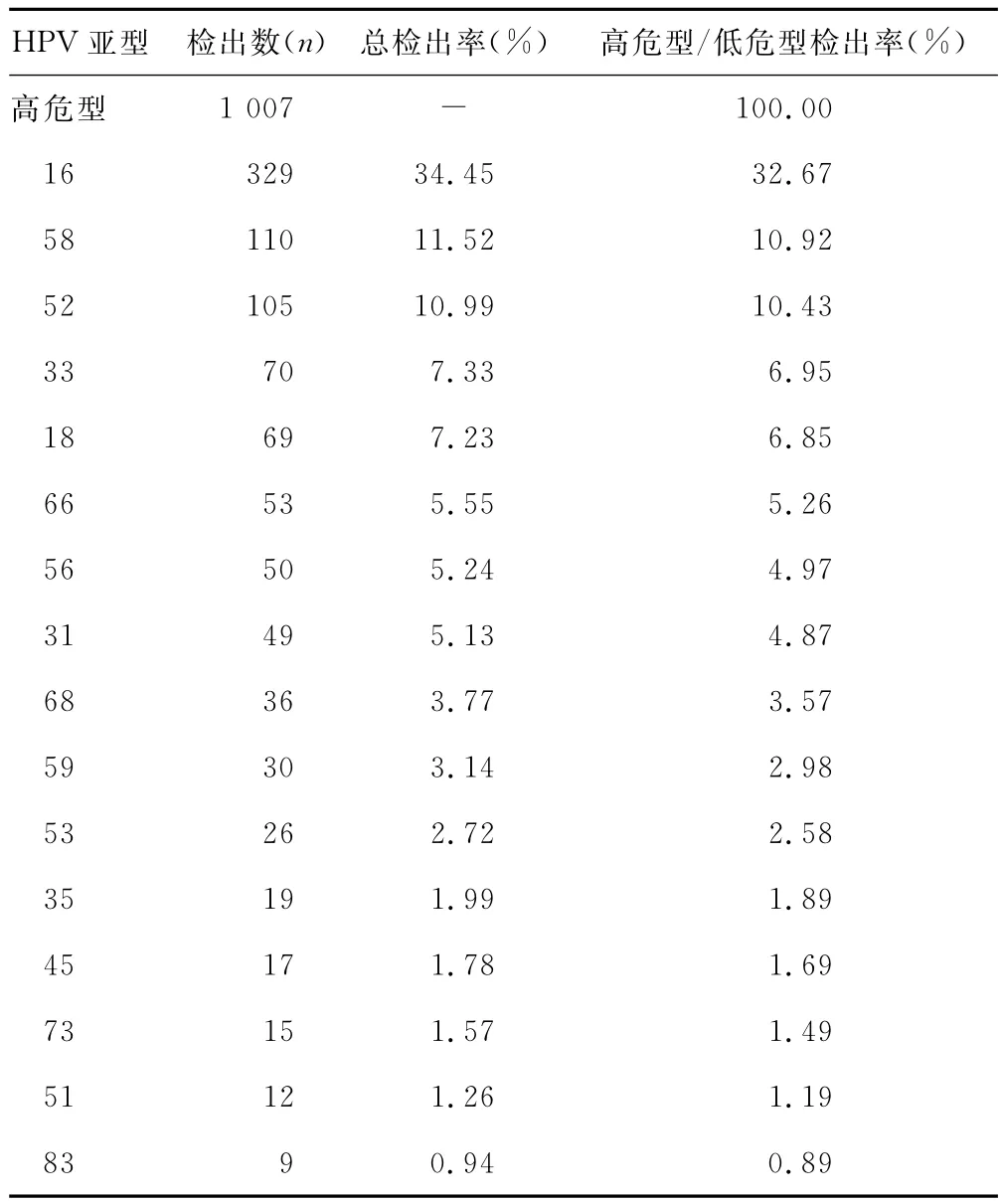
表1 HPV亚型感染情况
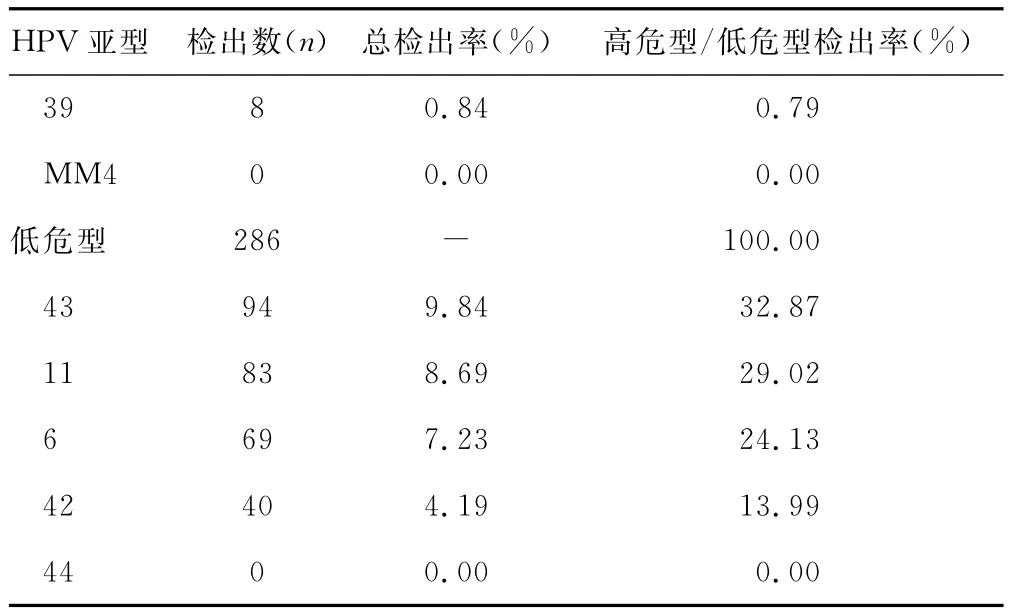
续表1 HPV亚型感染情况
2.2 HPV各型感染情况 在混合感染的249例标本中,两种亚型的混合最为常见,占感染检出率的19.27%;3种及以上亚型感染检出率仅占总感染的6.81%。高危型和低危型混合感染110例,占总感染11.52%;高危型混合感染118例,占总感染的12.36%;低危型混合感染13例,占总感染的1.36%。
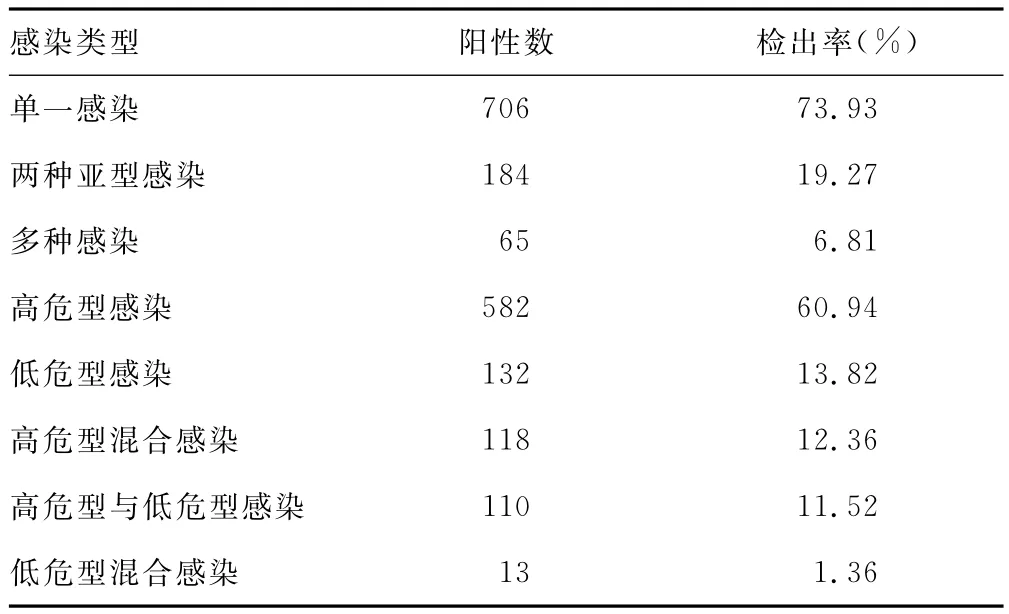
表2 HPV感染情况
2.3 HPV感染的年龄分布 本研究将感染者分为≤20岁、>20~30岁、>30~40岁、>40岁4个年龄组,其HPV的感染率依次为6.49%、22.93%、39.27%、31.31%,>30~40岁年龄组是HPV感染的主要年龄阶段。

表3 不同年龄HPV感染情况
3 讨 论
3.1 HPV感染状况 HPV是一种通过性生活传播的病毒,通常感染没有明显症状。据统计,至少有50%的妇女其一生都会感染HPV,而50岁之前感染HPV的几率高达80%。非洲HPV感染率约22.1%,亚洲8.0%,北美洲11.3%,中美洲和墨西哥20.4%,欧洲8.1%[4],不同地区有一定差异,这可能是由于HPV本身的地域性差异及不同的研究者选择的目标人群和采用的检测方法不同引起的。
3.2 HPV亚型分布特点 研究表明,HPV亚型分布也存在地域性差异,不同亚型 HPV感染致癌性及其后果不同[5]。Bao等[6]研究的中国宫颈癌常见亚型为 HPV-16、18、58、33、52、45、31及35型;宫颈癌前病变中常见亚型为 HPV-16、58、52、18、33、31。
本研究显示HPV高危型感染中常见的亚型为HPV-16、58、52、33、18、66、56,与前人的研究有所偏差,原因可能归结为HPV亚型分布的地域性差异;低危型感染中 HPV-43、11、6、42均占有较大比例,与前人结果比较6、11没有占有主导地位,但是4种亚型均是广范围报道的HPV低危型亚型。
3.3 单一感染与多重感染 本研究中HPV多重感染的比例为26.08%,低于Bachtiary等[7](43.9%),与其他文献一致[8]。不少学者认为HPV的多重感染并不少见,检出率高低除与研究人群有关外,还与检测方法有关。在本研究中,多重感染主要是二重感染,最常见的为HPV-16合并的感染。Ho等[9]学者认为HPV多重感染者出现持续感染的危险性更大,支持本研究结果。
3.4 HPV与宫颈癌的关系 宫颈癌发病率高,在女性恶性肿瘤的发病率中位居第2。研究表明,HPV的持续感染是宫颈癌及宫颈上皮内瘤变(CIN)的主要病因。高危型HPV的持续感染是宫颈癌及其癌前病变发生、发展的必要条件。宫颈癌患者的高危型HPV感染阳性率为100%,CINⅡ和CINⅢ为97%,CINⅠ为61.4%。
不同HPV亚型的致病力不同,据 Munoz等[10]统计,虽然各级别病变间感染型别存在差异,但高危型HPV-16、58、18、56、33在各级别病变组均占有一定优势,本研究亦支持上述结果。HPV多重感染率随病变级别增加而增加,一定程度上说明多重感染对宫颈病变的发生、发展起促进作用。结果与Fife等[11]的研究一致,但也有不少学者提出反对意见[10]。
3.5 HPV与年龄的关系 HPV与年龄具有相关性,据de Sanjose等[4]的研究显示:HPV感染高峰在34岁之前,35~44岁的HPV感染率随之降低,而对于大于45岁组,除亚洲外其他地区的感染率又有所增加。本研究结果有所不同,原因可能在于,统计的标本量有限,不能客观反映HPV感染年龄本身,也存在患者来源集中的问题,HPV感染一般症状不明显,很多年轻妇女忽略了HPV的常规检查也是一个很大的因素。
[1]Steben M,Duarte-Franco E.Human papillomavirus infec-tion:epidemiology and pathophysiology[J].Gynecol Oncol,2007,107(2):2-5.
[2]Paavonen J.Human papillomavirus infection and the development of cervical cancer and related genital neoplasias[J].Int J Infect Dis,2007,11(2):3-9.
[3]Clifford GM,Gallus S,Herrero R,et al.Worldwide distribution of human papillomavirus types in cytologically normal women in the international agency for research on cancer HPV prevalence surveys:apooled analysis[J].Lancet,2005,366(9490):991-998.
[4]de Sanjose S,Diaz M,Castellsague X,et al.Worldwide prevalence and genotype distribution of cervical human papillomavirus DNA in women with normal cytology:a meta-analysis[J].Lancet Infect Dis,2007,7(7):453-459.
[5]Clifford GM,Swith JS,PlummerM,et al.Human papillomavirus types in invasive cervical cancer worldwide:a meta-analysis[J].Br J Cancer,2003,88(1):63-73.
[6]Bao YP,Li N,Smith JS,et al.Human papillomavirus typedistribution in the cervix of Chi-nese women:a meta-analysis[J].Int J STD AIDS,2008,19(2):106-111.
[7]Bachtiary B,Obermair A,Dreier B,et al.Impact of multiple HPV infection on response to treatment and survival in patients receiving radical radiotherapy for cervical cancer[J].Int J Cancer,2002,102(3):237-243.
[8]Huang LW,Chao SL,Wang JL,et al.Hunam papillomavirus-31-related types predict better survival in cervical carcinoma[J].Cancer,2004,100(2):327-334.
[9]Ho GY,Bierman R,Beardsley L,et al.Natural history of cervicov-aginal papillomavirus infection in young women[J].N Engl J Med,1998,338(7):423-428.
[10]Munoz N,Bosch FX,Sanjose S,et al.Epidemiologic classification of human papillomavirus types associated with cervical cancer[J].N Engl J Med,2003,348(6):518-527.
[11]Fife KH,Cramer HM,Schroeder JM,et al.Detection of multiple human papillomavirus types in the lower genital tract correlates with cervical dysplasia[J].J Med Virol,2001,64(4):550-559.

