抑癌基因maspin在胃癌细胞株SGC-7901中的表达及意义*
谯 敏,牛司强,王丕龙
(重庆医科大学附属第一医院:1.消化内科;2.检验科 400016)
抑癌基因maspin是丝氨酸蛋白酶抑制剂(serpin)家族的成员之一,其在健康成人的大多数组织中均有表达,而在恶变的组织中表达明显下降,甚至不表达。目前的研究认为其可抑制不同类型的肿瘤细胞增殖、转移,促进肿瘤细胞凋亡,抑制肿瘤血管生长等。为了研究maspin基因对胃癌细胞的抑制作用,本研究构建maspin基因的表达质粒pCDNA3.1-maspin,并将其稳定转染胃癌细胞株SGC-7901,从mRNA及蛋白水平检测maspin的表达变化,并检测胃癌细胞的增殖和凋亡。
1 材料与方法
1.1 材料
1.1.1 质粒 pCDNA3.1质粒由重庆医科大学感染性疾病分子生物学重点实验室黄爱龙教授惠赠。
1.1.2 细胞株和组织 胃癌细胞株SGC-7901由重庆医科大学病理教研室提供。原发性肝癌癌旁组织由重庆医科大学附属第一医院普外科孔令泉副教授提供。
1.1.3 主要试剂 限制性内切酶XhoⅠ及EcoRⅠ购于TaKaRa公司;质粒提取试剂盒、胶回收试剂盒和连接试剂盒购于Omiga公司;总RNA提取试剂、逆转录-聚合酶链反应(RT-PCR)试剂盒和原位末端标记法(TUNEL)反应试剂盒购于Promega公司;转染试剂lipofectamine 2000购于Invitrogen公司;maspin单克隆抗体购于Santa Cruz公司;maspin引物和内参磷酸甘油醛脱氢酶(GAPDH)引物由大连宝生物公司合成。
1.2 方法
1.2.1 细胞培养胃癌SGC-7901细胞株接种在含10%小牛血清的RPMI-1640培养液,37℃,5%CO2孵箱中培养,长满后传代。
1.2.2 重组质粒pCDNA3.1-maspin的构建 maspin的上、下游引物分别为5′-TAC GAA TTC ATG GAT GCC CTG CAA CTA GCA AAT-3′和 5′-TCG CTC GAG TTA AGG AGA ACA GAA TTT GCC AAA G-3′。采用手术切除的原发性肝癌癌旁组织,按照Trizol试剂的方法提取总RNA,总RNA用M-MLV逆转录酶和maspin下游引物合成第一链cDNA,反应条件如下:30℃10min,94℃5min,5℃5min。用Ex Taq DNA聚合酶进行PCR扩增,反应体系内含cDNA 4 μL,10×缓冲液5μL,上、下游引物各1μL,MgCl 24μL,脱氧核苷酸(dNTPs)4μL,Taq酶0.25μL,加灭菌蒸馏水至50 μL。按下述条件进行循环:94℃40s,57℃30s,72℃70s,共30个循环,以纯水作阴性对照。扩增产物于1.5%琼脂糖凝胶电泳30min,EB染色,Bio-Rad图像仪观察并扫描制片,胶回收目的基因。重组质粒酶切鉴定,再测序分析。
1.2.3 pCDNA3.1-maspin转染SGC-7901细胞 按lipofectamineTM 2000说明书进行转染。将贴壁生长的SGC-7901细胞用胰酶消化、离心、然后去上清,沉淀用RPMI-1640培养液重悬,调整浓度为4×105/mL,2mL/孔细胞接种于6孔培养板中,37℃培养。待细胞生长到占培养瓶底约80%左右时,培养液换为不含抗菌药物但仍含血清的RPMI-1640,培养过夜。次日分别用空质粒pCDNA3.1、重组质粒pCDNA3.1-maspin和脂质体的复合物转染SGC-7901细胞,在无血清及抗菌药物的培养液中培养4~6h后换新鲜的含10% 小牛血清的RPMI-1640培养液,继续培养2~4d,然后检测各项指标。
1.2.4 RT-PCR检测maspin基因的mRNA 按照Qiagen公司的RT-PCR一步法试剂盒进行操作。反应条件为:94℃40 s,57℃30s,72℃70s,共30个循环。以GAPDH作为内参,以pCDNA3.1转染组作为阴性对照。合成的GAPDH上游引物为:5′-CCA TGG AGA AGG CTG GGG-3′,下游引物为:5′-GGT CCA CCA CTG ACA CTG G-3′,产物长度 421bp;maspin产物长度为821bp。扩增产物于1%琼脂糖凝胶电泳30min,EB染色,BIO-RAD图像分析仪观察并扫描,记录结果。
1.2.5 免疫化学检测maspin蛋白表达 SGC-7901细胞爬片,72h后收获细胞,95%乙醇固定后,按maspin抗体说明书操作。DAB显色,二甲苯透明,封片,照相。Image Proc Plus 3.0软件进行分析。
1.2.6 MTT法检测细胞增殖 将SGC-7901细胞以5×104/mL接种于96孔板,每孔200μL,于37℃、5%CO2孵箱中培养24h后加上处理因素,每组设立4个重复孔,并设空白对照组。继续培养1~4d,然后在每孔中加入MTT 20μL,37℃继续孵育4h后弃培养液上清,随后每孔加入二甲基亚砜100 μL,振荡使蓝色沉淀溶解。用酶标仪测490nm波长处的吸光度(A),计算细胞增殖抑制率(IR)及中效浓度,并在倒置显微镜下观察细胞形态。抑制率=(l-试验孔A/对照组A)×100%。
1.2.7 TUNEL检测细胞凋亡 取对数生长期的SGC-7901细胞4×105/mL接种于6孔板,10%小牛血清的RPMI-1640培养过夜,质粒pCDNA3.1和pCDNA3.1-maspin分别转染细胞后72h,弃上清,95%乙醇固定,3%H2O2封闭,每孔加50 μL反应混合液,37℃孵育60min,然后每孔加50mL山羊标记的辣根过氧化物酶,DAB显色。
2 结 果
2.1 质粒鉴定 重组质粒pCDNA3.1-maspin经XhoⅠ及EcoRⅠ双酶切,同时做pCDNA3.1质粒双酶切对照。1%琼脂糖电泳,pCDNA3.1-maspin经双酶切后呈两条带,分别为5.5 kb的载体片段和1 128bp的小片段;而pCDNA3.1经双酶切后则为5.5kb的载体片段和30bp的目的片段。测序结果均正确。见图1。
2.2 RT-PCR检测结果 以琼脂糖电泳条带的亮度来判断maspin mRNA水平高低。实验结果显示,与转染pCDNA3.1组细胞相比较,转染pCDNA3.1-maspin组细胞中maspin的mRNA水平上调80.5%(P<0.05)。见图2。
2.3 免疫细胞化学检测结果 转染pCDNA3.1组SGC-7901细胞,细胞质着色少而浅。而转染pCDNA3.1-maspin组SGC-7901细胞可见细胞质黄染,内有较多棕黄色颗粒,说明maspin成功转染进入SGC-7901细胞中并获得较强表达。见图3。
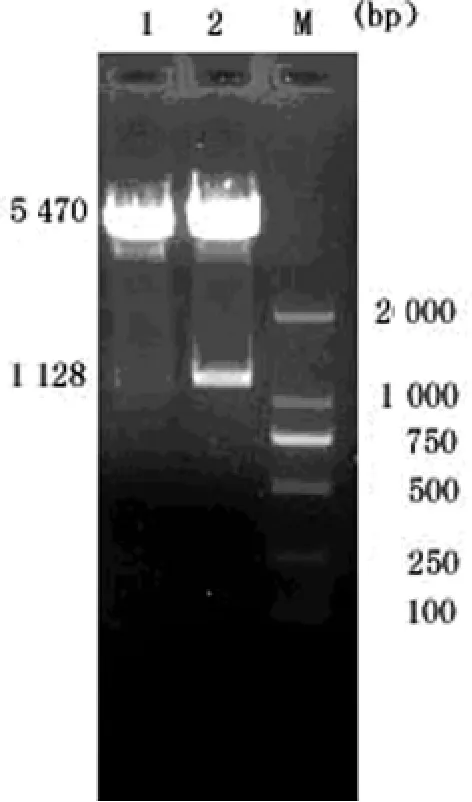
图1 重组质粒的酶切鉴定
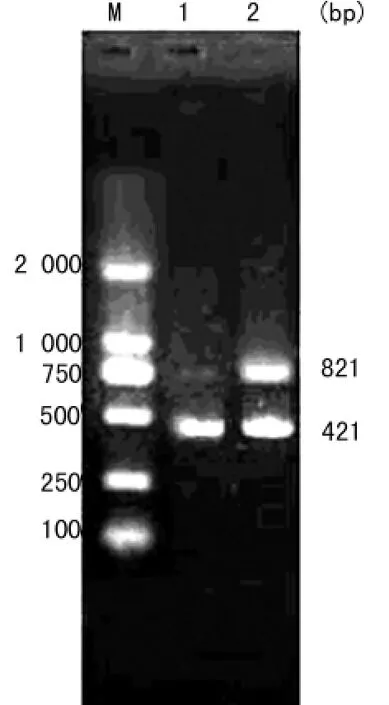
图2 RT-PCR检测maspin的mRNA水平
2.4 MTT实验检测细胞增殖 纯水转染SGC-7901细胞后72h细胞生长抑制率为0.17±0.03,空质粒pCDNA3.1转染SGC-7901细胞后72h细胞生长抑制率为0.22±0.02,两者差异无统计学意义(P>0.05);重组质粒pCDNA3.1-maspin转染SGC-7901细胞后72h细胞生长抑制率为0.79±0.06,与前两组的差异均有统计学意义(P<0.01)。
2.5 TUNEL检测SGC-7901细胞的凋亡 MTT实验检测细胞增殖转染pCDNA3.1组SGC-7901细胞贴壁良好,形态较完整,部分细胞胞核内有着色现象,胞质着色浅。而转染pCDNA3.1-maspin质粒组则出现大量的凋亡细胞,细胞核内呈棕红色染色,核浓缩,胞浆有片状着色,可见部分细胞脱落,说明pCDNA3.1-maspin能引起明显的细胞凋亡。见图4。
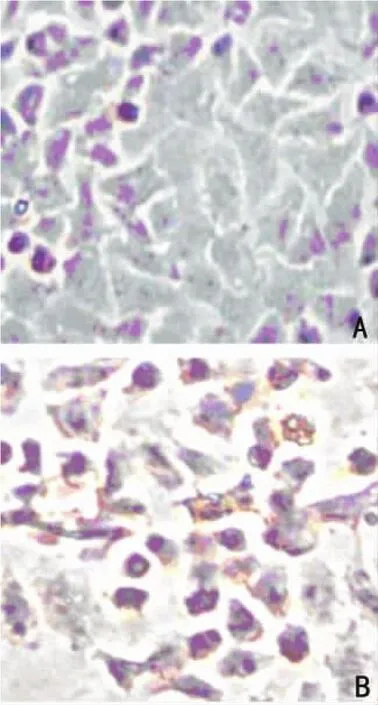
图4 TUNEL检测细胞凋亡(×40)
3 讨 论
胃癌是消化系统最常见的恶性肿瘤之一,其发病率高,恶性程度高。临床上手术切除及辅助性放疗、化疗的应用并没有带来满意的生存率[1]。基因治疗是近年来兴起的一种肿瘤治疗的新方法,其中通过基因工程手段促使抑癌基因在癌细胞中的再表达,进而抑制肿瘤细胞生长,是目前公认有效的一种基因治疗方法[2-3]。
maspin基因是在人的正常乳腺上皮细胞上发现的serpins。1994年,有研究者首先报道maspin再表达可明显抑制乳腺癌细胞株MDA-MB-435在体内、外的生长、浸润和转移[4-5]。Abraham等[6]的研究证明,maspin的再表达在逆病毒转染的鼠前列腺肿瘤细胞中能特异性地促进细胞对纤维结合素的结合。目前的研究发现maspin基因在大多数健康人组织中均有表达;一旦正常组织恶变,maspin基因表达则减弱或不表达[6-10]。生物学研究表明maspin的再表达会抑制肿瘤生长,可能与增强细胞对凋亡刺激因子的敏感性有关;maspin基因的再表达可抑制肿瘤浸润、血管生成和肿瘤转移,其发生可能与maspin介导的抑制细胞周围蛋白酶解有关[11-13]。
在本研究中,作者首先成功构建了maspin基因的重组表达质粒pCDNA3.1-maspin,将其转染胃癌细胞株SGC-7901,并在mRNA和蛋白水平检测到maspin基因表达明显增强,说明maspin基因在SGC-7901细胞中获得了再表达;同时MTT实验及TUNEL反应发现SGC-7901细胞增殖受到抑制,并出现明显的细胞凋亡。通过这些实验结果,作者证实了maspin基因可能通过抑制胃癌细胞株SGC-7901的增殖、诱导细胞凋亡达到抑癌作用[14-15],为进一步研究maspin基因的抑癌机制以及利用maspin基因进行基因治疗提供了一定的理论依据。
[1]Chan AD,Wong BC,Lam SK.Gastric cancer:past,present and future[J].Can Gastroenterol J,2001,15(7):469-474.
[2]Shi HY,Zhang W,Liang R,et al.Modeling human breast cancer metastasis in mice,maspin as a paradigm[J].Histol Histopathol,2003,18(1):201-206.
[3]Casado E,Comez-Navarro J,Yamamoto M,et al.Strategies to accomplish targeted expression of transgenes in ovarian cancer for molecular therapeutic appliacations[J].Clin Cancer Res,2001,7(8):2496-2504.
[4]Zou Z,Anisowicz A,Hendix MJC,et al.Maspin,a serine with tumor suppressing activity in human mammary epithelial cells[J].Science,1994,263(10):526-529.
[5]Zou Z,Cao C,Nagaich AK,et al.p53regulates the expression on of the tumor suppressor gene Maspin[J].J Biol Chen,2000,275(9):6051-6054.
[6]Abraham S,Zhang W,Greenberg N,et al.Maspin functions as tumor suppressor by increasing cell adhesion to extracellular matrix in prostate tumor cells[J].J Urol,2003,169(3):1157-1161.
[7]Shao LJ,Shi HY,Ayala G,et al.Sufficiency of the maspin tumor suppressor gene leads to hyperplastic lesions in prostate[J].Cancer Res,2008,68(13):5143-5150.
[8]Lonardo F,Li X,Kaplun A,et al.The natural tumor suppressor protein maspin and potential application in non small cell lung cancer[J].Curr Pharm Des,2010,16(16):1877-1880.
[9]Mohsin SK,Zhang M,Clark GM,et al.Maspin expression in invasive breast cancer:association with other prognostic factors[J].J Pathol,2003,199(4):432-435.
[10]Marioni G,Giacomelli L,Alessandro E,et al.Nuclear localization of mammary serine protease inhibitor(MASPIN):is its impact on the prognosis in laryngeal carcinoma due to a pro-apoptotic effect[J].Am J Otolaryngol,2008,29(3):156-162.
[11]Cho JH,Kim HS,Park CS,et al.Maspin expression in early oral tongue cancer and its relation to expression of mutant-type p53and vascular endothelial growth factor[J].Oral Oncol,2007,43(3):272-277.
[12]Liu J,Yin S,Reddy N,et al.Bax mediates the apoptosissensitizing effect of maspin[J].Cancer Res,2004,64(5):1703-1711.
[13]Terashima M,Maesawa C,Oyama K,et al.Gene expression profiles in human gastric cancer:expression of maspin correlates with lymph node metastasis[J].Br J Cancer,2005,92(6):1130-1136.
[14]Zhang W,Shi HY,Zhang M.Maspin overexpression modulates tumor cell apoptosis through the regulation of Bcl-2family proteins[J].BMC Cancer,2005,5(1):50-55.
[15]Li Z,Shi HY,Zhang M.Targeted expression of maspin in tumor vasculatures induces endothelial cell apoptosis[J].Oncogene,2005,24(20):2008-2019.

