幽门螺杆菌ureI核酸疫苗免疫活性的初步研究
李 杰,于 文,刘 胜,张 艳,朱翠明,吴移谋
幽门螺杆菌(Helicobacter pylori,H.pylori)是一种寄居于人体消化道,并可引起胃炎、消化性溃疡、胃腺癌以及胃黏膜相关淋巴组织淋巴瘤的病原体[1-4]。目前临床治疗 H.pylori感染主要采用质子泵抑制剂和两种抗生素的三联疗法,但缺点是容易引起耐药株的产生从而导致治疗失败。研究高效的H.pylori疫苗,不但能通过诱发特异性免疫应答而清除病原体,同时也能诱导相应的免疫记忆来防止H.pylori再感染。在众多的候选抗原中,尿素通道基因(ureI)是H.pylori的管家基因,几乎分布于H.pylori所有亚型当中,在H.pylori于酸环境中的存活、定植上起关键作用。UreI蛋白高度保守,不同菌株的UreI蛋白之间同源性非常高[5-6]。Mollenhauer等[7]发现,抑制 UreI的活性则有利于胃内H.pylori的清除。本研究选用本课题组前期构建并鉴定无误的ureI核酸疫苗[8],分析其免疫小鼠后体液免疫及细胞免疫水平,为进一步研究该疫苗的免疫保护作用及新的H.pylori核酸疫苗的研制提供实验依据。
1 材料与方法
1.1 动物和载体 C57BL/6雌性小鼠,6周龄,体重17~20g,由上海斯莱克实验动物中心提供;E.coli JM109、E.coli BL21、pcDNA3.1(+)以及pcDNA3.1(+)/ureI真核表达载体为本实验室前期所构建[8]。
1.2 试剂 蛋白纯化试剂盒购自Merk;BCA蛋白浓度测定试剂盒为碧云天生物技术研究所产品;IFN-γ、IL-4ELISA试剂盒为美国eBioscience公司产品;兔抗H.pylori多克隆抗体购自Abcam;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗为北京康为世纪生物科技有限公司产品;MTT为南京建成生物工程研究所产品。
1.3 免疫接种 30只雌性C57BL/6小鼠随机分为3 组:PBS 组、pcDNA3.1(+)组、pcDNA3.1(+)/ureI组,每组10只。将空质粒和重组质粒分别用无菌PBS稀释至1g/L,100μL接种于小鼠左后腿股四头肌,每2周免疫1次,共免疫4次。
1.4 抗体滴度测定 初次免疫当天及其后的第2、4、6、8和10周分别采取小鼠断尾采血,分离血清,间接ELISA法检测抗体滴度:用重组的UreI蛋白包被96孔酶标板,不同浓度倍比稀释的免疫小鼠血清为一抗,HRP标记的羊抗鼠IgG为二抗。酶标仪读取450nm波长吸光度值,实验组和阴性对照组吸光度比值≥2.0时最大的血清稀释倍数为其抗体滴度[9]。
1.5 细胞因子检测 获取免疫后10周小鼠脾脏,制成单个细胞悬液,加入5mL 0.83%NH4Cl孵育5min以溶解红细胞;1 000r/min离心5min收集淋巴细胞后用含10%小牛血清的RPMI-1640培养基重悬并调整其密度为6×106/mL,1mL/孔转于24孔板中,每孔中加入UreI抗原10μg后于37℃、5%CO2培养箱中培养72h。ELISA法检测培养上清中IL-4和IFN-γ的含量。
1.6 脾淋巴细胞增殖实验 将分离的脾淋巴细胞(1×106/mL)接种于96孔板中(200μL/孔);对照组不加UreI抗原;实验组每孔加UreI抗原2μg,37℃、5%CO2培养箱中培养72h。随后各孔加入MTT(5g/L)20μL,继续培养4h后弃上清,加入DMSO 150μL,震荡混匀15min,570nm波长测定各孔的A值。根据刺激指数(Stimulation index,SI)大小来判断增殖程度。
1.7 ureI在小鼠肌细胞内的表达 免疫后10周,取腿部肌肉提取总DNA,以特异性引物ureI-P1/P2扩增ureI基因。同时取约0.5cm腿部肌肉浸泡于70%酒精中,制备石蜡组织切片。经烘烤,二甲苯、乙醇浸泡后,放组织切片于加热至95℃0.01 mol/L的枸橼酸钠缓冲溶液(pH6.0)中10~15 min;PBS洗涤5min;5%BSA室温封闭20min;滴加一抗(1∶500兔抗H.pylori多克隆抗体);37℃孵育1h;洗涤、孵育二抗(FITC标记的山羊抗兔IgG),置荧光显微镜下观察拍照并保存。
1.8 统计学方法 采用SPSS 15.0统计学软件处理数据,结果采用均数±标准差表示,多组比较采用one-way方差分析和Student’s t检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 血清特异性抗体的检测 pcDNA3.1(+)/ureI免疫组在免疫10周后抗体滴度达到1∶2 048,其 A 值显著升高,与pcDNA3.1(+)以及PBS组相比,具有统计学意义(P<0.01)。结果如表1所示。2.2 IFN-γ和IL-4表达水平的检测 ELISA结果显示,pcDNA3.1(+)/ureI实验组小鼠脾细胞培养上清中IFN-γ和IL-4的水平明显高于pcDNA3.1(+)组和PBS组(P<0.01),具有统计学意义。
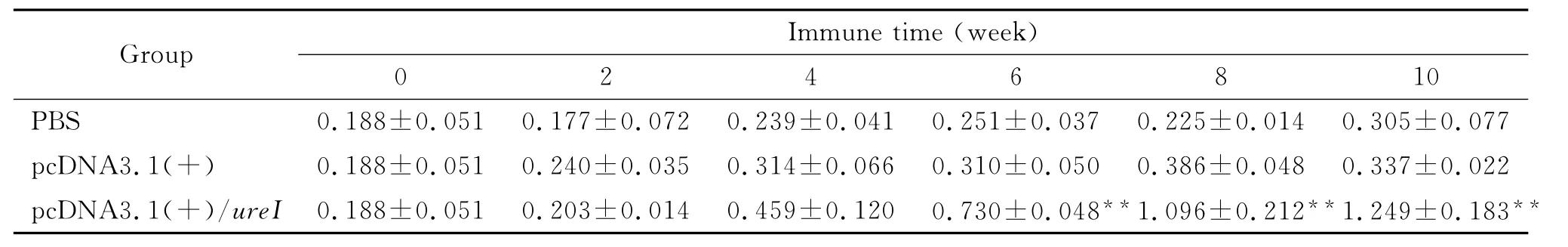
表1 不同免疫时间各组特异性抗体A450值Tab.1 A450of special IgG antibody in immunized mice
表2 免疫小鼠脾细胞培养上清中IFN-γ和IL-4含量(x±s,pg/mL)Tab.2 IFN-γand IL-4levels in supernatant of cultured spleen cells from immunized mice
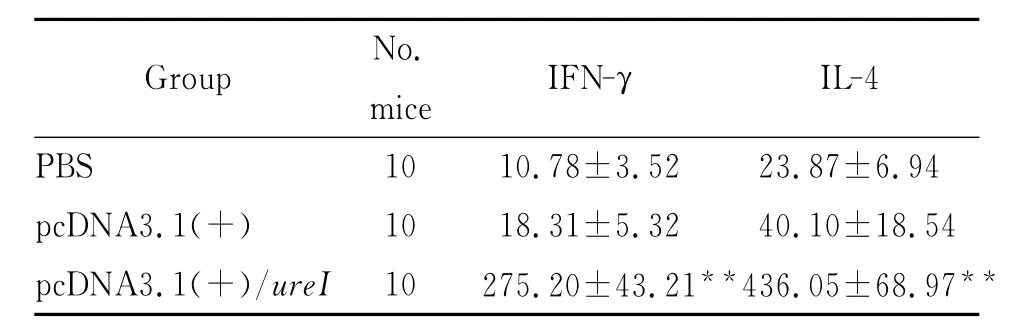
表2 免疫小鼠脾细胞培养上清中IFN-γ和IL-4含量(x±s,pg/mL)Tab.2 IFN-γand IL-4levels in supernatant of cultured spleen cells from immunized mice
Note:**P<0.01VS pcDNA3.1(+)and PBS group
Group No.mice IFN-γIL-4 PBS 10 10.78±3.52 23.87±6.94 pcDNA3.1(+) 10 18.31±5.32 40.10±18.54 pcDNA3.1(+)/ureI 10 275.20±43.21**436.05±68.97**
2.3 脾淋巴细胞增殖情况 小鼠脾淋巴细胞经纯化的 UreI蛋白刺激后,pcDNA3.1(+)/ureI免疫组细胞增殖活性明显增强,与pcDNA3.1(+)组及PBS对照组比较(P<0.01),具有统计学意义(表3)。
2.4 ureI在小鼠肌细胞内表达
2.4.1 PCR检测ureI基因在小鼠肌细胞中的表达 以ureI-P1/P2为特异性引物进行基因扩增,电泳后可见1条约585bp的基因片段(图1),表明ureI基因可在肌细胞中表达。
2.4.2 免疫组化检测 图2所示,pcDNA3.1(+)及PBS对照组小鼠组织切片几乎不见荧光,而重组质粒pcDNA3.1(+)/ureI实验组小鼠组织切片可见黄绿色荧光,组织中由于荧光的存在而使组织轮廓在暗视野下依稀可见。
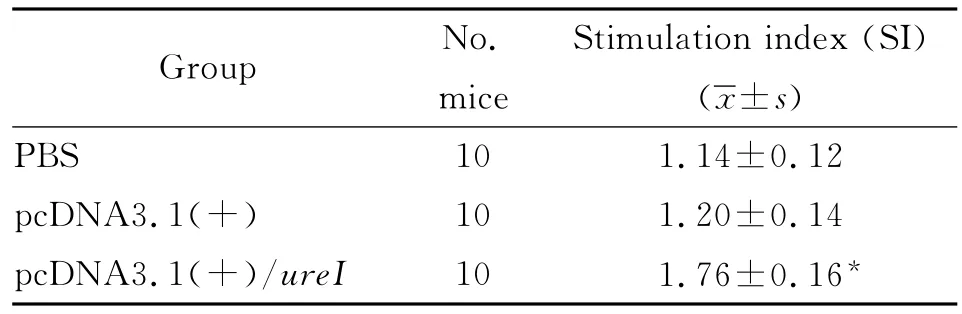
表3 免疫小鼠的脾淋巴细胞增殖反应(刺激指数)Tab.3 Stimulation index (SI)of spleen cells derived from immunized mice

图1 小鼠肌细胞中ureI PCR扩增结果1.pcDNA3.1(+)/ureI免疫后 PCR 扩增产物;2.pcDNA3.1(+)对照组;M.DNA markerFig.1 PCR products of ureI gene in muscle cells of mice1:Products of ureI in muscle cells of mice immunized with pcDNA3.1(+)/ureI;2:pcDNA3.1(+)control;M:DNA marker

图2 小鼠肌肉组织ureI基因表达的免疫荧光分析(×100)A:PBS免疫组;B pcDNA3.1(+)免疫组;C:pcDNA3.1(+)/ureI组Fig.2 Immunofluorescence analysis of ureIexpression in muscular tissue of miceA:Muscular tissue of mice immunized by PBS;B:Muscular tissue of mice immunized by pcDNA3.1(+);C:Muscular tissue of mice immunized by pcDNA3.1(+)/ureI
3 讨 论
理想的疫苗应该能够诱导机体产生高效特异的免疫保护性,且无毒或毒性较弱,便于制备。早期的动物实验研究表明:H.pylori全细胞裂解物由于抗原成分复杂,免疫效果较差、不良反应较大,已逐步被亚单位疫苗取代[10]。Myers等[11]以重组 UreB加大肠杆菌不耐热肠毒素口服免疫小鼠后,63%~100%的小鼠免受H.pylori近缘菌猫螺杆菌的攻击,表明尿素酶具有免疫保护作用。Lee等 用重组UreB加LT接种于已感染H.pylori的恒河猴,发现可减少H.pylori的胃内定植数,表明尿素酶具有免疫治疗作用。因此,Ure是目前最理想的保护性抗原之一,具有开发的潜在价值。
随着新型核酸疫苗的出现,人们开始尝试着用核酸做疫苗来预防和治疗H.pylori感染。有研究显示应用编码Hsp或UreB核酸疫苗皮内免疫小鼠引起强烈的黏膜免疫反应,大大降低了小鼠的感染率,表明核酸疫苗可以产生一定的免疫保护作用,并且具有生产简单,易于存储等许多优点[13-15]。
本研究采用pcDNA3.1(+)/ureI重组质粒免疫小鼠后,结果表明特异性抗体的产生与免疫时间和免疫次数成正比,在免疫后4周时小鼠血清中可以检测到特异性抗体,至10周时,pcDNA3.1(+)/ureI免疫组的抗体滴度达到1∶2 048,而整个免疫过程中pcDNA3.1(+)和PBS免疫组均未检出特异性抗体,表明pcDNA3.1(+)/ureI核酸疫苗能够诱导小鼠产生较强的特异性体液免疫应答。
另外,本研究结果显示,pcDNA3.1(+)/ureI免疫组的小鼠脾淋巴细胞经重组UreI蛋白刺激后,其增殖反应明显高于pcDNA3.1(+)和PBS免疫组,且pcDNA3.1(+)/ureI免疫组的细胞上清中IFN-γ的浓度明显高于pcDNA3.1(+)和PBS免疫组,IFN-γ的表达水平在一定程度上反映了细胞免疫应答水平。因此,本研究结果表明构建的重组pcDNA3.1(+)/ureI核酸疫苗可以诱导小鼠产生特异性的细胞免疫应答,从而证实pcDNA3.1(+)/ureI核酸疫苗能在小鼠体内有效表达且具有较强的免疫保护性。
综上所述,我们构建的核酸疫苗pcDNA3.1(+)/ureI通过肌肉注射C57BL/6小鼠能够在小鼠体内表达,并刺激小鼠产生较强的体液免疫和细胞免疫应答,为后续试验奠定了基础。下一步我们将构建H.pylori感染的动物模型,用来评价核酸疫苗pcDNA3.1(+)/ureI在预防H.pylori感染和治疗H.pylori感染方面的效果,如细菌的根除率、炎症降低的程度等,为继续探索高效的人用H.pylori疫苗打下一定基础。
[1]Peek RM.Helicobacter pylori infection and disease:from humans to animal models[J].Dis Model Mech,2008,1(1):50-55.DOI:10.1242/dmm.000364
[2]Souza RC,Lima JH.Helicobacter pylori and gastroesophageal reflux disease:a review of this intriguing relationship[J].Dis E-sophagus2009223256-263.
[3]Yamaoka Y,Kato M,Asaka M.Geographic differences in gastric cancer incidence can be explained by differences between Helicobacter pylori strains[J].Intern Med,2008,47(12):1077-1083.
[4]Ernst PB,Gold BD.The disease spectrum of Helicobacter pylori:the immunopathogenesis of gastroduodenal ulcer and gastric cancer[J].Annu Rev Microbiol,2000,54:615-640.
[5]Gueneau P,Loiseaux-De Goer S.Helicobacter:molecular phylogeny and the origin of gastric colonization in the genus[J].Infect Genet Evol,2002,1(3):215-223.
[6]Weeks DL,Sachs G.Sites of pH regulation of the urea channel of Helicobacter pylori[J].Mol Microbiol,2001,40(6):1249-1259.
[7]Mollenhauer-Rektorschek M,Hanauer G,Sachs G,etal.Expression of UreI is required for intragastric transit and colonization of gerbil gastric mucosa by Helicobacter pylori[J].Res Microbiol,2002,153(10):659-666.
[8]Li J,Yu W,Zhang Y,etal.Construction and expression of eukaryotic expression vector of urea channel protein gene (ureI)from Helicobacter pylori[J].J Nanhua Univ(Med Ed),2010,38(2):155-158.(in Chinese)李杰,于文,张艳,等.幽门螺杆菌尿素通道蛋白ureI基因真核表达载体的构建及表达[J].南华大学学报:医学版,2010,38(2):155-158.
[9]Yu DH,Cai H,Zhu YX.DDA is more efficacious than MPL as adjuvants that enhanced immunogenicity and protection of combined DNA vaccine against Mycobacterium tuberculosisa[J].Progr Biochem Biophysics,2005,32(8):765-770.(in Chinese)余大海,蔡宏,朱玉贤.佐剂DDA和 MPL对提高结核杆菌组合DNA疫苗免疫效果的比较研究[J].生物化学与生物物理进展,2005,32(8):765-770.
[10]Del Giudiee G,Covacci A,Telford JL,etal.The design of vaccines againsthelicobacter pylori and their development[J].Annu Rev Immun,2001,19:523-563.
[11]Myers GA,Ermak TH,Georgakopoulos K,etal.Oral immunization with recombinanthelicobacter pylori urease confers long-lasting immunity againsthe1icobacter felis infection[J].Vaccine,1999,17(11/12):1394-1403.
[12]Lee CK,Soike K,Hill J,etal.Immunization with recombinanthelicobacter pylori urease decreases colonization levels following experimental infection of rhesus monkeys[J].Vaccine,1999,17(11/12):1493-1505.
[13]Miyashita M,Joh T,Watanabe K,et a1.Immune responses in mice to intranasal and intracutaneous administration of a DNA vaccine encoding Helicobacter pylori-catalase[J].Vaccine,2002,20(17/18):2336-2342.
[14]Hatzifoti C,Bajaj-Elliott M,Dorrell N,et a1.A plasmid immunization construct encoding UreaseB of Helicobacter pylori induces an antigen-specific antibody response and upregulates the expression of beta-defensins and IL-10in the stomachs of immunized mice[J].Vaccine,2004,22(20):2651-2659.
[15]Srivastava IK,Liu MA.Gene vaccine[J].Ann Intern Med,2003,138(7):550-559.
[16]de Rosbo NK,Ben-Nun A.T-cell responses to myelin antigens in multiple sclerosis;relevance of the predominant autoimmune reactivity to myelin oligodendrocyte glycoprotein[J].J Autoimmun,1998,11(4):287-299.

