TTV病毒体外培养体系的建立及超微形态观察
张 娜,刘学芳,李建国,张振强
TTV 病毒(Torque teno virus),又称输血传播病毒(Transfusion transmitted virus),根据ICTV第8次报告,TTV病毒属于细项圈病毒属(Anellovirus),暂不归入任何科。TTV病毒首次报道于日本,在一例输血后肝炎(非甲~非庚型肝炎)患者体内分离[2],随后多个国家均有报道,目前已确定该病毒在世界范围内流行。TTV病毒是一种环状、单股、负链DNA病毒,直径20nm左右,无囊膜,氯化铯中的浮密度1.31g/cm3~1.35g/cm[3]。
TTV病毒感染后可导致非甲~庚型肝炎,同时在肝硬化、丙型肝炎、急性甲型肝炎、慢性乙型肝炎、急性乙型肝炎中也有较高的感染率。此外,TTV病毒在肝癌、传染性胃肠炎、女性生殖系统疾病、输血性传播疾病以及结肠癌等多种疾病中均有较高感染率。2008年,河南中医学院教授李建国在慢性胃炎患者的胃组织电镜样本中观察到一种微小病毒(命名为L08),直径22.18~22.63nm,在胃黏膜上皮细胞胞浆内和核内均有发现,后经鉴定为TTV病毒感染[4]。为了进一步研究该株TTV病毒的生物学特性,在体外建立了适应TTV病毒增殖的细胞系,并对病毒的超微形态进行进一步的观察。
1 材料与方法
1.1 毒株与细胞 TTV病毒(L08株)由河南中医学院病理实验中心分离、鉴定、保存。人胃腺癌细胞SGC-7901,人胃粘膜细胞 GES-1,均购自北京伯乐生命科学发展有限公司。
1.2 试剂 MEM培养液购自GIBCO;胰酶购自索来宝生物;胎牛血清购自民海血清。
1.3 样品制备 用灭菌的磷酸盐缓冲液(PBS)分别将病料清洗干净,剪碎,按1∶5(W/V)的比例加入pH7.4的PBS进行研磨,充分混匀,反复冻融3次后,再加入青霉素1 000u/mL,链霉素1 000μg/mL。置4℃冰箱过夜,翌日5 000r/min离心20 min,吸取上清液,无菌检验合格后,备用。
1.4 病毒接种与培养[5]参考文献复苏冻存的细胞株SGC-7901和GES-1,待细胞长成单层后,使用无菌PBS缓冲液清洗细胞2遍,接种含TTV病毒液(L08株),接毒量与维持液的比例为1∶5~1∶10,置37℃5%CO2细胞培养箱中吸附1h,弃去病毒液,换含2%新生牛血清的细胞维持液,再加入维持液(含2%犊牛血清的MEM营养液),同时设正常对照细胞。置37℃培养,逐日在镜下观察,若无细胞病变(CPE),培养5d收获进行盲传,若出现细胞病变,当出现80%细胞病变时收获,连续传至第8代,同时设未接毒细胞作为对照。
1.5 病毒滴度测定 取F1~F10代SGC-7901细胞毒各2mL,反复冻融3次,3 000r/min离心10 min,取上清液进行10倍梯度稀释,分别接种到96孔细胞培养板中,200μL/孔,每个梯度接种8孔,共检测8组,同时设PBS对照组,根据Reed-Muench法计算各代病毒的TCID50。
1.6 透射电镜观察[6]当CPE达80%时收集细胞毒,将细胞从细胞瓶中轻轻刮下,4℃3 000r/min离心10min,取出细胞团,包埋于2%的低熔点琼脂糖内,按照文献方法进行电镜样品制备,步骤如下:①固定:将细胞团浸入25mL/L戊二醛溶液中,4℃固定2h以上;②洗涤:将细胞团取出使用磷酸盐缓冲液洗涤3次,每次15min;③后固定:将细胞团浸入20mL/L锇酸溶液中,4℃固定2h;④洗涤:将细胞团取出使用磷酸盐缓冲液洗涤3次,每次15 min;⑤脱水:依次使用30%丙酮、50%丙酮、70%(加醋酸铀)丙酮、80%丙酮对细胞样品脱水,每次5 min;⑥置换、浸透和包埋:将细胞团包埋入环氧树脂中;⑦切片和染色:细胞样品切片,厚度为80nm左右,使用醋酸铀和柠檬酸铅双染。细胞样品制备完毕后,使用奥林巴斯透射电镜进行观察。
2 结 果
2.1 病毒细胞培养结果 TTV病毒首次接种GES-1和SGC-7901细胞后,96h内两种细胞病变均不典型,仅出现悬浮细胞增多、折光性增强等变化,盲传3代后,SGC-7901细胞病变开始趋于稳定,72hp.i.SGC-7901细胞出现明显的CPE,96hp.i.CPE比例高达80%以上,SGC-7901细胞出现变圆、皱缩、脱落、及折光性增强的变化,同时形成大小不等的圆形或椭圆形噬斑,数量较多(图1A),培养至96h的对照组SGC-7901细胞胞质清亮,细胞界限明显,形态规则(图1B)。
病毒盲传8代后,GES-1细胞病变仍不典型,96 h p.i.细胞变为多边形,并且细胞间隙变大(图1C),培养至96h,对照组GES-1细胞生长为多边形,与接毒组形态相似(图1D)。

图1 TTV病毒接种SGC-7901和GES-1细胞后的形态学变化(400×)A:SGC-7901细胞变圆、皱缩、脱落、形成大量噬斑,96hp.i.;B:对照组SGC-7901细胞形态,96h;C:GES-1细胞呈多边形,细胞间隙变大96hp.i.;D:对照组 GES-1细胞形态,96hFig.1 Morphological changes of the SGC-7901and GES-1after TTV viral infection(400×)A:SGC-7901cells rounding,shrinking,shedding and forming big plaque,96hours p.i.;B:The appearance of the normal SGC-7901cells at 96hours;C:GES-1cells showed polygon appearance and intercellular space increased at 96hours p.i.D:The appearance of the normal GES-1cells at 96hours.
2.2 病毒滴度测定F1~F10代TTV病毒SGC-7901细胞TCID50测定结果见图2,病毒毒价从F1代至F3代呈现快速上升的趋势,至F4代以后,病毒毒价稳定在106.0~106.8之间,并且变化幅度较小。同时,TTV病毒接种GES-1后细胞病变不典型,无法检测TCID50。
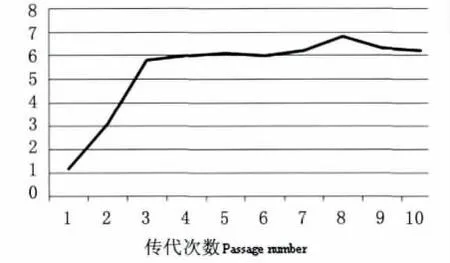
图2 不同代次TTV细胞毒的TCID50测定结果Fig.2 TCID50for viruses of different generations adapting for SGC-7901cells
2.3 透射电镜观察 SGC-7901细胞毒电镜标本观察结果显示,在感染细胞胞浆、细胞核、核膜等区域均观察到病毒粒子,病毒呈现致密球形外观,直径20nm左右,无囊膜,在胞浆内呈散在分布,如图3A箭头所示;被病毒感染细胞的细胞核变形,核膜扩张,在核膜下方聚集着大量的病毒粒子,如图3B左侧箭头所示,细胞核内部有大量病毒粒子聚集,如图3B右侧箭头所示。
3 讨 论
TTV病毒是从急性肝炎患者体内首次分离的,患者临床表现为非甲-庚型肝炎,相关报道显示,在急性肝炎期,TTV弥漫分布于肝小叶内,慢性肝炎则主要分布于汇管附近,所以一般认为TTV为一种嗜肝病毒,TTV病毒分离困难,在传统的培养基上生长困难,但是2005年美国学者Desai M实验证实,TTV病毒可以在张氏肝细胞系(Chang Liver)、外周血单核细胞系(PBMC)和Raji细胞系中成功增殖,并产生明显的细胞病变[7]。Mariscal L.F.等的研究也证实,使用植物血凝素刺激的外周血单核细胞系(PBMC)可以在体外成功培养TTV病毒[8]。
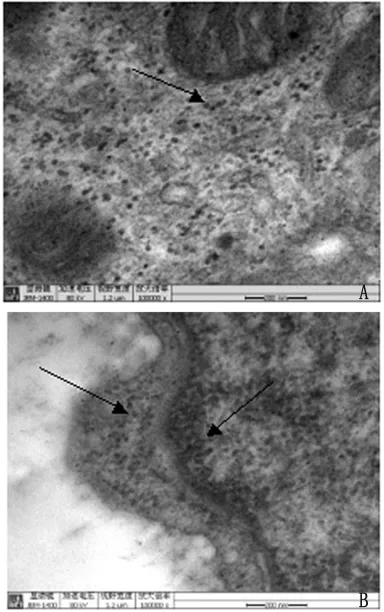
图3 TTV病毒超微形态观察(100 000×)A:TTV病毒粒子散在分布在SGC-7901细胞的胞浆内,如箭头所示;B:TTV病毒粒子聚集分布在SGC-7901细胞的细胞核和核膜下方,如箭头所示Fig.3 Ultramicro-morphology observation of TTV (100 000×)A:TTV diffused in cytoplasm,as showed by arrow;B:TTV gathered below nucleus and nuclear membrane,as showed by arrow
TTV病毒由于个体小,结构简单,抵抗力强,在自然界广泛存在,特别是近年出现大量关于TTV病毒造成水体污染的报道,使TTV病毒检测称为衡量水体污染的重要指标[9],2009年英国学者Braham,S在一例急性胃肠炎患者的体内分离到一种未知病毒,后经鉴定为TTV病毒的急性暴发[10],2011年,巴西学者Pinho-Nascimento C.A在临床肠胃炎患者的粪便样本中检测到TTV DNA,并且临床检查阳性率高达91.1%[11],多项实验结果证实,TTV病毒可经粪-口途径进行传播。本试验所使用的TTV毒株在临床上表现出与慢性胃炎的相关性,采用人胃低分化腺癌细胞SGC-7901,人胃粘膜细胞GES-1对病毒进行体外培养,盲传3代后,SGC-7901细胞病变典型,并取得了良好的增殖效果。在GES-1细胞系上盲传8代,细胞病变仍不明显,结果证实TTV病毒L08株表现出对人胃腺癌细胞的偏爱性。
TTV病毒的检测方法多种多样,常用方法包括:分子生物学检测法、血清学检测法、电镜观察法等,每种方法都有其优点和不足,其中电镜观察法是病毒学检测的“金标准”,具有直观、准确等特点,为了确定TTV病毒在SGC-7901细胞内已稳定增殖,我们将受病毒感染的细胞进行收集,制备电镜样品进行观察,结果显示,在细胞质和细胞核内均发现了大量的病毒粒子,病毒的大小和外观与TTV病毒的相关报道一致,所以可以作为病毒培养成功的标志,此外,我们对该毒株的病原学研究、DNA序列分析以及动物模型的建立等工作正在进行中。
[1]Biagini P.Classification of TTV and related viruses(anelloviruses)[J].Curr Top Microbiol Immunol,2009,331:21-33.
[2]Nishizawa T,Okamoto H,Konishi K.A novel DNA virus(TTV)associated with elevated transaminase levels in posttransfusion hepatitis of unknown etiology[J].Biochem Biophys Res Commun,1997,241(1):92-97.DOI:10.1006/bbrc.1997.7765
[3]Hino S,Miyata H.Torque teno virus(TTV):current status[J].Rev Med Virol,2007,17(1):45-57.DOI:10.1002/rmv.524
[4]Li NN.Examine the parvovirus from the patients'gastric mucosa of chronic superficial gastritic,chronic atrophic gastritic and gastric adenocarcinoma with electron microscope and in situ hybridization technique[D].Zhengzhou:Henan Traditional Chinese Medical College,2008:1-30.(in Chinese)李宁宁.慢性浅表性、萎缩性胃炎及胃腺癌中微小病毒的电镜技术、原位杂交法检测[D].郑州:河南中医学院,2008:1-30.
[5]Fu JH.Practical virology experimental technology[M].Jinan:Shandong Science Publishing House,2011:50-80.(in Chinese)傅继华.病毒学实用实验技术[M].济南:山东科学技术出版社,2001:50-80.
[6]Hong T.Biomedicine ultrastructure and electron microscope technologyM .BeijingScience Publishing House198020-56.(in Chinese)洪涛.生物医学超微结构与电子显微镜技术[M].北京:科学出版社,1980:20-56.
[7]Desai M,Pal R,Deshmukh R,etal.Replication of TT virus in hepatocyte and leucocyte cell lines[J].J Med Virol,2005,77(1):136-143.DOI:10.1002/jmv.20426
[8]Mariscal LF,Lopez-Alcorocho JM,Rodriguez-Inigo E,etal.TT virus replicates in stimulated but not in nonstimulated peripheral blood mononuclear cells[J].Virology,2002,301(1):121-129.DOI:10.1006/viro.2002.1545
[9]Hamza IA,Jurzik L,Uberla K,etal.Evaluation of pepper mild mottle virus,human picobirnavirus and Torque teno virus as indicators of fecal contamination in river water[J].Water Res,2011,45(3):1358-1368.DOI:10.1016/j.watres.2010.10.021
[10]Braham S,Iturriza-Gomara M,Gray J.Detection of TT virus by single-primer sequence-independent amplification in multiple samples collected from an outbreak of gastroenteritis[J].Arch Virol,2009,154(6):981-985.DOI:10.1007/s00705-009-0387-8
[11]Pinho-Nascimento CA,Leite JP,Niel C,etal.Torque teno virus in fecal samples of patients with gastroenteritis:prevalence,genogroups distribution,and viral load[J].J Med Virol,2011,83(6):1107-1111.DOI:10.1002/jmv.22024

