铁皮石斛茎乙醇提取物正丁醇溶性部分化学成分研究
魏泽元,陆静金,金传山,夏宏*
(1.安徽医科大学 附属省立医院,安徽 合肥 230001; 2.安徽中医药大学,安徽 合肥 230031)
铁皮石斛茎乙醇提取物正丁醇溶性部分化学成分研究
魏泽元1,陆静金2,金传山2,夏宏1*
(1.安徽医科大学 附属省立医院,安徽 合肥 230001; 2.安徽中医药大学,安徽 合肥 230031)
目的:研究铁皮石斛茎乙醇提取物的正丁醇溶性部分的化学成分。方法:利用硅胶、凝胶及反相硅胶等色谱方法对正丁醇溶性部分进行分离,根据质谱、核磁共振等波谱技术对分离的单体化合物进行结构鉴定。结果:从铁皮石斛的正丁醇部位分离得到7个糖苷类化合物,分别鉴定为:芹菜素-7-O-β-D-葡萄糖苷(1),枸橼苦素C(2),3,5-二甲氧基-4-羟基苯基-1-O-β-D-吡喃葡萄糖苷(3),7-甲氧基香豆素-6-O-β-D-吡喃葡萄糖苷(4),淫羊藿醇A2-4-O-β-D-吡喃葡萄糖苷(5),灯盏花素2(6),(+)-丁香脂素-O-β-D-吡喃葡萄糖苷(7)。结论:化合物1,2,4均为首次从铁皮石斛中分离得到。
铁皮石斛;正丁醇部分;化学成分;结构鉴定
铁皮石斛DendrobiumofficinaleKimura et Migo为兰科石斛属名贵药用植物,具有很高的药用价值,为《中国药典》2010年版收载品种,具有益胃生津,滋阴清热功能。用于热病津伤,口干烦渴,胃阴不足,食少干呕,病后虚热不退,阴虚火旺,骨蒸劳热,目暗不明,筋骨痿软。现代药理活性研究表明其具有增强人体免疫力、抗氧化、抑制肿瘤细胞增殖等活性[1]。野生铁皮石斛生于海拔100~3 000 m的山地半阴湿岩石、树皮上,喜温暖湿润气候和半阴湿的环境,不耐寒[2]。由于铁皮石斛生长条件的特殊性和分布的局限性,又经长期采挖,自然资源濒临枯竭,市场供应紧缺,价格昂贵。目前,国内评定铁皮石斛质量的指标主要以性状和粗多糖为标准[3],然而这种质量控制方法不完善,迄今仍没有确定一个化学成分作为铁皮石斛的质量控制标准。笔者通过初步的提取分离,发现铁皮石斛的正丁醇部分浸膏含量远高于乙酸乙酯溶性部分。为探明铁皮石斛的药效物质基础,并为其质量控制提供依据,开展了铁皮石斛正丁醇部分的化学成分研究。
1 仪器与材料
1.1 仪器
Brucker AM-400型超导核磁共振仪,四甲基硅烷为内标;Xevo TQ-S超高压液相色谱三重四极杆串联质谱联用仪。
1.2 材料
柱色谱硅胶(青岛海洋化工厂,100~200目,200~300目);薄层色谱硅胶(烟台汇友硅胶开发有限公司,GF254型);反相材料RP-18(Merck公司);Sephadex LH-20(北京化工厂)。显色剂为10%浓H2SO4-乙醇溶液。
1.3 药材来源
新鲜的铁皮石斛茎,购自浙江省中药材市场,自然风干,由安徽中医药大学药学院副院长金传山副教授鉴定为铁皮石斛DendrobiumofficinaleKimura et Migo的干燥茎。
2 提取与分离
取铁皮石斛干燥茎3 kg,粉碎后用80%乙醇回流提取,回收乙醇得浸膏289 g。加适量水形成混悬物,依次按极性从小到大的顺序,采用乙酸乙酯、水饱和正丁醇分步萃取,分别合并萃取液,减压浓缩得到各个萃取部分,分为乙酸乙酯萃取部分、正丁醇萃取部分和水溶性部分。
将正丁醇萃取部分193 g与0.4 kg硅胶(100~200目)拌样,1.9 kg硅胶干法装柱,三氯甲烷-甲醇(15∶1~1∶1)梯度洗脱,得到7个组分,组分1同乙酸乙酯萃取部分(留样)进行TLC对照,多个点重叠,故未进一步分离。组分2经硅胶柱色谱,三氯甲烷-甲醇(20∶1~1∶1)梯度洗脱,经Sephadex LH-20柱再纯化,得到化合物1(23 mg)和5(8 mg)。组分3经硅胶柱色谱,三氯甲烷-甲醇(15∶1~1∶1)梯度洗脱,再经RP-18(40%甲醇水梯度洗脱)和Sephadex LH-20柱色谱再纯化,得到化合物3(10 mg)。组分4经硅胶柱色谱,三氯甲烷-甲醇(15∶1)等度洗脱,再经Sephadex LH-20柱色谱纯化,得到化合物4(7 mg)。组分5经硅胶柱色谱,三氯甲烷-甲醇(20∶1~1∶1)梯度洗脱,再依次经RP-18柱色谱(30%~100%甲醇水梯度洗脱)、硅胶制备薄层色谱和Sephadex LH-20柱色谱纯化,得到化合物2(5 mg)和6(8 mg)。组分6经硅胶柱色谱,三氯甲烷-甲醇(15∶1)等度洗脱,再经Sephadex LH-20柱色谱纯化,得到化合物7(16 mg)。最后1个组分经TLC显色,呈灰色和浅黄色条带,成点性差,未进行进一步分离。
3 结构鉴定
化合物1:黄色粉末;C21H20O10,ESI-MS显示准分子离子峰m/z:431[M-H]-;1H-NMR (500 MHz,CD3OD)δ:7.79 (2H,d,J=8.4 Hz,H-2′,6′),7.52 (2H,d,J=8.5 Hz,H-3′,5′),7.02 (1H,s,H-6),6.98 (1H,s,H-3),6.87 (1H,s,H-8),5.86 (1H,d,J=6.9 GlcH-1″);13C-NMR(100 MHz,CD3OD) δ:182.3 (s,C-4),164.7 (s,C-9),164.0 (s,C-7),163.0 (s,C-5),162.5 (s,C-4′),158.0 (s,C-10),129.0 (d,C-2′,6′),122.4 (s,C-1′),116.0 (d,C-3′,5′),106.6 (s,C-2),104.1 (d,C-6),100.7 (d,C-8),95.4 (d,C-3),102.0 (d,C-1″),79.0 (d,C-3″),78.7 (d,C-5″),75.0 (d,C-2″),71.3 (d,C-4″),62.5 (t,C-6″)。以上数据与文献报道相符[4],故鉴定化合物1为芹菜素-7-O-β-D-葡萄糖苷,首次从铁皮石斛中分离得到。化学结构见图1。
化合物2:白色粉末;C16H22O7,ESI-MS显示准分子离子峰m/z:327[M-H]-;1H-NMR(400 MHz,CD3OD)δ:7.10 (1H,d,J=8.0 Hz,H-6),6.85 (1H,s,H-2),6,77 (1H,d,J=8.0 Hz,H-5),5.98 (1H,m,H-8),5.10 (2H,m,H-9),4.87 (1H,d,J=7.0 Hz,H-1′),3.90 (3H,s,H-3-OMe),3.50 (2H,brd,J=7.6 Hz,H-7);13C-NMR(100 MHz,CD3OD) δ:150.8 (s,C-3),146.3 (s,C-4),138.9 (d,C-8),136.7 (s,C-4),122.0 (d,C-5),118.3 (d,C-6),116.0 (t,C-9),114.4 (d,C-2),102.3 (d,C-1′),78.2 (d,C-3′),77.8 (d,C-5′),75.1 (d,C-2′),71.3 (d,C-4′),62.5 (t,C-6′),56.9 (q,C-OMe),41.0 (t,C-7)。以上数据与文献报道相符[5],故鉴定化合物2为枸橼苦素C,首次从铁皮石斛中分离得到。化学结构见图1。
化合物3:白色粉末;C14H20O9,ESI-MS 显示准分子离子峰m/z:355[M+Na]+;1H-NMR(400 MHz,CD3OD)δ:6.12(2H,s,H-3,5),4.83(1H,d,J=6.9 Hz,H-1′),3.86(6H,s,H-2,6-OMe);13C-NMR(100 MHz,CD3OD) δ:150.0(s,C-4),148.2(s,C-2,6),130.0(s,C-1),94,7(s,C-3,5),102.0 (d,C-1′),78.2 (d,C-3′),77.8 (d,C-5′),75.7 (d,C-2′),71.4 (d,C-4′),62.7 (t,C-6′),56.8(q,C-2,6-OMe),40.7 (t,C-7)。以上数据与文献报道相符[6],故鉴定化合物3为3,5-二甲氧基-4-羟基苯基-1-O-β-D-吡喃葡萄糖苷。化学结构见图1。
化合物4:白色粉末;C16H18O9,ESI-MS 显示准分子离子峰m/z:377[M+Na]+;1H-NMR(400 MHz,CD3OD)δ:7.90(1H,d,J=9.6 Hz,H-4),7.20 (1H,s,H-8),7.17 (1H,s,H-5), 6.30 (1H,d,J=9.6 Hz,H-3),5.07 (2H,d,J=7.8 Hz,H-1′),3.89 (3H,s,H-7-OMe);13C-NMR(100 MHz,CD3OD) δ:162.9 (s,C-2),151.8 (s,C-7),150.6 (s,C-9),148.3 (s,C-6),145.6 (d,C-4),114.1 (d,C-3),112.8 (s,C-10),110.0 (d,C-5),102.0 (d,C-8),105.1 (d,C-1′),78.7 (d,C-3′),77.8 (d,C-5′),75.0 (d,C-2′),71.7 (d,C-4′),62.8 (t,C-6′),56.7 (q,C-OMe)。以上数据与文献报道相符[7],故鉴定化合物4为7-甲氧基香豆素-6-O-β-D-吡喃葡萄糖苷,首次从铁皮石斛中分离得到。化学结构见图1。
化合物5:白色粉末;C28H38O14,ESI-MS 显示准分子离子峰m/z:621[M+Na]+;1H-NMR(400 MHz,CD3OD)δ:6.79 (2H,s,H-2,6),6.70 (2H,s,H-2′,6′),4.96 (1H,d,J=7.6 Hz,H-7),4.93 (1H,d,J=8.0 Hz,H-7′),4.82 (1H,d,J=7.8 Hz,H-1″),3.83 (6H,s,H-3′,5′-OMe),3.82 (6H,s,H-3,5-OMe),2.24(2H,m,H-8,8′)。以上数据与文献[8]报道相符,故鉴定化合物5为淫羊藿醇A2-4-O-β-D-吡喃葡萄糖苷。化学结构见图1。
化合物6:白色粉末;C17H24O8,ESI-MS显示准分子离子峰m/z:379[M+Na]+;1H-NMR(400 MHz,CD3OD)δ:6.52 (2H,s,H-2,6),5.94 (1H,m,H-8),5.11 (2H,m,H-9),4.81 (1H,d,J=7.6 Hz,H-1′),3.82 (6H,s,H-3,5-OMe),3.48 (2H,d,J=7.5 Hz,H-7);13C-NMR (100 MHz,CD3OD) δ:154.1 (s,C-3,5),138.6 (s,C-1),138.3 (d,C-8),116.0 (t,C-9),107.4 (d,C-2,6),105.5 (s,C-1′),78.2 (d,C-3′),77.8 (d,C-5′),75.7 (d,C-2′),71.3 (d,C-4′),62.8 (t,C-6′),56.9 (q,C-OMe),41.5 (t,C-7)。以上数据与文献报道相符[9],故鉴定化合物6为灯盏花素2。化学结构见图1。
化合物7:白色粉末;C28H36O13,ESI-MS 显示准分子离子峰m/z:603[M+Na]+;1H-NMR (400 MHz,CD3OD)δ:6.67(2H,s,H-2,6),6.61 (2H,s,H-2′,6′),4.84 (1H,d,J=7.8 Hz,H-1″),4.73 (1H,d,J=4.2 Hz,H-7),4.66 (1H,d,J=4.1 Hz,H-7′),4.23 (2H,m,Ha-9,9′),3.87 (2H,m,Hb-9,9′),3.79,3.72 (各6H,s,H-3,3′,5,5′-OMe),3.07 (2H,m,H-8,8′);13C-NMR (100 MHz,CD3OD) δ:154.3 (s,C-3,5),149.3 (s,C-3′,5′),139.6 (s,C-4),136.1 (s,C-4′),132.9 (s,C-1′),104.7 (d,C-2,6),104.5 (d,C-2′,6′),87.5 (d,C-7),87.3 (d,C-7′),105.3 (s,C-1″),78.3 (d,C-3″),77.8 (d,C-5″),75.6 (d,C-2″),71.2 (d,C-4″),62.5 (t,C-6″),56.9,56.7 (q,C-3,3′,5,5′-OMe),55.5,55.4 (d,C-8,8′)。以上数据与文献报道相符[10],故鉴定化合物7为(+)-丁香脂素-O-β-D-吡喃葡萄糖苷。化学结构见图1。
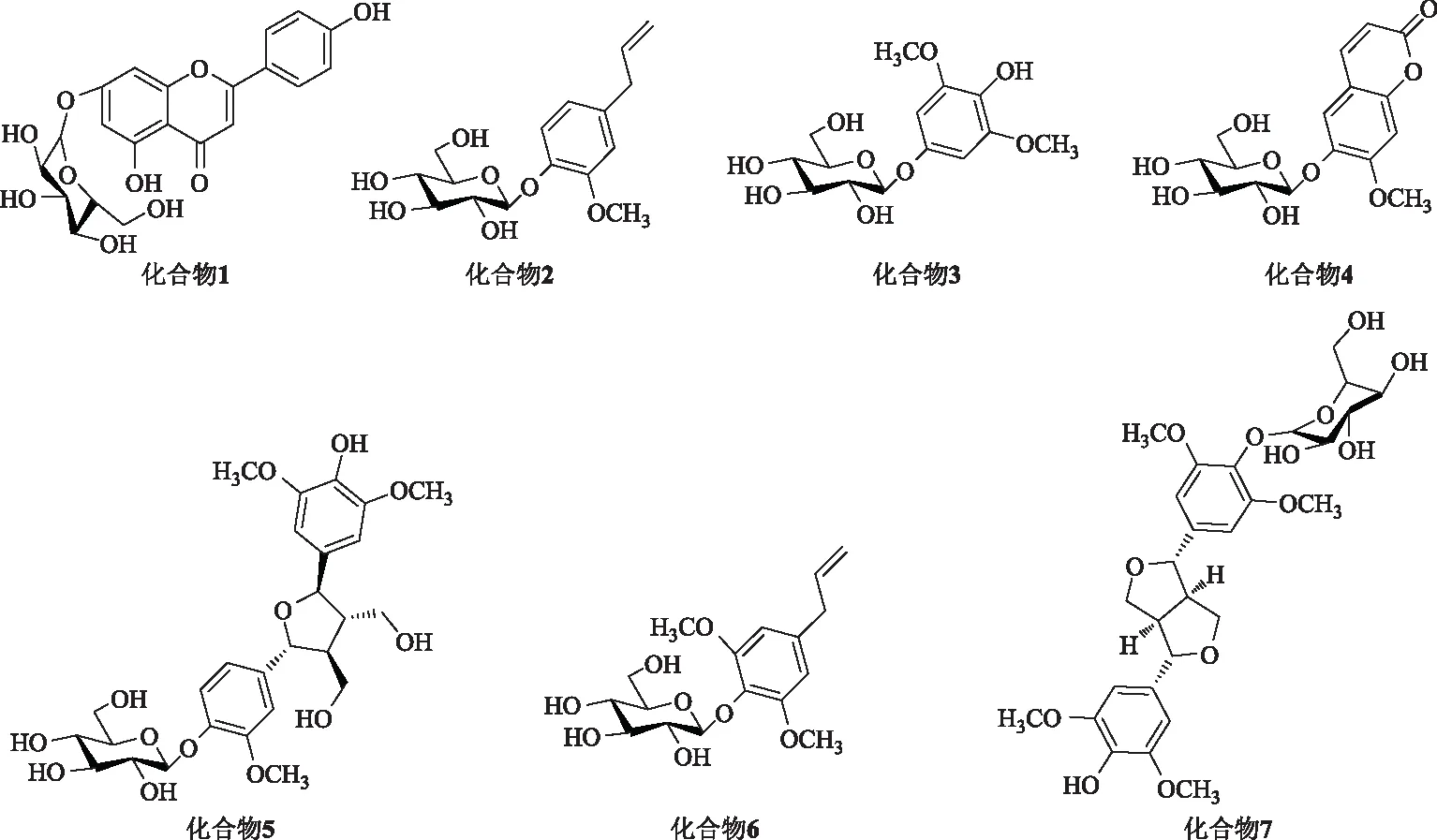
图1 化合物1~7化学结构
[1] 屠国昌.铁皮石斛的化学成分、药理作用和临床应用[J].海峡药学,2010,22 (2):70-71.
[2] 中国科学院中国植物志编辑委员会.中国植物志[M].第19卷.北京:科学出版社,1999:117.
[3] 国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2010:265-266.
[4] 范明松,叶冠,黄成刚.山莴苣化学成分研究[J].中国中药杂志,2004,29(12):1146-1148.
[5] Toshihiro Murata,Toshio Miyase,Fumihiko Yoshizaki.New phenolic compounds fromMeehaniaurticifolia[J].J Nat Med,2011,65:385-390.
[6] 李燕,王春兰,肖培根,等.铁皮石斛中的酚酸类及二氢黄酮类成分[J].中国药学杂志,2010,45(13):975-979.
[7] Xi Feiding,Xu Feng,Yun Fadong,et al.A new angelol-type coumarin glucoside fromAngelicapubescens[J].Chinese Chemical Letters,2008,19:1237-1239.
[8] Gongora Luis,Manez Salavor,Giner Rosa M,et al.Phenolic glycosides fromPhagnalonrupestre[J].Phytochemistry,2002,59(8):857-860.
[9] Chen Bin,Li Bo-Gang,Zhang Guo-Lin.Glycoside from Erigeron brevscapus[J].Acta Botanica Sinica,2002,44(3):344-348.
[10] 王芳菲,李艳,郭顺星,等.铁皮石斛中的一个新化合物[J].中国药学杂志,2010,45(12):898-902.
ChemicalConstituentsfromn-butanolExtractsofDendrobiumofficinale
WEI Ze-yuan1,LU Jing-jin2,JIN Chuanshan2,XIA Hong1*
(AnhuiMedicalUniversityAffiliatedProvincialHospital,Hefei230001,China; 2.AnhuiUniversityofChinesemedicine,Hefei230031,China)
Objective:To study the chemical constituents from n-butanol extracts ofDendrobumofficinale.Methods:A variety of chromatographic methods such as silica gel,Sephadex LH-20 and Pre PC18column were used.Compounds structures were determined by mass spectrometry and nuclear magnetic resonance(NMR)techniques.Results:Seven compounds of glycosides were isolated fromD.officinaleand identified as follows:apigenin-7-O-β-D-glucopyranoside(1),citrusin C(2),3,5-dimethoxy-4-hydroxyphenyl-1-O-β-D-glucopyranoside(3),7- methoxy-coumarin-6-O-β-D-glucopyranoside(4),icariol A2-4-O-β-D-glucopyranoside(5),erigeside 2(6),(+)syringaresinol- 4-O-β-D-monoglucoside(7).Conclusion:Compound1,2and4were isolated fromD.officinalefor the first time.
Dendrobiumofficinale;n-butanol extracts;Chemical constituents;Structural elucidation
2013-07-11)
*
夏宏,副主任药师,研究方向:医院药学;E-mail:bhxhong@sina.com

