绒毛诃子果实多酚类化学成分及抗氧化活性研究△
齐敬浩,文先,陈贵林*,波多野力
(1.内蒙古大学 生命科学学院,内蒙古 呼和浩特 010021; 2.内蒙古自治区中蒙药材规范化生产工程技术研究中心,内蒙古 呼和浩特 010021; 3.冈山大学 药学部,冈山 700-8530)
中药科技
绒毛诃子果实多酚类化学成分及抗氧化活性研究△
齐敬浩1,2,文先1,2,陈贵林1,2*,波多野力3
(1.内蒙古大学 生命科学学院,内蒙古 呼和浩特 010021; 2.内蒙古自治区中蒙药材规范化生产工程技术研究中心,内蒙古 呼和浩特 010021; 3.冈山大学 药学部,冈山 700-8530)
目的:研究绒毛诃子果实中多酚类化学成分及其抗氧化活性。方法:采用Toyopearl HW-40和MCI gel CHP-20P柱分离并结合制备型高效液相色谱,对诃子70%丙酮提取部分进行分离纯化,利用MS、1H-NMR和13C-NMR进行结构鉴定;以紫外分光光度法测定诃子多酚类对DPPH·和ABTS+·的清除率。结果:从诃子果实中分离鉴定了9个化合物,分别鉴定为:诃黎勒酸(1)、诃子酸(2)、1,3,4,6-四-O-没食子酰-β-D-葡萄糖苷(3)、1,3,6-三-O-没食子酰-β-D-葡萄糖苷(4)、没食子酸(5)、诃子素(6)、1,2,3,4,6-五-O-没食子酰-β-D-葡萄糖苷(7)、新诃黎勒鞣花酸甲酯(8)、新诃黎勒鞣花酸酯(9)。其中4、8为首次从诃子中分离得到。抗氧化实验中,化合物4的TEAC值为(3.912±0.21) mmol·g-1,抗氧化活性最强,与其他单体化合物比较,差异具有统计学意义(P<0.01),化合物3、5和6的TEAC值与对照品维生素C接近,有较强的抗氧化活性,与对照组比较差异没有统计学意义,但是与其他化合物比较差异具有统计学意义(P<0.01),化合物8的抗氧化活性最低。
鞣质;NMR;诃子果实;抗氧化
绒毛诃子TerminaliachebulaRetz.var.tomentellaKurt.为使君子科植物,以干燥成熟的果实入药,是重要的藏药和蒙药,多产于我国云南、贵州、广东、广西等地。其味苦、酸、涩,性平,归肺、大肠经,具有涩肠止泻、敛肺止咳、降火利咽的功能[1]。诃子果实含丰富的鞣质类化合物,约占30%~37.36%,且具有很强的抗氧化活性[2],其主要成分为三萜酸类、没食子酰葡萄糖、没食子酰的简单酯类化合物及蒽醌类等物质[3]。魏安池等[4]对多种天然植物进行抗氧化筛选时,发现诃子粉末具有很强的抗氧化活性,且其活性强于合成抗氧化剂BHA,介于BHA与茶多酚之间。
目前研究报道诃子提取物具有良好的抗氧化活性,但仅对粗提物和少数几个化合物的活性进行了研究,如诃子酸、诃黎勒酸等。研究发现,诃子醇提物可控制糖尿病大鼠体内的过氧化氢含量,发挥抗氧化剂的作用[5];而鞣质类诃子酸可保护大鼠肝细胞免受氧化损伤,具有清除自由基的活性[6]。目前国内对诃子的研究主要集中在诃子粗提物、诃子多酚和诃子多糖等药理作用和几个常见单体化合物的药理活性方面,尚未系统开展诃子可水解多酚类化合物提取分离,也未见对起主要抗氧化作用的单体化合物进行鉴定分析。笔者主要采用柱色谱分离并结合制备型高效液相色谱法,对诃子可水解多酚类化合物进行分离纯化,利用MS、1H-NMR和13C-NMR等方法进行单体化合物的结构鉴定;并对分离得到的单体化合物进行抗氧化活性实验,旨在为从诃子中筛选新的天然抗氧化剂提供理论依据。
1 仪器与材料
1.1 仪器
超导核磁共振波谱仪(SC-NMR,美国Varian公司);电喷雾质谱仪(德国Bruker公司);反相HPLC(RP-HPLC)为Shimadzu LC-10A系统,正相HPLC(NP-HPLC)为Shimadzu LC-6A系统。
1.2 材料
绒毛诃子果实于2012年3月购于内蒙古呼和浩特市赛罕区荣新堂药店,产于贵州省,经日本冈山大学药学部波多野力教授鉴定为绒毛诃子TerminaliachebulaRetz.var.tomentellaKurt.。
分析纯乙醇、甲醇、丙酮和质谱级乙腈、甲醇(Sigma-Aldrich公司);色谱纯乙腈和甲醇(Merck公司)。色谱柱填料 MCI-gel CHP-20P(日本三菱化学公司);Toyopearl HW-40 (日本东曹株式会社)。
2 方法
2.1 绒毛诃子果实活性成分的提取与分离
取绒毛诃子粉末685 g,用70%丙酮进行提取分离(每次2 000 mL,共提取3次,每次12 h),合并提取液,浓缩至800 mL,然后依次用乙酸乙酯和正丁醇萃取,得乙酸乙酯萃取部分(153.169 1 g)、正丁醇萃取部分(69.385 6 g)和残留水溶性物质(116.135 8 g)。取乙酸乙酯萃取物上Toyoperal 40-C柱(34 cm×2.2 cm),用70%乙醇水溶液-70%丙酮水溶液洗脱,用顺、反高效液相检测,相似部分合并得到15个部分。第4部分通过MCI-gel CHP-20P柱(30 cm×1.1 cm)进一步纯化,甲醇-甲醇水溶液(0%→10%→20%→30%→40%→50%→100%)梯度洗脱。从甲醇洗脱部分得化合物5(0.397 7 g),从10%甲醇水溶液洗脱部分的第2流分得到化合物4(0.217 7 g),40%甲醇水溶液洗脱部分的第3流分用制备型高效液相[色谱柱J′sphere ODS-H80(250 mm×10 mm,4 μm,80 A)]进一步精制,流动相为水-乙腈-甲酸(19∶80∶1),柱温为40 ℃,流速为2.0 mL·min-1,检测波长均为280 nm,得到化合物1(0.727 4 g)和6(0.063 8 g)。50%甲醇水溶液洗脱,得到6个部分,其中前3部分经制备型高效液相纯化,得化合物2(0.261 2 g),3(0.05 2 g)和7(0.121 0 g)。甲醇洗脱部分再经MCI-gel CHP-20P柱(1.1 mm×30 cm)进一步纯化,得到化合物8(0.007 3 g)和9(0.052 2 g)。共得到9个多酚类单体化合物。
2.2 HPLC检测条件
NP-HPLC采用YMC-PACK SIL A-003色谱柱(150 mm×4.6 mm,5 μm,12 nm),流动相为正己烷-甲醇-四氢呋喃-甲酸(55∶33∶11∶1)和450 mg·L-1的草酸,流速为1.5 mL·min-1,室温下280 nm处检测。
RP-HPLC采用YMC-PACK ODS-A色谱柱(150 mm×4.6 mm,5 μm,12 nm),流动相为水-乙腈-甲酸(89∶10∶1),柱温为40 ℃,流速为1.0 mL·min-1。
半制备HPLC(semipreparative HPLC)色谱柱为J′sphere ODS-H80(250 mm×10 mm,4 μm,80 A),流动相为水-乙腈-甲酸(19∶80∶1),柱温为40 ℃,流速为2.0 mL·min-1,检测波长均为280 nm。
2.3 诃子果实抗氧化活性测定
2.3.1 清除DPPH自由基能力测定[7]配制浓度为1×10-6mol·g-1的DPPH甲醇溶液,取1 mL该溶液与3 mL不同浓度的样品溶液(160,120,80,40,20,0 μg·mL-1)轻轻混匀,室温反应30 min。于515 nm处测定反应物的吸光度,以维生素C为对照。样品清除能力用加样品较空白对照的DPPH吸光度的降低来表示。样品抑制百分率按如下公式计算。
抑制率(%)=(1-AA/AB)×100
式中:AA为加样品后DPPH吸光度,AB为空白对照的吸光度。IC50表示能够清除50%自由基所需的样品浓度,IC50从样品清除率的线性曲线计算可得。
2.3.2 清除ABTS自由基能力测定 参考Re等[8]的方法测定清除ABTS自由基能力。测定Trolox标准曲线方程为Y=0.468X+2.659(r=0.994),Y为消除率,X为浓度。
3 结果与分析
3.1 诃子果实活性成分结构鉴定
化合物1:白色无定形粉末,ESI-MS m/z:953[M-H]-,分子量为954。1H-NMR 400 MHz,acetone-d6+D2O):7.03,7.15,7.23(each 2H,s,Galloyl),4.87(1H,d,J=7.2 Hz,Chebubyl-2′),5.07(1H,dd,J=7.2,1.2 Hz,Chebubyl-3′),3.81(1H,m,Chebubyl-4′),2.13(2H,t,J=3.2 Hz,Chebubyl-5′),7.48(1H,s,Chebubyl-3″),6.48(1H,s,Glu-H-1),5.47(br,s,Glu-H-2),5.88(m,Glu-H-3),5.20(d,J=3.6 Hz,Glu-H-4),4.71(t,J=10.8 Hz,Glu-H-5),4.42(dd,J=10.8,8.0 Hz,Glu-Ha-6),4.81(t,J=8.0 Hz,Glu-Hb-6),7.01,6.63(each 1H,s,HHDP);13C-NMR(151 MHz,acetone-d6+D2O):119.8(Galloy-C-1),110.4(Galloy-C-2,6),145.9(Galloy-C-3,5),139.9(Galloy-C-4),165.6(-COO-),169.7(Chebubyl-C-1′),66.2(Chebubyl-C-2′),41.0(Chebubyl-C-3′),39.3(Chebubyl-C-4′),172.9(Chebubyl-C-6′),173.6(Chebubyl-C-7′),165.6(Chebubyl-C-8′),115.7(Chebubyl-C-1″),118.5(Chebubyl-C-2″),117.1(Chebubyl-C-3″),146.5(Chebubyl-C-4″),136.6(Chebubyl-C-5″),140.8(Chebubyl-C-6″),91.6(Glu-C-1),70.7(Glu-C-2),61.8(Glu-C-3),66.2(Glu-C-4),73.7(Glu-C-5),63.9(Glu-C-6),115.2,117.1(HHDP-1″″),124.3,125.3(HHDP-2″″),107.5,110.1(HHDP-3″″),144.5,145.2(HHDP-4″″),136.6,137.6(HHDP-5″″),145.1,145.3(HHDP-6″″),166.3,168.0(-COO-)。从1H-NMR与13C-NMR图谱可看出该化合物是1个HHDP、1个chebubyl和没食子酸连接在1个六碳糖上。依据糖的碳化学位移值判断该糖为葡萄糖,参照文献[9]鉴定该化合物为诃黎勒酸。化学结构见图1。
化合物2:白色针晶,ESI-MS m/z:955[M-H]-,分子量为955。1H-NMR (400 MHz,acetone-d6+D2O):7.13(2H,s,Galloyl-3,5),5.08(1H,d,J=3.6 Hz,Chebubyl-2′),5.13(1H,dd,J=7.2,1.6Hz,Chebubyl-3′),3.92(1H,t,J=7.2 Hz,Chebubyl-4′),7.52(1H,s,Chebubyl-3″),6.51(1H,d,J=2.0 Hz,Glu-H-1),5.46(1H,m,Glu-H-2),6.28(1H,d,J=2.0 Hz,Glu-H-3),5.07(1H,d,J=3.65 Hz,Glu-H-4),4.72(m,Glu-H-5),4.72(m,Glu-Ha-6),4.85(m,Glu-Hb-6);13C-NMR(151 MHz,acetone-d6+D2O):119.5,119.6,120.4(3C,Galloy-C-1),109.8,110.2(6C,Galloy-C-2,6),145.8,145.9,146.1(6C,Galloy-C-3,5),139.2,139.8,139.9(3C,Galloy-C-4),165.1,165.2,165.3(3C,-COO-),169.7(Chebubyl-C-1′),39.3(Chebubyl-C-3′),173.3(Chebubyl-C-4′),173.8(Chebubyl-C-5′),165.3(Chebubyl-C-6′),115.9(Chebubyl-C-8′),118.5(Chebubyl-C-1″),146.6(Chebubyl-C-3″),140.9(Chebubyl-C-5″),156.3(Chebubyl-C-6″),92.2(Glu-H-1),70.9(Glu-H-2),62.1(Glu-H-3),68.9(Glu-H-4)。从1H-NMR 与13C-NMR图谱可看出该化合物是3个没食子酸和1个chebubyl连接在1个六碳糖上。依据糖的碳化学位移值判断该糖为葡萄糖,参照文献鉴定该化合物为诃子酸[10]。化学结构见图1。
化合物3:ESI-MS m/z:788.11[M-H]-,分子量为788。1H-NMR (CD3OD):7.01(s,2H),7.05(s,2H),7.09(s,2H),7.15(s,2H),5.94(d,J=8.0 Hz),4.00(m),5.61(t,J=9.6 Hz),5.42(t,J=10.2 Hz),4.33(m),4.49(dd,J=2.0,10.4Hz),4.18 (dd,J=4.8,7.2 Hz)。从1H-NMR与gCOSY图谱可看出该化合物是4个没食子酸连接在1个六碳糖的1,3,4,6位上。依据糖的碳化学位移值判断该糖为葡萄糖,参照文献鉴定该化合物为1,3,4,6-四-O-没食子酰-β-D-葡萄糖苷(1,3,4,6-tetra-O-galloyl-β-D-glucose)[11]。化学结构见图1。
化合物4:ESI-MS m/z:637.10[M-H]-,分子量为638。1H-NMR (CD3OD):7.09(s,2H),7.13(s,2H),7.14(s,2H),5.83(d,J=8.0 Hz),3.85(m),5.28(t,J=9.2,9.6 Hz),3.95(m),4.35(dd,J=5.2,5.6 Hz),4.55(dd,J=1.6,10.4 Hz)。从1H-NMR与gCOSY图谱可看出该化合物是3个没食子酸连接在1个六碳糖的1,3,6位上。依据糖的碳化学位移值判断该糖为葡萄糖,参照文献鉴定该化合物为1,3,6-三-O-没食子酰-β-D-葡萄糖苷(1,3,6-tri-O-galloyl-β-D-glucose)[12]。化学结构见图1。
化合物5:无色结晶,ESI-MS m/z:170.02[M-H]-,分子量为170。1H-NMR(CD3OD):7.07(2H,s,gal-2,5)。该化合物结构比较简单,液相图谱中正反相出峰时间最早,且通过与对照品对比、文献对照[13]、1H-NMR与gCOSY图谱,可看出该化合物是没食子酸。
化合物6:淡黄色结晶粉末。1H-NMR (400 MHz,acetone-d6+D2O):6.52(1H,s,Glu-H-1),5.47(1H,d,J=10.8 Hz,Glu-H-2),5.70(1H,s,Glu-H-3),5.35(brd,J=3.6 Hz,Glu-H-4),4.66(1H,m,Glu-H-5),4.71,4.80(m,Glu-H-6),6.98(2H,1-O-galloyl-2,6),7.07(2H,3-O-galloyl-2,6),7.22(2H,6-O-galloyl-2,6),4.90(1H,t,J=9.6 Hz,AHHDP-1),6.22 (1H,d,J=1.2 Hz,AHHDP-3),7.14(1H,s,AHHDP-3′)。从1H-NMR与gCOSY图谱可看出该化合物是3个没食子酸分别连接在1个六碳糖的1,3,6位上,1个AHHDP连接在2,4位点上。依据糖的碳化学位移值判断该糖为葡萄糖,参照文献鉴定该化合物为诃子素(Terchebin)[14]。化学结构见图1。
化合物7:淡黄色晶体,UV最大吸收217,278 nm。ESI-MS m/z:939.1[M-H]-,分子量为940。1H-NMR(400 MHz,acetone-d6+D2O):6.95(s,2H),6.98(s,2H),7.02(s,2H),7.08(s,2H),7.11(s,2H),6.25(d,J=6.4 Hz,Glu-H-1),5.61(m,Glu-H-2),4.53(t,Glu-H-3),4.26(d,Glu-H-4),5.97(t,Glu-H-5)。从1H-NMR与gCOSY图谱可看出该化合物是5个没食子酸分别连接在1个六碳糖的1,2,3,4,6位上。依据糖的碳化学位移值判断该糖为葡萄糖,参照文献鉴定该化合物为1,2,3,4,6-五-O-没食子酰-β-D-葡萄糖苷(1,2,3,4,6-penta-O-galloyl-β-D-glucose)[15]。化学结构见图1。
化合物8:淡紫色晶体,ESI-MS m/z:988.139[M-H]-,分子量为988。1H-NMR (400 MHz,acetone-d6+D2O):4.61(1H,s,Chebubyl-C-2′),3.64(1H,d,J=11.2 Hz,Chebubyl-C-3′),2.96(m,Chebubyl-C-4′),2.30(1H,d,J=4.4 Hz,Chebubyl-C-5′),2.62(1H,m,Chebubyl-C-5′)6.97(s,Chebubyl-C-2″),5.89(1H,d,J=8.4 Hz,Glu-H-1),3.93(1H,t,J=8.8 Hz,Glu-H-2),5.53(1H,t,J=9.2 Hz,Glu-H-3),5.44(1H,t,J=9.6 Hz,Glu-H-4),4.20(m,Glu-H-5),4.30(1H,t,J=4.4 Hz,Glu-Ha-6)。从1H-NMR 与gCOSY图谱可看出该化合物是3个没食子酸分别连接在1个六碳糖的1,3,6位上,在高能场区有3个明显的Chebubyl H信号。依据糖的碳化学位移值判断该糖为葡萄糖,参照文献鉴定该化合物为新诃黎勒鞣花酸甲酯(Methyl neochebulinate)[16]。化学结构见图1。
化合物9:淡黄色晶体,1H-NMR (400 MHz,acetone-d6+D2O):4.79(1H,s,Chebubyl-C-2′),3.22(1H,d,J=10.4 Hz,Chebubyl-C-3′),2.94(m,Chebubyl-C-4′),2.43(1H,d,J=4.8 Hz,Chebubyl-C-5′),2.44(1H,m,Chebubyl-C-5′),7.06(s,Chebubyl-C-2″),5.88(1H,d,J=8.4 Hz,Glu-H-1),4.02(1H,t,J=8.4 Hz,Glu-H-2),5.43(1H,d,J=10.8 Hz,Glu-H-3),4.19(m,Glu-H-5),4.25(1H,t,J=4.4 Hz,Glu-H-6)。从1H-NMR与gCOSY图谱可看出该化合物是3个没食子酸分别连接在1个六碳糖的1,3,6位上,在高能场区有3个明显的Chebubyl H信号。且化合物9的1H-NMR与gCOSY图谱和化合物8的图谱基本相似,但在高能场附近有几个H信号,最后和文献[17]对比判断少连1个甲基,鉴定该化合物为新诃黎勒鞣花酸酯(neochebulinate)。化学结构见图1。
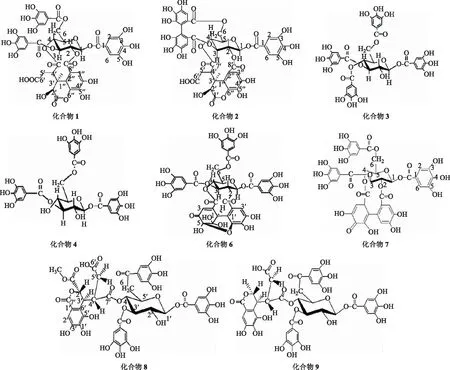
图1 化合物1~4、6~9化学结构
3.2 诃子果实抗氧化能力测定
3.2.1 DPPH自由基法抗氧化活性测定 DPPH自由基法测定抗氧化活性是通过DPPH自由基的半数清除率(IC50)来表示,IC50值越小,其抗氧化活性越高。诃子果实不同提取物和单体化合物的抗氧化活性见图2。几个粗提物的IC50值很高,抗氧化活性明显较低,其中70%丙酮提取物的IC50值(35.3±2.4)较低,说明其抗氧化活性要比其他几个粗提物的抗氧化活性高,且差异具有统计学意义。其他粗提物IC50值都较大,抗氧化活性较低,差异不具有统计学意义。乙酸乙酯萃取物的第4部分经Toyoperal 40-C柱分离得单体化合物,化合物4的抗氧化活性最强,且比对照品维生素C效果还好,化合物3和5抗氧化活性也很高,但与对照品比较差异无统计学意义。其他几个单体化合物的抗氧化活性较几个粗提物要高,与对照品维生素C相比活性要低,但差异无统计学意义。结果表明化合物3、4和5具有较高的抗氧化活性,具有开发新型天然抗氧化剂的潜能。

注:不同小写字母表示差异有统计学意义(P<0.05),下同图2 诃子果实不同提取物和单体化合物的 抗氧化活性比较(DPPH自由基法)
3.2.2 ABTS自由基法抗氧化活性测定 ABTS法考察结果与DPPH法类似,结果见图3。粗提物中70%丙酮提取物的TEAC值最大,与其他几个粗提物相比差异具有统计学意义,但与对照品维生素C相比,抗氧化活性要低。化合物4的TEAC值(3.912±0.21) mmol·g-1抗氧化活性最强,与其他单体化合物比较差异具有统计学意义(P<0.01),化合物3、5和6的TEAC值与对照品维生素C接近,有较强的抗氧化活性,与对照组比较差异无统计学意义,但与其他化合物比较差异具有统计学意义,化合物8的抗氧化活性最低。结果与DPPH法一致,化合物3、4和5具有较高的抗氧化活性,具有开发新型天然抗氧化剂的潜能。
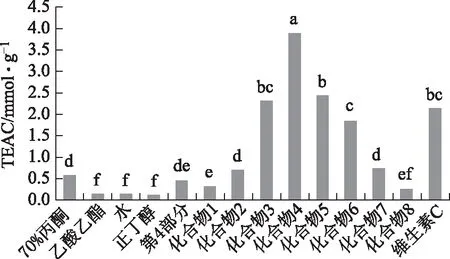
图3 诃子果实不同提取物和单体化合物的 抗氧化活性比较(ABTS自由基法)
4 讨论
许多研究表明,诃子中含有大量的酚类和黄酮类物质,且酚类物质在抗氧化活性中起重要作用。因此,本研究中首先采用柱分离(Toyopearl HW-40和MCI-gel CHP-20P)结合制备型高效液相色谱对诃子70%丙酮提取部分进行分离,得到9种鞣质类化合物,然后利用ABTS和DPPH方法对诃子果实各萃取部分及单体化合物的抗氧化能力进行测定。以往多利用DPPH法、TBA法及碘量法对不同溶剂的诃子提取物的抗氧化活性进行评价,发现不同溶剂的提取物相同浓度下清除DPPH自由基的能力依次为:95%乙醇>乙酸乙酯>正己烷。其中诃子95%乙醇提取物对亚油酸的抗氧化能力甚至强于同等浓度的茶多酚[19];乙酸乙酯提取物对食用油的抗氧化能力强于同浓度的茶多酚,甚至可与合成的抗氧化剂TBHQ相当[19]。
目前诃子的研究主要集中在药理方面,且活性研究只是做到粗提物水平,并未对活性强的部位继续分离。本研究中经过进一步分离精制,发现诃子中的几个化合物具有明显的抗氧化活性,且活性较对照品维生素C强,为诃子提取物研发成一种用于油脂和含油食品的天然抗氧化剂提供了理论依据。
[1] 国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2010:173.
[2] 张杰.鞣质的药理作用(Ⅲ)——抗氧化、降脂、降压等多种作用[J].国外医药·植物药分册,1995,10(3):99-103.
[3] 江苏新医学院.中药大辞典[M].上海:上海科学技术出版社,2001:1174-1177.
[4] 魏安池,周瑞宝,瞿水忠.诃子抗氧化性能的研究[J].郑州粮食学院学报,1998,19(1):8-12.
[5] Senthilkumar G P,Subram anian S.Evaluation of antioxidant potential ofTerminaliachebulafruits studied in streptozotocin-induced diabeticrats[J].Pharm Biol,2007,45(6):511-518.
[6] Lee H S,Jung S H,Yun B S,et al.Isolation of chebulic acid fromTerminaliachebulaRetz.and its antioxidant effect in isolated rat hepatocytes[J].Arch Toxicol,2007,81(3):211-218.
[7] 段园园,马耀,陈贵林.锁阳中粗多酚和粗多糖抗氧化活性的比较[J].中国现代中药,2012,14(1):43-46.
[8] Re R,Pellegrini N,Proteggente A,et al.Antioxidant activity applying an improved ABTS+radical cation decolorization assay[J].Free Rad Biol Med,1999,26(9):1231-1237.
[9] 丁岗,刘延泽,王莉,等.诃子中主要可水解丹宁的结构鉴定[J].中国药科大学学报,2001,32(2):91-93.
[10] Owen R W,Haubner R,Hull W E,et al.Isolation and structure elucidation of the major individual polyphenols in carobfibre[J].Food Chem,2003,41:1727-1738.
[11] Barreto J C,Trevisan M T,Hull W E,et al.Characterization and quantitation of polyphenolic compounds in bark,kernel,leaves,and peel of mango (MangiferaindicaL.)[J].J Agric Food Chem,2008,56:5599-5610.
[12] Hatano T,Yasuhara T,Yoshihara R,et al.Effects of interaction of tannins with co-existing substances VII.Inhibitory effects of tannins and related polyphenols on xanthine oxidase[J].Chem Pharm Bull,1990,38:1224-1229.
[13] 张超,方岩雄.中药地菍的化学成分研究[J].中国中药杂志,2003,28(5):429-431.
[14] Lin TC,Nonaka G,Nishioka I,et al.Tannins and Related Compounds.CⅡ.Structures of terchebulin,an ellagitannin having a novel tetraphenylcarboxylic acid (terchebulic acid) moiety,and biogenetically related tannins fromTerminaliachebulaRetz.[J].Chem Pharm Bull,1990,38(11):3004-3008.
[15] Hatano T,Yoshida T,Shingu T,et al.13C Nuclear magnetic resonance spectra of hydrolyzable tannins.III.Tannins having IC4glucose and C-glucosidic linkage[J].Chem Pharm Bull,1988,36:3849-3856.
[16] Juang L J,Sheu S J,Lin T C.Determination of hydrolyzable tannins in the fruit ofTerminaliachebulaRetz.by high-performance liquid chromatography and capillary electrophoresis[J].J Sep Sci,2004,27:718-724.
[17] Juang L J,Sheu S J,Lin T C.Determination of hydrolyzable tannins in the fruit ofTerminaliachebulaRetz.by high-performance liquid chromatography and capillary electrophoresis[J].J Sep Sci,2004,27:718-724.
[18] 孟洁,杭瑚.诃子抗氧化作用的研究[J].食品科学,2000,21(2):9-12.
[19] 金裕范,高雪岩,王文全,等.云南普洱茶抗氧化活性的比较研究[J].中国现代中药,2011,13,(8):17-19.
PolyphenolicCompoundsandAntioxidantActivityofTerminaliachebulaRetz.var.tomentellaKurt.
QI Jing-hao1,2,WEN Xian1,2,CHEN Gui-lin1,2*,HATANO Tsutomu3
(1.CollegeofLifeScience,InnerMongoliaUniversity,Hohhot010021,China;2.TheGoodAgriculturePracticeEngineeringTechnologyResearchCenterofChineseandMongolianMedicineinInnerMongolia,Hohhot010021,China;3.FacultyofPharmaceuticalSciences,OkayamaUniversity,Okayama700-8530,Japan)
Objective:To study polyphenolic compounds from fruits ofTerminaliachebulaRetz.var.tomentellaKurt.and their antioxidant activity.Methods:Macroporous resin(Toyopearl HW-40 and MCI gel CHP-20P)columns and preparative HPLC were used,compound structures were determined by MS,NMR,COSY and HMBC techniques.The antioxidant activities of the polyphenolic compounds were assayed based on the method of DPPH and ABTS,which can evaluate the antioxidant abilityinvitro.Results:Nine compounds were isolated and identified as chebulinic acid(1),chebulagic acid(2),1,3,4,6-tetra-O-galloyl-β-D-glucose(3),1,3,6-tri-O-galloyl-β-D-glucose(4),gallic acid(5),terchebin(6),1,2,3,4,6-penta-O-galloyl-β-D-glucose(7),methyl neochebulinate(8),neochebulinate(9).Conclusion:Compounds4and8were isolated for the frist time from the fruits ofT.chebula.Compounds3,4and5have obvious antioxidant activity compared with control group.The antioxidant activity of crude extract was lower than single compounds.
Hydrolyzable tannins;NMR;TerminaliachebulaRetz.var.tomentellaKurt.;Antioxidant activity
2013-04-26)
国家科技支撑计划(2011BAI07B07)
*
陈贵林,教授,博士生导师,研究方向:药用植物化学;E-mail:guilinchen61@163.com

