腹腔镜与开腹手术治疗直肠癌的临床对照研究
熊少伟 刘 铮 雷云鹏 李灼非 邓兴明
北京大学深圳医院胃肠外科,广东深圳 518036
直肠癌是发生于消化系统常见的恶性肿瘤,发病率高,治疗直肠癌主要的手段仍是手术治疗。随着医学发展,腹腔镜直肠癌根治术已经在全国许多医院开展,该术式能弥补传统开腹手术的不足,取得了较好的效果。但是,在该术式开展的早期,有部分学者对手术的疗效提出质疑,随着腹腔镜微创技术的不断进步,近几年才逐渐被广大外科医生所接受。本文通过对2003年1月—2012年12月在该院完成的100例腹腔镜下直肠癌根治手术与同期95例开腹直肠癌根治手术病例的资料进行分析,比较两组手术的疗效及安全性。
1 资料与方法
1.1 一般资料
回顾性分析该院100例腹腔镜手术的直肠癌患者和同期95例传统开腹手术的直肠癌患者临床资料,见表1和表2。腹腔镜组男性52例,女性48例,平均年龄(53±5.0)岁,开腹组男性49例,女性46例,平均年龄(51±4.5)岁,在年龄、性别等方面比较两组患者差异无统计学意义(P > 0.05)。同时,手术方式、肿瘤位置、Dukes分期以及病理分型等方面比较两组患者差异无统计学意义(P > 0.05)。所以两组患者具有可比性。
1.2 手术方法
①开腹组:治疗方法是常规开腹直肠癌根治术。②腹腔镜组:治疗方法是腹腔镜辅助直肠癌根治术。具体方法:手术准备和麻醉与常规开腹手术相同,患者取截石位,头低足高、右侧倾斜各30°,并常规消毒铺无菌手术巾,于脐下缘切口10 mm做为观察孔,建立并维持气腹,压力约为12 mmHg,从观察孔插入腹腔镜先行常规检查,仔细观察腹腔脏器和大网膜,了解是否有转移,确认直肠肿瘤具体位置,观察是否突破浆膜。在腹腔镜监视下,分别于右下腹、右中腹和左下腹进行戳孔,大小分别为10 mm、5 mm、5 mm,右下腹10 mm戳孔为主操作孔。在腹腔镜的辅助下进行手术操作,在乙状结肠系膜根部打开后腹膜,游离肠系膜下动脉及其伴行静脉,根部予血管夹夹闭并切断血管。由内侧向外侧分离乙状结肠系膜,完整游离乙状结肠及系膜。沿着直肠固有筋膜与盆壁筋膜的间隙行锐性分离,切开直肠前腹膜返折,游离直肠前壁,最后将直肠游离至肿瘤下方。如行Dixon术式,则在肿瘤下方至少2 cm 处用腹腔镜切割闭合器切断直肠,在脐孔或左下腹处作相应大小的小切口,用开创器保护好切口,将近端乙状结肠拉出腹腔外,在降结肠下段切除肠段及直肠肿物。将管形吻合器的抵钉座放入近端结肠,重新建立气腹,使用吻合器在腹腔镜直视下作结肠、直肠端端吻合。如行Miles术式,则在降结肠下段切断肠管,会阴部梭形切口,切除肛门和直肠及肿物,从会阴部取出标本,左下腹行永久性结肠造瘘,冲洗盆腔,放置引流管,缝合伤口。

表1 两组的临床资料比较
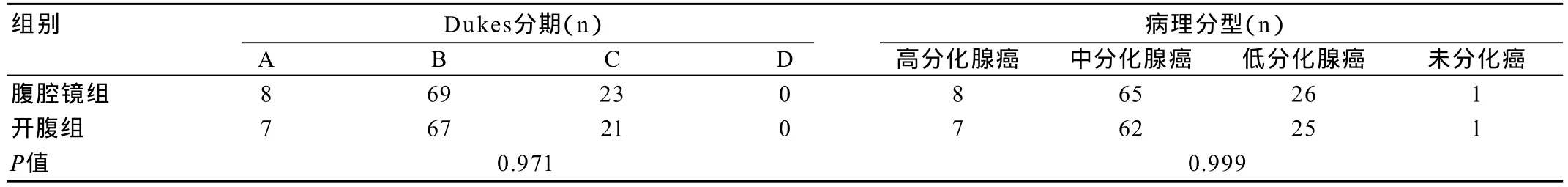
表2 两组的病理资料比较
1.3 统计学方法
采用SPSS 13.0统计软件进行统计学分析,正态分布计量资料以均数±标准差表示并且采用t检验,采用χ2检验计数资料,以P < 0.05为差异有统计学意义。
2 结果
两组术中情况比较见表3,术后情况比较见表4。腹腔镜组前50例手术时间与开腹组相比,差异无统计学意义(P > 0.05),但是,后50例腹腔镜组手术时间与开腹组相比,手术时间少,差异有统计学意义(P < 0.05)。术中出血量腹腔镜组明显少于开腹组,差异有极显著意义(P < 0.01)。术中清除淋巴结数目两组差异无统计学意义(P > 0.05)。术后恢复时间:术后肛门排气时间、留置尿管时间、住院时间腹腔镜组明显少于开腹组,差异有极显著意义(P < 0.01)。腹腔镜组无切口感染发生,开腹组发生5例切口感染,差异有显著意义(P < 0.05),两组术后吻合口瘘、腹腔脓肿、肺部感染等并发症的发生,差异无显著意义(P > 0.05)。
3 讨论
直肠癌是一种常见的严重威胁人类健康的消化系统恶性肿瘤,手术切除仍是治疗直肠癌的主要手段[1]。1982年Heald等提出全直肠系膜切除术治疗直肠癌的概念,因其术后复发率低,逐渐成为手术治疗 中下段直肠癌的金标准。1991年Jacobs等[2]首次尝试将腹腔镜技术用于治疗直肠癌,至今已逐渐被临床医生认识、接受,目前在国内许多医院已经广泛应用于临床。尤其随着医学技术的发展,超声刀、电凝系统、结扎束血管闭合系统(LigaSure)、高清腹腔镜系统的问世,使得腹腔镜手术治疗消化系统肿瘤的安全性得到了较大的提高。尽管如此,仍有部分学者对腹腔镜手术应用于消化道恶性肿瘤的治疗心存疑虑,主要分歧是在手术的可行性、肿瘤的根治性等方面。人们担忧微创外科虽然创伤小,是外科的发展趋势,但如应用不当可能会影响胃肠肿瘤的生存率。

表3 两组术中情况比较

表4 两组术后情况比较
本研究回顾性地比较腹腔镜直肠癌根治术与传统开腹手术,我们发现腹腔镜组前50例的手术时间比传统开腹手术的时间略长,但差异无统计学意义,然而,随着手术例数的增加,手术时间逐渐缩短,腹腔镜组后50例的手术时间比传统开腹手术的时间要少,差异具有统计学意义,这是由于腹腔镜手术存在技术层面上的掌握和熟练过程,存在一个渐进的学习曲线过程,同时需要手术团队的密切合作[3],随着技术经验的积累,手术人员配合逐渐熟练,腹腔镜的手术时间逐步缩短。我们还发现,腹腔镜组术中出血量明显少于开腹组,从而反映出腹腔镜技术操作的精细性和微创性。直肠癌手术根治彻底性的主要因素[4]是病灶的切除范围与淋巴结清扫。我们就比较了淋巴结的清扫数目,两组之间差异无统计学意义,表明腹腔镜手术的根治效果同开腹手术一样,因此此手术是安全可行的。从术后两组患者恢复时间方面比较,在术后胃肠道功能恢复时间,留置尿管时间以及术后住院时间等,腹腔镜组均少于开腹组,差异有统计学意义,表明腹腔镜组患者术后恢复快,住院时间短。两组在术后吻合口瘘、腹腔脓肿以及肺部感染等并发症方面不存在统计学差异,但是,腹腔镜组无一例发生切口感染,而开腹组有5例出现切口感染,存在明显统计学差异,说明腹腔镜小切口存在着明显的优势。
综上所述,腹腔镜直肠癌根治术能取得传统开腹手术的根治效果。而且,该术式还存在以下几方面的优点[5-7]:①痛苦小;②恢复快;③出血少;④住院时间短;⑤手术根治效果好;⑥对患者自身免疫功能的影响较小[8]。因此,腹腔镜直肠癌根治术正在成为直肠癌根治性手术的“金标准”。
[1] 张 锦辉.腹腔镜与开腹直肠癌根治术对老年患者机体炎症影响的比较[J].中国医药导报,2010,7(14):33-34.
[2] Pugliese R,Di Lernia S,Sansonna F.Outcomes of laparoscopic Miles operation in very low rectal Adenocarcinoma.Analysis of 32 cases[J].Eur J Surg Oncol,2007,33(1):49-54.
[3] 刘利华,许秋萍.28例腹腔镜下结肠直肠癌根治术的手术配合[J].中国现代药物应用,2009,3(3):37-38.
[4] 郑民华.腹腔镜结直肠癌手术的现状与展望[J].中国实用外科杂志,2011,31(9):841-843.
[5] 江志伟,黎介寿.结直肠癌手术腹腔镜或开腹术式选择的争论[J].中国实用外科杂志,2008,28(6):453-455.
[6] Veldkamp R,Gholghesaei M,Bonjer HJ.Laparoscopic resection of colo cancer[J].Surg Endosc,2004,18(8):1163-1185.
[7] The Clinical Outcomes of Surgical Therapy Study Group.A comparison of laparoscopically assisted and open co]ectomy for colon cancer[J].N Engl J Med,2004,350(20):2050-2059.
[8] 曹 其彬,胡三元.腹腔镜与开腹结直肠癌手术对机体免疫功能的比较[J].中国普通外科杂志,2010,15(8):615-618.

