外周血淋巴细胞培养及染色体高分辨标本制备方法
刘爱生,朱春燕
(甘肃省平凉医学高等专科学校,平凉 744000)
人类染色体G显带高分辨核型分析,是临床检测诊断染色体畸变常用方法,国内公认常规制作方法因步骤繁杂,实验周期长,收获到的中期染色体局限了基因定位和G显带分析疾病的诊断。核型分析时,在短时间内能检诊到大量的分散均匀的早中期及中期染色体,是临床工作者所渴求的。我们在实验教学中主要改变了细胞培养的方法;最低浓度的秋水仙素处理和最短阻断培养时间,最小锥度的10 ml尖底细长离心管收集细胞和斜滴片法,取得了良好的收效,现报告如下。
1 实验方法
收集每次实验课后成败相关数据,分析总结标准方法[1]的经验,制作方法宜改进如下:
1.1 接种培养 需在无菌环境条件下进行,无菌室内正常消毒,工作前半小时超净工作台紫外线照射30 min。取出冰冻保存5 ml/每瓶1640混合培养液先室温融化,再置入37℃水浴箱内预温止37℃,操做者双手40℃水预温继续无菌操作,用3 ml肝素真空抗凝管,瓶盖、皮肤常规消毒,取肘部静脉血3 ml轻轻转动摇匀抗凝管,起到充分的抗凝作用,用1 ml灭菌注射器吸取0.5 ml抗凝血(37℃),迅速接种于提前室温融化后再经37℃水浴箱预温的5 ml的1640混合培养液内,消毒封盖立即放入37℃电子调控隔水式恒温箱内培养51 h[2]。培养过程每隔8 h轻轻摇晃培养物一次。
1.2 最低浓度秋水仙素处理和最短阻断培养时间经37℃恒温培养的细胞,培养至50 h25 min时用微量移液器加40 μg/L的秋水仙素55 μl,继续阻断培养51 h终止培养,收集染色体。培养至50 h 45 min时用微量移液器加 40 μg/L 秋水仙素 60 μl,继续阻断培养51 h终止培养,收集染色体。终止前1 min将培养物摇匀倾斜移入最小锥度的10 ml锥型离心管内,取1 ml生理盐水清洗全部血细胞移入此离心管内,并对称放入电脑调控的离心机内,以2 000 rpm离心10 min,终止细胞培养。或者用同等低渗法阻断收集[3];细胞培养止51 h时将培养物摇匀倾斜移入最小锥度的10 ml锥型离心管内,取1 ml生理盐水清洗全部血细胞移入此离心管内,以2 000 rpm离心10 min,弃取上清液,保留底物1 ml加入预温37℃,0.075 mol/L 的 KCl 4 ml,用微量移液器随即加 40 μg/L 秋水仙素 57.5 μl,迅速吹打均匀,置于37℃水浴箱内低渗24 min,加3∶1固定液0.6 ml打匀预固定1 min,以2 000 rpm离心10 min(注意:吸取培养液的量与所加低渗液的量必须相等,以免影响秋水仙素的浓度)。
1.3 选取最小锥度10 ml尖底细长洁净的离心管收集细胞,每管培养物制0.4 ml的细胞悬液吹打均匀,改斜滴片法,滴片时玻片与水平位呈45°夹角以20cm的高度2滴滴于热玻片或者冰冻玻片中央。待室温干燥后,浸入30%过氧化氢处理10 min[4],自来水彻底冲洗,用EDTA胰酶法或PBS胰酶缓冲法作显带处理。Giemsa(1 Giemsa∶9自来水)染色10~15 min,细流水冲洗。晾干,显微镜40×10倍视野观察玻片标本制作良好,用中性树胶加二甲苯调试成线状,取2滴滴于细胞面中央,盖玻片呈30°角铺于玻片上封片,即可在高倍镜下鉴定,铺平室温放置3 d树胶干燥制作成永久性保存标本片,供长期使用保存。
2 结果
改进制作方法简单,制作总程由72 h缩短至54 h既可做为临床标本诊断,如表1所示[5-7]。一张玻片10×10倍视野下可记32个分裂量(图1),即可见早中期,部分中期兼有早期分裂相,加之斜滴片法和30%过氧化氢处理,染色体分散均匀,带纹显示更加精细、清楚;尤其是获得的大量早中期,中期分裂相(图2),符合统计学分析细胞数的要求。实验共61个班级,每班分8个小组进行,分裂指数数据分析如表2所示。
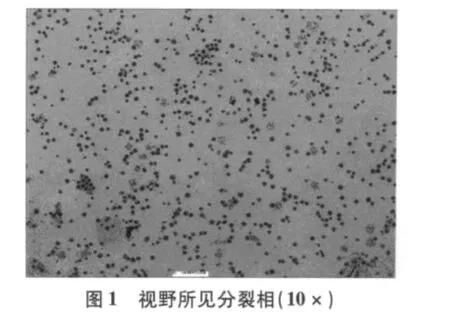
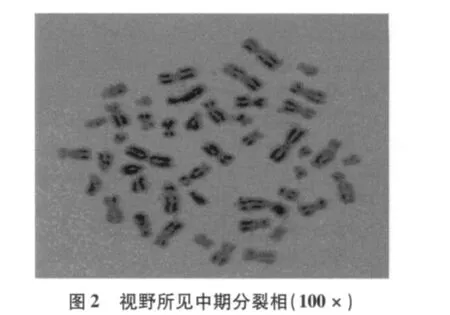
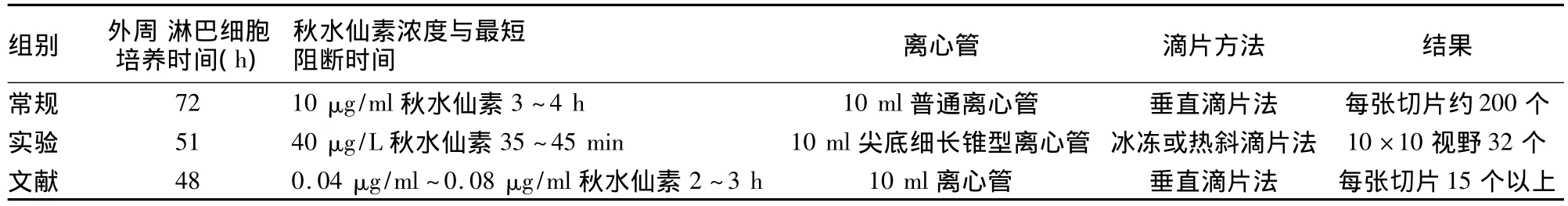
表1 常规、文献与实验结果比较
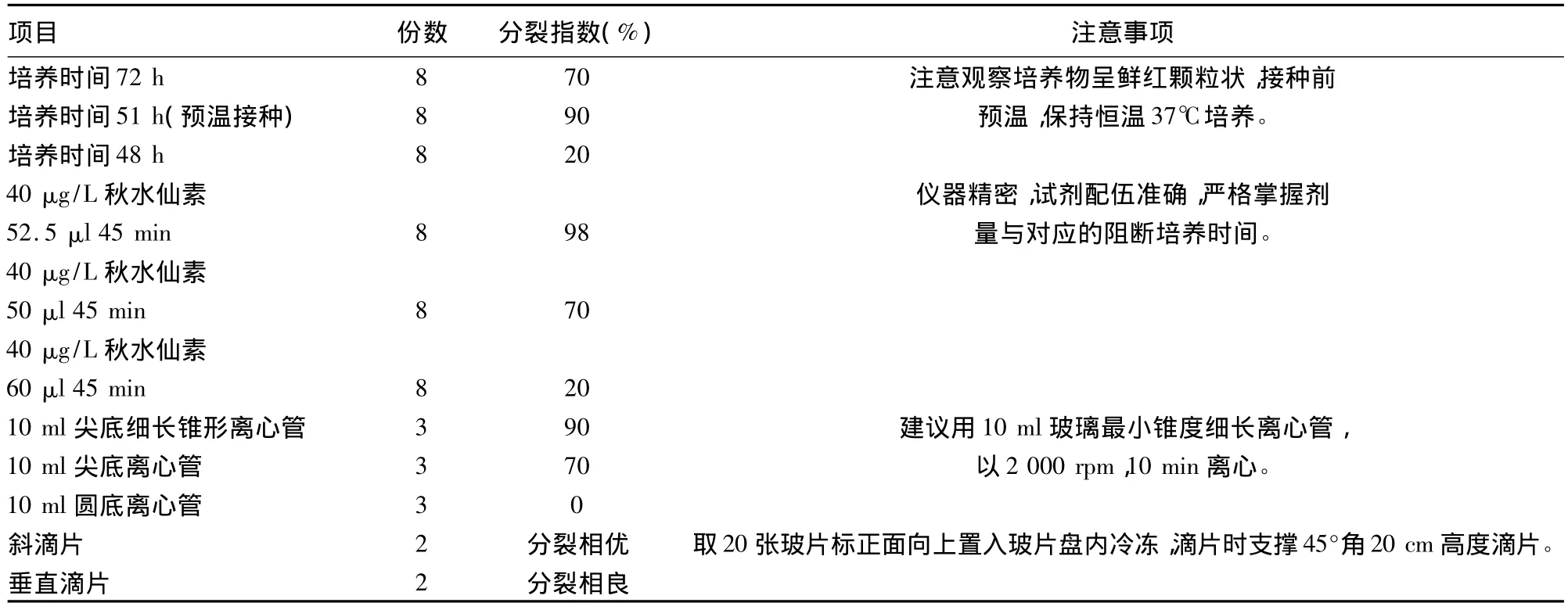
表2 实验分裂指数结果
3 讨论
3.1 离体抗凝血细胞培养生长环境和细胞周期的准确时间 在离体培养条件下,一个存活细胞可繁殖成一个细胞群体[8],细胞培养过程中的温度和营养对细胞生长发育活力速度有极大影响。每一粒离体培养细胞繁殖能力和在人体内细胞一样,需要细心培养,让它不受外界刺激干扰,提供它适宜的生存环境,方可良好分裂,故需要严格的无菌操作。采取新鲜离体抗凝血[9](37℃),迅速接种与预温37℃的1640混合培养液内,继续37℃恒温培养,保护细胞的发育与分裂活力,使离体抗凝血细胞跳过低温休克期,同在机体内37℃生存环境一样,保持原有的活力继续生长。在这种良好适宜细胞生长的环境条件下,通过混合培养液内植物血凝素(phytohemagglutin,PHA)作用刺激,促幼稚淋巴细胞成熟。其中,小牛血清是促生长因子,同时培养基还提供营养作用及双抗的保护。培养过程中每隔8 h轻轻摇荡沉淀血细胞,使每一粒细胞均匀的吸收营养和均匀获取分裂能力。离体恒温37℃培养至50 h后大量的存活细胞已经逐渐获得了旺盛的分裂能力,完成细胞间期进入分裂期。此时即用低浓度的秋水仙素短时间阻断培养,便获得第一次早期,中早期,中期分裂相,这一简单的过程保护了大部分细胞在遇低温时休克失活,创造了细胞良好的生存环境,提高了细胞分裂能力并加快了细胞生长速度,而使细胞培养时间缩短至51 h,增加了分裂量及可见大量中早期、中期、兼有早期分裂相(图1)。我们实验证明采用的离体抗凝血放置时间越长越不易细胞培养。冷冻的抗凝血细胞会导致培养失败。若不预温或遭遇中途停电,温度降低会使分裂量减少、细胞培养生长速度减慢,培养时间延长和只收集到堆积的不够舒展部分中期染色体分裂相。
3.2 细胞周期中分裂期的获得 细胞周期中分裂期一般持续0.5~2 h,细胞分裂中期总程是20 min[10]。已获得分裂能力进入分裂早期的培养细胞,由染色质逐渐螺旋化凝缩形成染色单体,此期也是细胞有丝分裂器纺锤体形成时期[11],秋水仙素具有抑制细胞分裂前期纺锤体的形成,使细胞分裂停留在中期,以积累大量分裂中期细胞[12]。中期染色体达到凝缩高峰,轮廓清楚,便于观察。在细胞周期中染色体经历着凝缩和舒展的周性的变化。它的浓度和阻断培养作用的时间影响染色体的结构形态,不同分裂时期的细胞被阻断到中前期染色体呈细长条状,中期呈棒状,中后期臂粗短,末期凝缩为染色质,秋水仙素的浓度和阻断培养作用时间需精确到最小浓度和最佳时间,才能够收集到分裂早期、早中期、中期染色体分裂相[13]。浓度过大产生细胞毒性作用则染色体形态快速凝缩使分裂相减少和染色体臂短粗、表面毛糙、边缘不齐、使明暗带纹显示不清,影响G显带制备效果。若阻断培养时间超时则染色体形态在秋水仙素的作用下逐渐凝缩,使染色体丢失制片失败。此期是制作染色体标本的关键步骤,确定好秋水仙素的量和对应的阻断培养时间,即从加秋水仙素计时起至开始离心的时间,为秋水仙素阻断培养的准确时间。若超时5 min,分裂相减少1/3,超时 10 min,分裂相减少减少 1/8,超时 15 min,分裂相减少1/9甚至完全凝缩为染色质。秋水仙素阻断培养作用最短时间在15 min内取40 μg/L的秋水仙素60 μl,25 min 内取40 μg/L 秋水仙57.5 μl,35 min 内取 40 μg/L 秋水仙素 55 μl,45 min 内取 40 μg/L 秋水仙素 52.5 μl。最短阻断培养时间和相应最低浓度秋水仙素的量,使收集到染色体形态结构处早中期和中期的最佳状态(图2)。
3.3 取最小锥度的10 ml尖底细长离心管 此是增加收集分裂量的关键步骤。由于低渗过的细胞其重力增加,受离心力的影响通过离心管壁的长度和锥度使染色体受到沉降作用,而易于收集。10 ml尖底离心管的锥度和长度不同,收集到的分裂量也不同,离心管的锥度越小收集到的分裂量越多。相反,锥度大和管壁长度不够而使细胞沉降不够,使部分染色体丢失,则收到的分裂量也甚少。斜滴片法;保持20 cm高度,滴片时产生的角度使细胞膜先被擦破,而使每条染色体顺着玻片角度自然散开黏附于热玻片或冰冻的玻片上,使各期染色体形态不易折叠而均匀的分散,更便于观察分析。每次固定静置10 min有利于清除胞浆背景和固定染色体形态结构的作用。避免酒精灯过多烤片,由于火焰温度很难掌握,过高影响胰酶消化带纹的显示。
本方法拓展了G显带检诊范围,使临床分析诊断深入研究人类染色体G显带畸变和基因定位更精确,广泛,快捷。有报到48 h可收集中期分裂相[12],但标本分裂相甚少,很难达到临床分析统计细胞数标准。国内公认标准方法约72 h完成,收集到部分中期分裂相,错过了细胞第一次分裂时期,收集到少部分中期和中后期分裂相,局限了G显带带纹的分布,使染色体畸变分析诊断基因定位受到局限。改进制作方法简单,方便,值得推广。
[1]李 洁,徐文瑜,杨娇英.外周血淋巴细胞培养及染色体G显带高分辨的实验对策[J].中国优生与遗传杂志,2006,14(1):51.
[2]熊晓芸.秋水仙素浓度对人体外周血淋巴细胞染色体标本制备的影响[J].江苏预防医学杂志,2009,6,20(2):54-56.
[3]王立斌,王贵杰,潘月英.高分辨染色体制备及显带方法的改良效果分析[J].宁夏医学杂志,2009,4:31.
[4]冯 治,黄元河.外周血高分辨染色体制备方法研究[J].临床与实验医学杂志,2011,8:1139-1141.
[5]杨艳芳,王宗霞,崔占前,等.人类染色体G显带核型技术研究进展[J].科技创新导报杂志,2010,16:13.
[6]董 烁,谢振兴.浅谈人体外周血淋巴细胞染色体的制备[J].食品工程杂志,2008,2:25-27.
[7]赵小平,余 红,黄 燕,等.外周血淋巴细胞培养及染色体G显带标本制备技术的改良[J].中国优生与遗传杂志,2009,36(11):2108-2109.
[8]刘树铮,主编.医学放射生物学[M].第2版.北京:北京原子能出版社,2010,8:103-126.
[9]韩 晶,李 洋.外周血淋巴细胞培养及制备染色体G显带的技术研究[J].中国实验诊断学杂志,2011,15(7):1177-1178.
[10]张忠寿,主编.细胞生物学和医学遗传学[M].第2版.北京:
人民卫生出版社,2008:1.
[11]张丽华,邹向阳,主编.细胞生物学和医学遗传学[M].第4版.北京:北人民卫生出版社,2011:6.
[12]马 强,刘青松,蔡 燕.外周血淋巴细胞培养及染色体制备的几点体会[J].国际检验医学杂志,2011,9(32):1641-1642.
[13]刘爱生,朱春燕.秋水仙素在人类染色体G显带制作中的应用与讨论[J].卫生职业教育杂志,2012,30(23):107-108.

