宫颈癌的发病机制、诊断及治疗进展
王 楠, 马 蓉, 吴建中, 高晓平, 陆益彬, 赵丽君, 薛 璟, 佘金雄, 何明芳
宫颈癌是全球女性最常见的恶性肿瘤之一。根据世界卫生组织的统计数据,其发病率仅次于乳腺癌,并呈逐渐年轻化的趋势[1]。每年宫颈癌的新发病例有46.6万左右,其中80%的病例发生在发展中国家。我国每年新发病例约有10万,占世界新发病例总数的1/5,且近年来呈现地区增长及发病年龄提前的现象[2]。由于其对女性健康的重大危害及其所造成的社会问题,针对宫颈癌的相关研究一直是人们关注的焦点。本文对宫颈癌发病机制、病毒和癌症进展检测方法、癌症的治疗和预防等方面的最新研究进展进行综述。
1 宫颈癌的发病机制
宫颈癌的发病原因有多个方面,其中最重要的因素是人乳头瘤病毒(HPV)感染。HPV对宫颈癌的引发作用是由德国科学家哈拉尔德·楚尔·豪森发现的,他因此荣获2008年诺贝尔生理医学奖。之后,HPV病毒的结构和致癌机制的诸多细节被广泛研究。
HPV是二十面体对称的核衣壳病毒,直径43~53 nm,无包膜,外壳由72个壳微粒组成,核酸为双链环状DNA。目前已经分出的HPV亚型有100多种[3]。按致病能力可分为:高致病基因型 HPV16、HPV18、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56、HPV58、HPV59和低致病基因型 HPV 6、HPV 11、HPV 40、HPV 42、HPV 54、HPV 61、HPV 70、HPV 72、HPV 81,其他基因型的致病性未确定。按感染类型可分为:上皮型HPV1、HPV 5、HPV 8、HPV 14、HPV 20、HPV 21、HPV 25、HPV 47 和黏膜型 HPV 6、HPV 11、HPV 16、HPV 18、HPV 31、HPV 33、HPV 35、HPV 39、HPV 41、HPV 45、HPV 51、HPV 52、HPV 56、HPV 58、HPV 59、HPV 68、HPV 70。
HPV病毒基因按功能分为3个区:早期基因区(E区)、晚期基因区(L区)和上游调节区。上游调节区功能尚不明确,可能对基因的表达起调节作用。晚期基因区的L1和L2分别编码病毒的主要衣壳蛋白和次要衣壳蛋白,共同组装成病毒的外壳。早期基因区编码的 E1、E2、E4、E5、E6、E7 蛋白参与病毒基因的复制和转录,并诱导宿主细胞发生转化。
以HPV16为例,早期基因在基因组上的排布如图1所示,E1蛋白参与病毒复制;E2参与病毒基因的复制和转录,高危型可抑制E6、E7基因的表达;E4蛋白主要与病毒颗粒的成熟和释放有关,可能还有支持病毒基因组扩增的作用;E5、E6和E7蛋白主导病毒在宿主细胞内的致瘤作用。
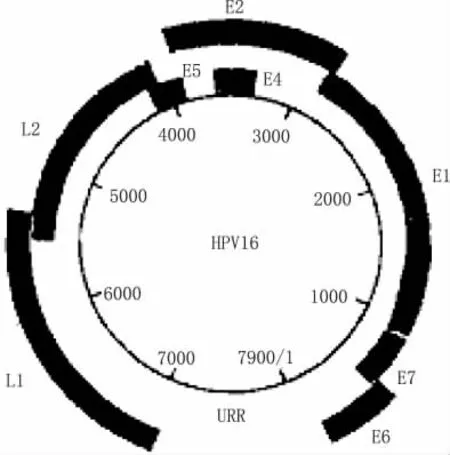
图1 HPV16基因组
同样以HPV16为例,根据目前国内外的研究结果[4-8],早期基因E5、E6和E7的编码蛋白在癌变过程中的作用如图2。
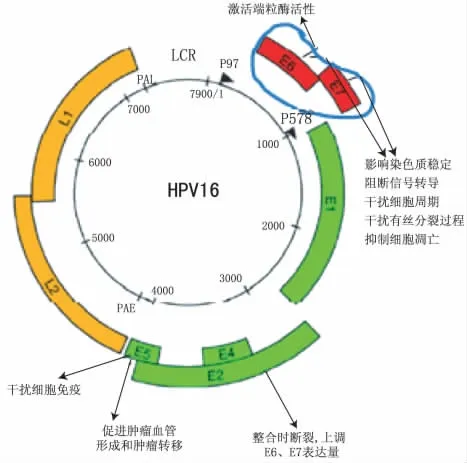
图2 HPV16与宫颈癌癌变的关系
2 宫颈癌的筛查与诊断方法
2.1 细胞学筛查
2.1.1 巴氏涂片法[9]用高精密过滤器过滤宫颈组织细胞保存液以去除标本中的黏液、血液等,将过滤后的细胞放在载玻片上,制成超薄片,95%酒精固定,再巴氏染色,于显微镜下通过观察细胞形态来诊断。一般受HPV感染的组织细胞有3种表现:核周空穴细胞,角化不良细胞及湿疣外底层细胞。薄片技术与三维治疗计划系统(TPS)分期同时应用可提高检测准确率。另外,在传统巴氏涂片法的基础上,实验技术不断改进,逐渐发展了雅图系统、液基薄层细胞检测技术(TCT)等检测体系,检测准确度有所提高。
2.1.2 组织学检查 方法主要有阴道镜检查、荧光镜检、宫颈照相等,是早期宫颈癌的辅助检测方法,用于鉴别肉眼看不见的宫颈病变。操作均直接对宫颈组织进行。其优点是能用于癌症和病变的早期诊断,缺点是特异性较低,荧光镜检具有较高的假阳性率。
2.2 病毒核酸的检测
2.2.1 宫颈组织细胞内HPV DNA的检测 宫颈组织细胞内HPV DNA浓度可作为细胞癌化风险、CIN的一项指标[10],同时可通过对病灶处 HPV DNA的检测来对HPV进行基因分型。检测方法有基因杂交捕获、通用引物PCR、荧光PCR、基因微阵列、基因芯片技术等,基本上均为常规的DNA检测手段。基因杂交捕获属于定量检测,通过判断荧光的强弱确定碱性磷酸酶的量,从而确定HPV DNA的浓度,大于等于0.1 pg·mL-1即为阳性。宋志慧等[11]利用此方法检测发现HPV感染率与宫颈癌的恶化程度呈线性关系。通用引物PCR也属于定量检测,发现利用引物MY11/09扩增L1基因,通过检测L1基因的存在与否判断感染程度。基因芯片、基因微阵列、荧光PCR等主要用于基因检测和分型。总体来讲,HPV DNA的存在和浓度与感染率呈线性关系,但目前只在统计学上有意义,还不能做到检测准确率达100%。
2.2.2 血清循环HPV DNA的检测 此方法为定性检测。从血浆、血清样本中抽提DNA,然后用设计的引物扩增相关基因并检测。所设计的引物最好为E7特异性,因为E7基因在病毒整合后不发生断裂,相比E2特异性引物应更准确。关婷等[12]研究了外周循环血HPV DNA浓度与患癌情况的线性关系。但此方法的特点是高特异性,低敏感性。另外,由于DNA的抽提目前还没有相对稳定的方法,检测阳性率波动较大,所以还不能作为定性检测HPV DNA的成熟方法。
2.2.3 外周血组织特异性标志物(CK19 mRNA)的检测 目前用的较多的扩增技术是RT-PCR,从外周血中抽提出RNA,进行逆转录,PCR扩增并鉴定。对CK19 mRNA的检测相对于循环但HPV DNA的检测具有更高的敏感性和特异性[13],可以作为外周血的一个良好的检测标志物。但HPV mRNA的检测准确度较低。
2.3 生物学标志物的检测
2.3.1 过表达产物的检测 过表达产物大多没有特异性,只能作为癌症进展阶段的判断指标[14]。检测方法以免疫组化为主。以宫颈上皮 p16、p53、Ki-67的过表达的检测为例。将切除的病灶组织制成石蜡切片,分别选用抗p16、p53、Ki-67特异性抗体和酶标二抗,通过免疫组化,在显微镜下观察过表达产物在组织中的分布情况,从而对癌症的恶性进展情况进行判断。其他的过表达产物如 VEGF、PDGF等,检测方法相同。免疫组化检测过表达产物的方法有一个明显的缺陷,即它只适用于回复性研究,目前无法作为早期诊断的手段。
2.3.2 抗原、抗体的检测 检测抗原L1蛋白能用于区分正常细胞和癌变细胞[15]。用于检测的抗原还有鳞状上皮细胞癌抗原(SCC)、胚抗原(CEA)、角质素等,各抗原对于不同的癌变类型有倾向性。检测手段主要是western blotting和ELISA。
3 宫颈癌的治疗方法
3.1 手术治疗
上世纪三四十年代,Meigs综合了经腹根治性子宫切除和Taussig的经腹盆腔淋巴结清扫术,形成了Wertheim-Meigs式手术,也是目前公认的早期子宫颈浸润癌较好的首选治疗[16]。目前最常见的手术有广泛性子宫颈切除术,腹腔镜下宫颈癌根治术,阴式广泛全子宫切除加腹腔镜下淋巴结切除术,机器人腹腔镜下宫颈癌根治术等。
3.2 药物治疗
目前临床用于治疗宫颈癌的药物有4类:(1)传统化疗药物:紫杉醇、奈达铂等;(2)抗病毒药物:无环鸟苷、5-Fu等;(3)免疫增强剂:白介素12等;(4)生物药:iRNA、疫苗等。这四类药物中,研究热点是疫苗。疫苗的研究基础是利用人体免疫机制诱导机体产生抗体。国内外近年来对疫苗的基础发掘和临床试验越来越重视,已取得一系列进展[17-19],目前临床上研究比较多的有活载体疫苗,多肽/蛋白疫苗,DNA疫苗,DC疫苗四大类[20]。树突状细胞(DC)在免疫反应中可以激活CD8+CTL和CD4+T细胞,并能分泌多种细胞因子参与免疫反应[21]。随着DC体外培养扩增技术的日渐成熟,采用DC疫苗治疗宫颈癌作为一种新的生物治疗技术已经成为了一个热点。
3.3 放射治疗
宫颈癌放射治疗包括腔内照射,体外照射,以及放疗与其他治疗手段相结合的综合手段。腔内照射技术目前国内多采用易于防护、半衰期短的192Ir为放射源。体外照射技术应根据患者及肿瘤情况具体设计放疗方案,目前应用比较多的是分割放疗。分割放疗主要有常规分割放疗、超分割放疗和加速超分割放疗。随着计算机技术的发展,近年出现了三维适形放疗(3-DCRT)和调强适形放疗(IMRT)等体外照射技术,并应用于宫颈癌的治疗,且一般为全盆照射,配合腔内后装治疗。因适形放疗技术在妇科恶性肿瘤中应用时间相对较短,宫颈癌适形放疗的安全性及有效性尚待进一步证实[22]。目前的常规治疗手段是放疗结合手术和化疗的综合手段。
3.4 热疗
热疗(hyperthermia)是利用各种物理能量在人体组织中所产生的热效应使肿瘤细胞升温到一定程度,并维持一定时间,达到杀灭癌细胞避免正常细胞遭受损伤为目的[23]。在临床上应用的热疗有局部热疗(浅表热疗、腔内加热和插植热疗),区域热疗(深部肿瘤的加热、各种热灌注技术)和全身热疗。热疗作为宫颈癌的一种辅助治疗手段目前已广泛应用于临床,大量临床资料及实验证实,热疗对晚期复发的宫颈癌有一定疗效。
3.5 基因疗法
主要方法有抑制或阻断癌基因、插入抑癌基因,自杀基因和免疫基因治疗。基因疗法为宫颈癌的治疗提供了一种新的治疗手段,其疗效已经在体内外的一些实验中得到了证明[23]。但是,其抗肿瘤的机制还未完全明确,并且还存在安全性和有效性等问题。总体来说基因治疗还处于临床研究阶段,真正应用于临床还有待于进一步的探索。
4 总结与展望
就宫颈癌的诊断而言,目前存在的问题有两点:一是诊断方法缺乏准确性,无论是对病毒核酸的检测还是对肿瘤相关标志物的检测,均没有完全准确的检测手段;二是感染程度和癌症进展程度的检测缺乏有效手段,病毒处于感染周期的哪一阶段难以在癌变前提前预知,组织癌变程度等问题只能通过以病灶组织的回顾性研究获得统计学规律,对于癌症诊断则意义不大。目前的解决方法是多种检测方法联用以提高检测准确度[24-25]。
宫颈癌的治疗目前尚缺乏专一有效的方法。传统的放化疗无法降低死亡率。新药研发专注于预防,包括抗病毒和增强免疫,以阻止病毒整合,但对于病毒整合后的细胞癌化进程则几乎没有针对性药物出现。同时抑制宫颈癌生长的药物均为传统抗癌药,非特异性导致的毒副作用无法避免。此外,由于抗原本身的复杂性、病毒亚型较多等诸多问题,疫苗的研究也比较困难。因此到目前为止还没有一个能够有效预防和根治宫颈癌的方法。但我们相信,随着生物学、医学的发展和对宫颈癌研究的深入,有朝一日,总会有治愈宫颈癌的方法被找到。
[1] 王淑珍,罗好曾.武威市宫颈癌发病率分析[J].中国肿瘤,2008,17(2):96-97.
[2] 白鹏来,宋伟奇,段仙芝.宫颈癌筛查方法的研究进展[J].内蒙古民族大学学报(自然科学版),2011,26(1):96-100.
[3] Hariri S,Steinau M,Rinas A,et al.HPV genotypes in high grade cervical lesions and invasive cervical carcinoma as detected by two commercial DNA assays,North Carolina,2001-2006[J].PLoS One,2012,7(3):e34044.
[4] Best SR,Niparko KJ,Pai SI.Biology of human papillomavirus infection and immune therapy for HPV-related head and neck cancers[J].Otolaryngol Clin North Am,2012,45(4):807-822.
[5] Schmitz M,Driesch C,Jansen L,et al.Non-random integration of the HPV genome in cervical cancer[J].PLoS One,2012,7(6):e39632.
[6] 钱永红,黄夏,蒋创.人乳头瘤病毒的致瘤性及机制[J].微生物及感染,2011,6(4):252-255.
[7] 单玉珍,马向东,王建.人乳头瘤病毒与宫颈癌研究进展[J].中国临床研究,2012,19(4):313-315,318.
[8] 冯松涛,张志刚.人乳头瘤病毒致癌机制的研究进展[J].国际病理科学与临床杂志,2010,19(1):81-85.
[9] 李清秀,钟巧莹.两种宫颈癌筛查方法的对比研究[J].广东医学,2009,39(8):1127-1128.
[10] 宋晓霞,孔令非.人乳头状瘤病毒分子生物学检测方法研究进展[J].中华实用诊断与治疗杂志,2012,26(5):419-420.
[11] 宋志慧,金海涛,刘秀荣,等.HPV DNA检查在子宫颈癌前病变筛查及诊断的评价[J].河北医药,2012,34(4):550-552.
[12] 关婷,郭新宇,叶长烂,等.宫颈癌患者循环DNA的定量及意义[J].南方医科大学学报,2008,28(9):1663-1667.
[13] 贾政军,周玉春,胡蓉,等.HPV mRNA实时荧光定量PCR检测及其与宫颈癌发生的关系[J].实用预防医学,2012,19(3):354-358.
[14] 薛翔,公丕军,范引侠.Skp2、C-myc、p27在宫颈癌组织中的表达及其意义[J].陕西医学杂志,2012,41(2):148-151.
[15] 阿尼克孜·阿不都艾尼,马正海,史茜,等.新疆地区宫颈癌和CIN患者HPV-16感染和血清中HPV-16 L1抗体的检测及其临床意义[J].肿瘤临床杂志,2012,17(4):306-309.
[16] 韩冰,冯凤芝.宫颈癌的治疗进展[J].临床合理用药,2011,4(2):135-138.
[17] Van Doorslaer K,Reimers LL,Studentsov YY,et al.Serological response to an HPV16 E7 based therapeutic vaccine in women with high-grade cervical dysplasia[J].Gynecol Oncol,2010,116(2):208-212.
[18] Huh WK,Roden RB.The future of vaccines for cervical cancer[J].Gynecol Oncol,2008,109(2 Suppl):S48-56.
[19] 朱雪琼,石一夏.HPV疫苗预防子宫颈癌临床研究进展[J].实用肿瘤杂志,2010,25(1):12-16.
[20] 张立娜,周志祥,盛望,等.宫颈癌治疗性疫苗的临床研究现状[J].现代预防医学,2012,39(5):1246-1250.
[21] 刘焕芝.宫颈癌的治疗进展[J].中国当代医药,2010,17(25):19-20.
[22] 林高娟.宫颈癌的放射治疗进展[J].现代肿瘤医学,2011,19(1):183-185.
[23] 陈薇,陈春玲.热疗在宫颈癌治疗中的应用及进展[J].中国医药指南,2011,9(31):39-42.
[24] 马秋丽.宫颈癌及癌前病变筛查中TCT和HPV-DNA联合检测的应用分析[J].中国医药指南,2012,10(3):102-103.
[25] 李发爵,胡艳琴,徐爱妹.多种方法在宫颈癌筛查中的联合应用[J].中国卫生产业,2012,9(12):149-150.

