直肠癌远端黏膜Cox-2及Bcl-2蛋白的表达及其临床意义
臧金林, 李红梅, 孟 涛, 孙 笋, 阎桂芸, 周东风
直肠癌的治疗是以手术为主的综合治疗。尽管遵循TME原则的保肛手术可以显著降低局部复发率并提高患者的生活质量,但外科医师在直肠癌根治保肛术时对肿瘤远端切缘的切除范围常难以把握。直肠癌仍有5% ~15%的局部复发率[1],而手术范围不合理,特别是直肠远端切缘切除的不充分是直肠癌局部复发的主要原因之一。显然,合理的手术切除范围是提高直肠癌患者术后生存率和生活质量的关键因素。在肿瘤的局部浸润过程中,癌边缘的组织细胞常检测不到异型性,但实际已经存在分子水平的变异。本研究旨在通过观察不同距离的直肠癌远端黏膜Cox-2及Bcl-2蛋白的表达情况,并与肿瘤组织和正常黏膜比较,明确直肠癌手术的远端安全切除范围。
1 资料与方法
1.1 一般资料 样本选自2008年9月至2010年1月期间在青岛市立医院行根治手术的54例直肠癌患者,其中男32例,女22例;年龄33~70岁,平均年龄57岁。所有患者均为中分化腺癌,其中肿瘤直径>3 cm 45例,<3 cm 9例;有淋巴结转移17例,无淋巴结转移37例;TNM分期:Ⅰ、Ⅱ期24例,Ⅲ期23例,Ⅳ期7例。取经手术切除的新鲜直肠癌组织,直肠癌远端2 cm、3 cm的黏膜组织,并选取20例同期经手术切除的直肠正常组织的石蜡切片作对照。
1.2 试剂与方法 将手术切除的组织沿对侧缘纵行剖开,平铺,自然状态下剪取大小为0.2 cm×2.0 cm的标本,福尔马林液中固定,石蜡包埋,以4 μm为平均厚度进行切片,行Bcl-2、Cox-2免疫组化染色(S-P法)。Cox-2鼠单克隆抗体(浓缩型)购自北京中杉金桥生物有限公司,Bcl-2单克隆抗体(即用型)及即用型免疫组化Elivision plus试剂盒(鼠/兔)购自福州迈新生物技术开发有限公司。具体实验方法严格按试剂盒说明书进行。
1.3 结果判定 Cox-2、Bcl-2蛋白阳性表达均以细胞质染色(黄色或棕黄色颗粒)为主,细胞膜可有少量染色。每张切片随机选择5个视野,400倍显微镜下观察计数。阳性判断标准按参考文献[2]的方法,根据染色的强度及阳性细胞的数量分别记分。不着色为0分,浅黄色为1分,黄色为2分,棕黄色为3分。无阳性细胞染色为0分,阳性细胞数<30%为1分,30% ~70%为2分,>70%为3分。按两者之和判断结果,≥2分为阳性(+),<2分为阴性(-)。
1.4 统计学方法 应用SPSS 13.0软件包进行统计分析。计量资料以均数±标准差(x±s)表示。各组数据间采用方差分析,组间两两比较采用q检验,检验水准 α=0.05。
2 结果
Cox-2、Bcl-2蛋白阳性表达均以细胞质染色(黄色或棕黄色颗粒)为主,细胞膜可有少量染色。Cox-2蛋白在肿瘤组织,肿瘤远端2 cm、3 cm黏膜组织,正常组织中的阳性表达率分别为 81.48%、20.01%、18.11%、10.00%;Bcl-2 蛋白在肿瘤组织,肿瘤远端2 cm、3 cm黏膜组织,正常组织中的阳性表达率分别为 77.78%、20.75%、22.56%、5.00%。直肠癌远端2 cm、3 cm黏膜组织与肿瘤组织中Cox-2和Bcl-2蛋白的表达比较,差异有统计学意义(均P<0.05),与直肠正常黏膜组织中的表达差异则无统计学意义(均P>0.05),见表1。在不同的肿瘤临床病理参数中,直肠癌远端2 cm、3 cm黏膜组织中Cox-2和Bcl-2蛋白的表达也无明显差异(均P>0.05),见表2。

表1 Cox-2、Bcl-2蛋白在直肠各部位黏膜中的表达计分(x±s)
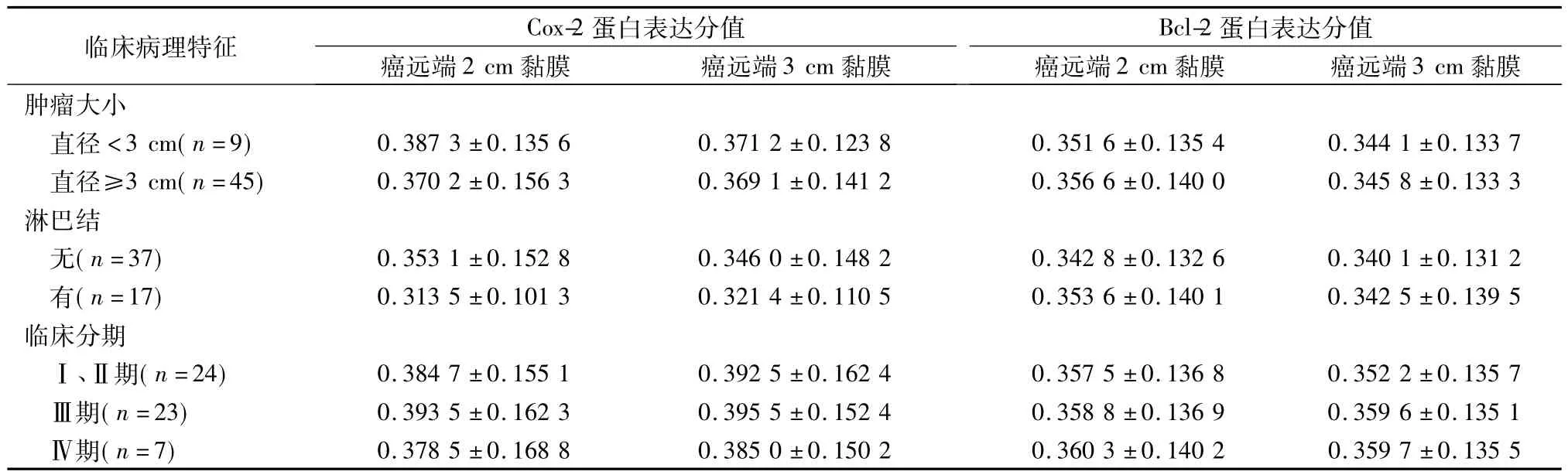
表2 直肠癌远端黏膜Cox-2、Bcl-2蛋白表达计分值与临床病理特征间的关系(x±s)
3 讨论
直肠癌是临床上常见的胃肠道恶性肿瘤。合理的手术切除范围是提高直肠癌患者术后生存率和生活质量的关键因素。手术范围不合理,特别是直肠远端切缘切除不充分是直肠癌术后局部复发的主要原因之一[3]。如何判定直肠下段切除范围是否合理,已成为临床上亟待解决的问题。对于直肠癌保肛手术的安全切缘,过去主要通过病理学方法进行判断。但病理学检测手段易受主观因素影响,尤其是对极微量的肿瘤细胞或微小转移灶缺乏灵敏度。在肿瘤的局部浸润中,癌边缘的组织细胞常检测不到异型性,但实际已有分子水平的变异。目前一致认为直肠癌远端肠壁“分子定界”的范围对于指导直肠癌保肛手术切除肿瘤下切缘的长度有重要意义,并由此提出了直肠癌远切缘“分子生物学长度”的概念,即以分子生物学方法检测直肠癌远切缘多种分子生物学指标的表达,以此界定分子生物学长度较为安全实用。本研究通过检测直肠癌远切缘黏膜Cox-2及Bcl-2蛋白的表达,来了解直肠癌远切缘黏膜细胞在分子水平上的变异情况。Cox-2蛋白在大多数正常组织中检测不到,其是一种诱导性即刻反应蛋白(inducing immediate 2 early gene),可由多种因素所诱导,如细胞因子、生长因子、促癌剂等。肠上皮细胞Cox-2表达可抑制细胞凋亡,从而诱导肿瘤产生,Cox-2同时能促进肿瘤血管生长,为肿瘤生长和转移提供所必需的营养[4]。Bcl-2蛋白通过抑制细胞的程序死亡,破坏细胞数量的动态平衡而导致肿瘤发生[5]。所以通过对Cox-2、Bcl-2蛋白表达的检测,可推测直肠癌远切缘是否有原发性癌前病变,以判断是否适合保肛手术。
本研究结果表明,在肿瘤组织、癌远端2 cm黏膜、远端3 cm黏膜组织内均有Cox-2、Bcl-2的表达,但远端黏膜内两蛋白的表达与肿瘤组织内的表达相比差异均有统计学意义(均P<0.05),但与正常黏膜比较差异均无统计学意义(均P>0.05);直肠癌远端2 cm、远端3 cm黏膜处的Cox-2蛋白及Bcl-2蛋白的表达与直肠癌的大小、淋巴结转移及TNM分期等生物学特性均无相关性(均P>0.05)。提示直肠癌远端2 cm或3 cm黏膜切缘的分子水平并未发生明显的异常改变,这较常规病理学检测更加准确可靠。由此我们推断,直肠癌手术远端切缘切除2 cm即能满足保肛手术的需要。另外,其他肿瘤学指标的检测也可进一步证实远端切缘切除2 cm是否可靠,这也是我们下一步的工作计划。
综上所述,常规的病理学检查结合分子生物学检测可提高手术切缘诊断的敏感性,对预防患者术后复发和评估预后都具有重要的意义。从分子水平重新评价和确定肿瘤的手术切缘还待进一步的深入探究。
[1] Palmer G,Martling A,Cedermark B,et al.A population-based study on the management and outcome in patients with locally recurrent rectal cancer[J].Ann Surg Oncol,2007,14(2):447-454.
[2] Yang Y,Zhu J,Gou H,et al.Clinical significance of Cox-2,Survivin and Bcl-2 expression in hepatocellular carcinoma(HCC)[J].Med Oncol,2011,28(3):796-803.
[3] 庞国栋,周东风,牛军.直肠癌安全远切缘研究进展[J].中国现代普通外科进展,2010,13(5):381-383.
[4] Hoellen F,Kelling K,Dittmer C,et al.Impact of cyclooxygenase-2 in breast cancer[J]. Anticancer Res,2011,31(12):4359-4367.
[5] Petri?or O,Giu?cǎ SE,Sajin M,et al.Ki-67,p53 and Bcl-2 analysis in colonic versus rectal adenocarcinoma[J].Rom J Morphol Embryol,2008,49(2):163-171.

