小鼠缺血再灌注损伤后海马齿状回Wnt1、Wnt3a的表达变化
罗时鹏 余资江 肖朝伦 余 彦 康朝胜 孙宝飞 李玉美
(贵阳医学院基础医学院人体解剖学教研室,贵州 贵阳 550004)
随着对脑缺血研究的进展,人们早已打破了成年人脑神经元不能再生的理论〔1〕。新近研究发现脑缺血后原处于静止状态的内源性神经干细胞(NSCs)被激活,并增殖分化为新生细胞。在中枢神经系统中,Wnt/β-catenin信号通路是细胞增殖分化的关键调控环节,与脑损伤后的修复有关。本研究检测经典Wnt信号通路中两个关键信号分子Wnt1、Wnt3a在小鼠缺血再灌注后海马组织中的表达和变化规律,探讨Wnt/β-catenin信号转导通路在脑缺血再灌注损伤中的作用及机制。
1 材料与方法
1.1 实验动物及试剂 健康1月龄雄性昆明小鼠80只,体重18~25 g,由贵阳医学院动物实验中心提供〔合格证号:SCXK(黔)2002-0001〕。随机分为正常组、假手术组和缺血再灌注后1、3、7、14、21、28 d 组,每组各 10 只。鼠抗 5-溴脱氧尿嘧啶核甘(BrdU)单克隆抗体购自武汉博士德生物工程公司,小鼠Wnt1、Wnt3a原位杂交检测试剂盒均购自天津灏洋生物制品有限公司,DAB显色试剂盒购自福建迈新公司。
1.2 脑缺血再灌注模型制备及BrdU标记 建立小鼠缺血再灌注脑损伤模型,术前12 h禁食,4 h禁水。5%水合氯醛(100 mg/kg)腹腔注射麻醉小鼠后,仰卧固定于手术操作台,颈前部皮毛常规消毒,行颈部正中切口,长约2 cm,逐层分离暴露双侧颈总动脉及伴行的迷走神经,无创微动脉夹夹闭双侧颈总动脉,造成全脑缺血〔2〕。30 min后松开动脉夹恢复再灌注,缝合切口,术中保持动物肛温(36.6±0.5)℃;假手术组不予夹闭颈总动脉,其余操作同实验组。各组小鼠均于取脑时间点前24 h,随机抽取10只小鼠行腹腔注射BrdU,50 mg/kg×3次,每次间隔4 h,并于末次注射12 h后处死。
1.3 取材与切片 模型建立后,于各相应时间点以4%多聚甲醛经心脏灌注固定后取脑。取出脑组织用4%多聚甲醛溶液固定过夜。石蜡包埋组织块,冠状连续切片,片厚5 μm,连续贴片,行BrdU免疫组化显色和原位杂交。
1.4 BrdU免疫组织化学染色步骤 石蜡切片常规脱蜡至水,用3%H2O2灭活内源性酶10 min,行抗原修复后,分别滴加一抗 (山羊抗小鼠β-catinen、cyclineD1多克隆抗体),阴性对照以PBS代替一抗,4℃过夜,滴加通用型二抗,进行DAB显色,梯度乙醇脱水,二甲苯透明,中性树胶封片。以胞质或胞核中出现棕黑色或棕黄色颗粒为阳性细胞。
1.5 Wnt1、Wnt3a多点标记的地高辛探针原位杂交步骤 ①石蜡切片脱蜡至水;②0.01 mol/L PBS冲洗3次;③滴加过氧化氢封闭液,室温,20 min,封闭内源性过氧化氢酶;④0.01 mol/L PBS冲洗3次;⑤滴加复合消化工作液,室温,30 min;⑥0.01mol/L PBS冲洗3次;⑦0.2×SSC冲洗1次,室温,3 min;⑧滴加预杂交工作液,37℃湿盒孵育1 h;⑨0.2×SSC冲洗,5 min×3次,室温;⑩滴加杂交工作液,37℃湿盒孵育4 h;○11 2× SSC 冲洗,5 min× 3 次,37℃;○120.2 × SSC 冲洗,5 min×3 次,37℃;○130.01 mol/L PBS 冲洗,5 min ×3 次,37℃;○14滴加小鼠抗地高辛生物素标记的抗体工作液,37℃湿盒孵育45 min;○150.01 mol/L PBS 冲洗,5 min ×3 次;○16滴加高敏过氧化物酶链亲和素复合物工作液,37℃湿盒孵育45 min;○17 0.01 mol/L PBS 冲洗,5 min ×3 次;○18DAB 显色;○19梯度乙醇脱水,每步5 min;○20二甲苯透明;○21中性树胶封片。
1.6 图像分析 采用CMIAS真彩色医学图像免疫组化自动分析系统计数阳性细胞。每只小鼠随机取5张切片,在200倍光镜下,每张切片取6个视野,计数每个视野海马齿状回颗粒细胞下层的阳性细胞数,以平均值代表各组阳性数结果。
1.7 统计学处理 采用SPSS13.0软件,计量资料以±s表示,进行F检验。
2 结果
2.1 BrdU免疫组化染色 正常组(4.28±0.57)和假手术组小鼠海马齿状回颗粒细胞下层可见少量BrdU阳性细胞,缺血再灌注后3 d BrdU阳性细胞开始增加,缺血再灌注后7 d达高峰(P<0.05),随着灌注时间的延长BrdU阳性细胞数呈下降趋势,缺血再灌注后14 d开始减少,依旧高于正常水平(P<0.05)。缺血再灌注后28 d BrdU阳性细胞数降至正常水平(P >0.05)。见图1,表1。
2.2 Wnt1、Wnt3a原位杂交结果 正常组和假手术组海马齿状回颗粒细胞下层均无明显Wnt1、Wnt3a阳性表达。缺血再灌注各组均可见Wnt1、Wnt3a阳性细胞,再灌注后1 d表达开始增加,14 d达高峰,28 d减少至正常水平。与正常组和假手术组比较,均明显增多(P<0.05)。见图2、图3,表2、表3。

图1 各实验组海马齿状回区BrdU阳性细胞(SP,×200)
表1 各组小鼠海马齿状回BrdU阳性细胞计数(n=10,±s)

表1 各组小鼠海马齿状回BrdU阳性细胞计数(n=10,±s)
与正常组比较:1)P<0.05
2±0.52 5.61±1.06缺血再灌注组 15.51±1.021) 20.13±3.471) 55.42±1.971) 14.52±1.911) 12.20±1.191) 4.94±0.641)1 d 3 d 7 d 14 d 21 d 28 d假手术组 2.96±0.46 3.29±0.52 4.62±1.13 4.94±1.44 4.6组别
表2 各组小鼠海马齿状回Wnt1阳性细胞计数(n=10,±s)

表2 各组小鼠海马齿状回Wnt1阳性细胞计数(n=10,±s)
与正常组、假手术组比较:1)P<0.05;与缺血再灌注后14 d组比较:2)P<0.05,下表同
0.38±0.18 - - - - -假手术组 0.37±0.17 - - - - -缺血再灌注组 4.00±0.461)2) 6.88±0.441)2) 15.00±1.461)2) 20.13±1.081) 18.75±0.801) 1.38±0.381)2)1 d 3 d 7 d 14 d 21 d 28 d正常组指标
表3 各组小鼠海马齿状回Wnt3a阳性细胞计数(n=10,±s)
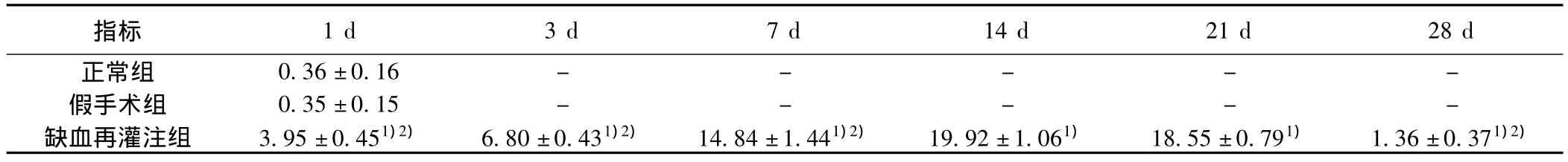
表3 各组小鼠海马齿状回Wnt3a阳性细胞计数(n=10,±s)
指标0.36±0.16 - - - - -假手术组 0.35±0.15 - - - - -缺血再灌注组 3.95±0.451)2) 6.80±0.431)2) 14.84±1.441)2) 19.92±1.061) 18.55±0.791) 1.36±0.371)2)1 d 3 d 7 d 14 d 21 d 28 d正常组
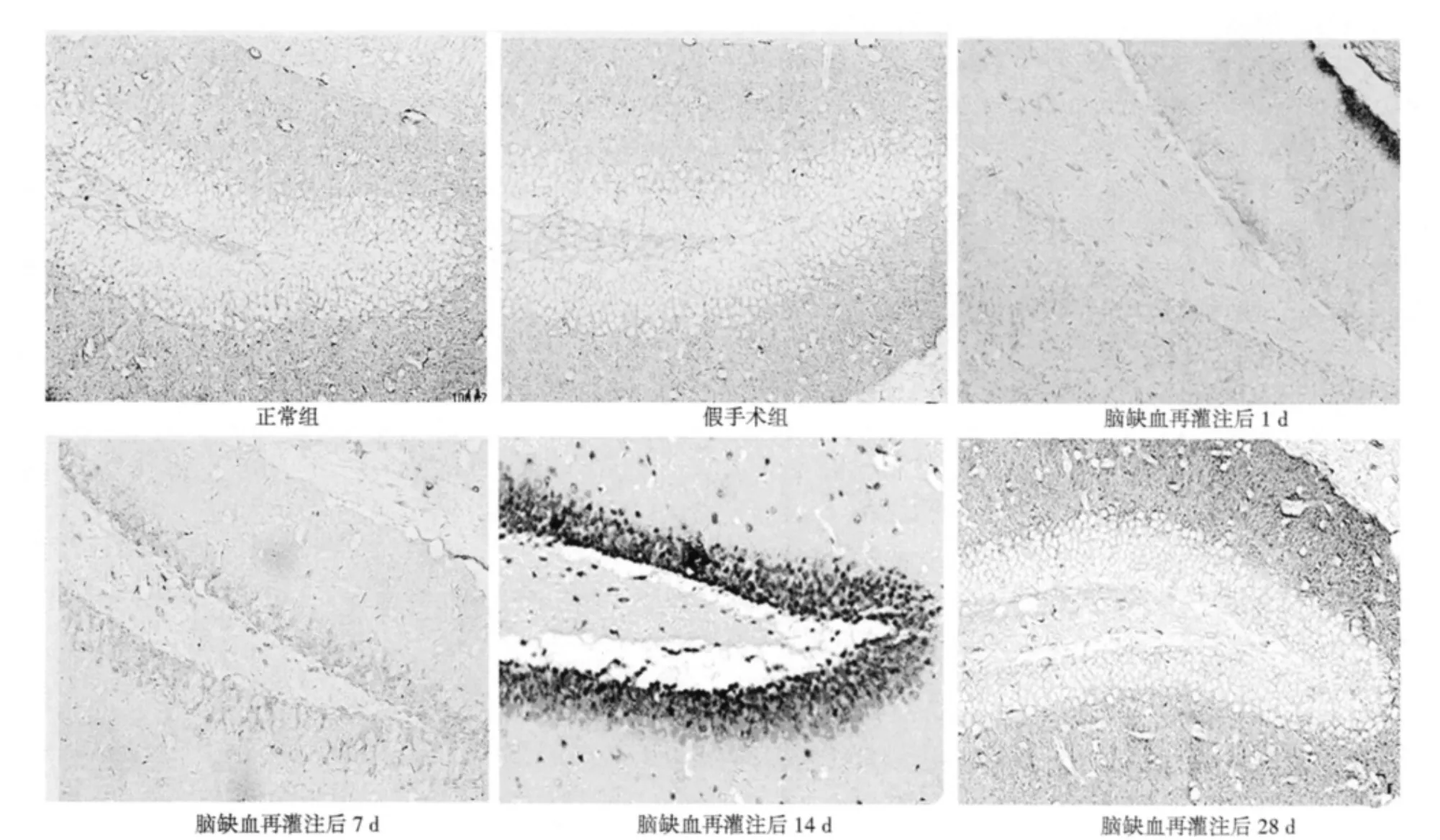
图2 各组海马齿状回区Wnt1阳性细胞(SP,×200)
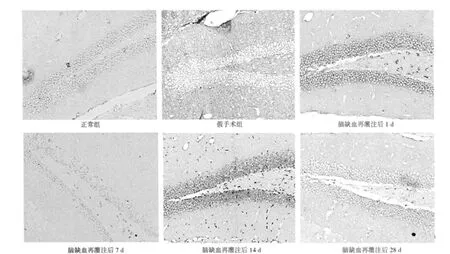
图3 各组海马齿状回区Wnt3a阳性细胞(SP,×200)
3 讨论
研究发现缺血性脑损伤造成神经元退行性变的同时,也促进了神经再生〔3〕。进一步的研究显示成年中枢神经系统中存在具有自我更新和多向分化潜能的NSCs〔4〕。NSCs是神经系统中未发育成熟的神经前体细胞。主要位于侧脑室室管膜下区(SVZ)和海马齿状回颗粒细胞下层区(SGZ)〔5〕。它具有自我更新和多分化潜能,能通过不对称分裂产生各种神经细胞的功能。正常情况下神经干细胞处于静止状态,但在损伤、缺血等刺激因素的作用下可被激活,发生增殖、迁移、分化等一系列变化来替代坏死的神经细胞,修复损伤、恢复神经功能〔6〕。
BrdU作为胸腺嘧啶核苷的衍生物,可代替胸腺嘧啶在细胞有丝分裂的S期作为原料掺入到细胞合成的DNA中,只要细胞不消亡,BrdU就在细胞核的DNA中长期存留。掺入到细胞DNA中的BrdU可通过抗BrdU单克隆抗体在组织切片上显示。实验中常采用活体注射或细胞培养加入BrdU后,利用抗BrdU单克隆抗体,ICC染色,显示增殖细胞。本实验可见在正常情况下,NSCs处于静止状态,在受到脑缺血再灌注损伤的刺激后,内源性NSCs开始增殖,灌注后7 d NSCs增殖达高峰,随后细胞增殖逐渐降低。国外研究显示,脑缺血后NSCs具有增殖能力,参与脑缺血的病理生理过程〔7〕,与本研究结果一致。这说明小鼠脑缺血再灌注损伤可激发内源性NSCs的增殖。
近年来研究表明,缺血性脑损伤造成神经元退行性变的同时,也促进了神经再生,Wnt信号途径与NSCs的增殖及神经发生密切相关,认为Wnt信号途径与脑损伤后的修复有关〔8〕。Wnt/β-catenin信号传导通路由配体(Wnt家族分子)、跨膜受体(Frizzled家族分子和CRP-5/6)、胞浆调节蛋白(DSH、APC、AXIN、GSK-3β、β-catenin)以及核内转录因子(TCF/LEF)等组成〔9〕。其中Wnt蛋白为脂质修饰的分泌型蛋白富含半胧氨酸,目前哺乳动物基因组中已经发现19种Wnt基因,可划分为两大亚族:Wnt-1和 Wnt-5a亚族。Wnt-1亚族包括 Wntl,2,3,3a,7a,8 等;Wnt-5a亚族包括 Wnt4,5a,6,11 等。其中 Wnt-l亚族激活经典的Wnt/β-catenin信号通路〔10〕,对NSCs增殖及分化有一定的调控作用,对胚胎神经系统发育具有重要作用。Wnt家族是Wnt信号传导通路中的启动因子,当受到Wnt蛋白信号刺激时,Wnt蛋白就与跨膜受体Frizzelds以及共同受体低密度脂蛋白受体相关蛋白(LRP-5、LRP-6)结合,作为Wnt信号通路活化的重要起始信号。
Wnt-1蛋白是控制细胞生长、增殖的关键分泌信号分子,可传递细胞间相互调控信息〔11〕。Wnt-1的缺失可引发中脑和小脑的严重缺陷,Wnt-3a的缺失可引起海马整体功能的丧失〔12〕。Wnt3a是WNT基因家族中的重要成员,在胚胎发育期Wnt3a信号蛋白在Wnt基因家族成员中最先表达〔13〕。Wnt3a是Wnt信号通路中重要的激活剂,大量研究已表明它表达的增加可促进细胞的分裂、加速分化增殖〔14〕。早期国外学者使用纯化获得的Wnt3a蛋白使体外培养的骨髓间充质干细胞大量增殖〔15〕。近期我国学者研究发现Wnt3a蛋白在胚胎发育时期不仅激活了Wnt信号通路,还促进 NSCs的增殖〔16〕。Davidson 等〔17〕通过添加Wnt3a观察发现,Wnt3a不仅能提高NSCs的数量,还能有效促进克隆球体积的增大。由此可见Wnt3a在中枢神经系统发育、维持NSCs自我更新和分化的过程具有重要作用。
1 Eriksson PS,Perfilieva E,Bj6rk-Eriksson T,et al.Neurogenesis in the adult human hippocampus〔J〕.Nat Med,1998;4(11):1313-7.
2 Bi X,Zhang Y,Yan B,et al.Quetiapine prevents oligodendrocyte and myelin loss and promotes maturation of oligodendrocyte progenitors in the hippocampus of global cerebral ischemia mice〔J〕.J Neurochem,2012;123(1):14-20.
3 Inoue T,Kagawa T,Fukushima M,et al.Activation of canonical wnt pathway promotes proliferation of retinal stem cells der-ived from adult mouse ciliary margin〔J〕.Stem Cells,2006;24(1):95-104.
4 Muraoka K,Shingo T,Yasuhara T,et al.The high Integration and differentiation potential of autologous neural stem cell transplantation compared with allog-eneic transplantation in adult rat hippocampus〔J〕.Exp Neurol,2006;199(2):311-27.
5 Zhanq RL,Zhang ZG,Chopp M.Ischemic stroke and neurogenesis in the subventricular zone〔J〕.Neuropharmacology,2008;55(3):45-352.
6 徐启飞,周初松,靳安民,等.大鼠脊髓损伤后内源性神经干细胞增殖过程中wnt-1的表达〔J〕.中国脊柱杂志,2009;19(2):138-42.
7 Meng XT,Chen D,Dong ZY,et al.Enhanced neural differentiation of neural stem cells and neurite growth by amniotic epithelial cell co-culture〔J〕.Cell Biol Int,2007;31(7):691-8.
8 Colucci-D'Amato L,di Porzio U.Neurogenesis in adult CNS:from denial to opportunities and challenges for therapy〔J〕.Bioessays,2008;30(2):5-145.
9 刘 洋,张晨光,周春燕.经典wnt/β-catenin信号通路中的双向调控〔J〕. 北京大学学报,2010;42(2):238-42.
10 Verkaar F,van der Doelen AA,Smits JF,et al.Inhibition of Wnt/β-catenin signaling by p38 MAP kinase inhibitors is explained by cross-reactivity with casein kinase Iδ /ε〔J〕.Chem Biol,2011;18(4):485-94.
11 Zhang Z,Zhao R,Qi J,et al.Inhibition of glycogen synthase kinase-3β by Angelica sinensis extract decreases β-amyloid-induced neurotoxicity and tau phosphorylation in cultured cortical neurons〔J〕.J Neurosci Res,2011;89(3):437-47.
12 Cerpa W,Godoy JA,Alfaro I,et al.Wnt-7a modulates the synaptic vesicle cycle and synaptic transmission in hippocampal neurons〔J〕.J Biol Chem,2008;283(9):5918-27.
13 Yin ZS,Zu B,Chang J,Zhang H.Repair effect of Wnt-3a protein on the contused adult rat spinal cord〔J〕.Neurol Res,2008;30(5):480-6.
14 Gjertsson I,Laurie KL,Devitt I,et al.Tolerance induction using lenteviral gene delivery delays on set and severity of collagen Ⅱarthritis〔J〕.Mol Ther,2009;17(4):632-40.
15 Hirabayashi Y,Itoh Y,Tabata H,et al.The Wnt/beta-catenin pathway directs neur-onal differentiation of cortical neural precursor cells〔J〕.Development,2004;131(12):2791-801.
16 才礼扬,赵 斌,王栓科,等.脊髓损伤后Wnt3a表达对神经干细胞增殖的影响〔J〕.国际骨科学杂志,2011;32(2):129-31.
17 Davidson KC,Jamshidi P,Daly R,et al.Wnt3a regulates survival,expansion,and ma-intenance of neural progenitors derived from human embryonic stem cells〔J〕.Mol Cell Neuro Sci,2007;36(3):408-15.

