顺铂诱导宫颈癌细胞上皮间质转化的研究*
杨 丞,饶 翔,丁莉利,王明华
(1.海南医学院病理教研室,海南海口571101;2海南省海口市人民医院病理科,海南海口570208)
上皮间质转化(epithelial-mesenchymal transition,EMT)是具有极性的上皮细胞转换成具有活动能力、能够在细胞基质间自由移动的间质细胞的过程。近年有学者通过比较多种耐药细胞系和其亲本细胞系的形态和检测EMT标记性蛋白的表达,证实耐药细胞株发生EMT改变,并使细胞侵袭力增强[1]。但在化疗药物干预早期,EMT能否发生、发生的时间点及其与肿瘤细胞侵袭能力和耐药性之间的关系等问题,目前尚不清楚。本文通过体外细胞学实验研究,以低剂量短时间给药处理,详细观察顺铂诱导低分化宫颈癌HCE1细胞株EMT的时间点及其与肿瘤细胞侵袭能力和耐药性之间的关系,并明确Twist1是否为调控顺铂诱导宫颈癌细胞EMT的关键转录因子。
1 材料与方法
1.1 材料 实验细胞:人低分化宫颈癌HCE1细胞株购自中南大学湘雅医学院细胞中心。主要试剂:高糖亚甲基双丙烯酰胺(dulbecco′s modified eagle′s medium,DMEM)培养基购自Gibco公司,新生牛血清购自杭州四季青公司,胰蛋白酶和二甲基亚砜(dimethyl sulfoxide,DMSO)购自Amersco公司,四甲基偶 氮 唑 盐 (3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliumromide,MTT)试剂购自Sigma公司,Transwell小室购自Corning Coster公司,基底膜Matrigel购自BD Biosciences公司,顺铂(批号:H37021358)购自山东齐鲁制药厂,相对分子质量300.3Da。一抗抗体Vimentin、E-Cadherin、PGlycoprotein购自ProMab公司。二抗羊抗鼠/兔抗体免疫组织化学试剂盒购自迈新公司。Trizol试剂购自Invitrogen公司,cDNA Synthesis Kit购自TOYOBO公司,PCR Master Mix(0.05units/uL Taq DNA Polymerase in reaction buffer,4 mmol MgCl2,0.4mmol dNTP)购自 Fermentas公司,DNA Marker DL2000购自TaKaRa公司,AGAROSE购自AMRESCO公司,10×DNA上样缓冲液购自ProMab公司。PCR引物用Primer premier 5.0软件设计,由Invitrogen公司合成。引物序列及产物长度如下:Twist上游引物:5′-GAG TCC GCA GTC TTA CGA G-3′,下 游 引 物:5′-ATC CTC CAG ACC GAG AAG-3′,长度282bp;甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上 游 引 物:5′-ACC ACA GTC CAT GCC ATC AC -3′,下 游 引 物:5′-TCC ACC ACC CTG TTG CTG TA-3′,长度450bp。
1.2 方法
1.2.1 细胞培养并形态观察 以HCE1细胞株为对照组,加顺铂组(终浓度0.1mg/L)为实验组,分别以相同的细胞量接种到培养瓶,加入10%新生牛血清DMEM培养基置37℃、5%CO2的细胞培养箱中孵育,分别于24、48、72、96h等以倒置相差显微镜观察细胞形态并拍照,比较细胞形态差异,寻找顺铂诱导细胞EMT的时间点。
1.2.2 细胞生长曲线测定方法 待以上细胞长至对数生长期,用胰酶消化后重悬并进行细胞计数,在96孔板每孔加入100μL(104/mL)细胞,各设3个平行孔,置37℃5%CO2细胞培养箱培养,待24h后吸取实验组培养液加入100μL含顺铂的培养液(终浓度0.1mg/L)。再过24h每孔加10μL MTT(5g/L),37℃、5%CO2的细胞培养箱中继续孵育4h后弃上清液,每孔再加200μL DMSO,出现蓝紫色颗粒结晶并充分溶解后于570nm处测光密度(OD)值,连续6d。然后以OD值为纵轴,时间为横轴绘制细胞生长曲线,比较生长趋势差异。
1.2.3 细胞免疫组织化学检测方法 以HCE1细胞株为对照组,在EMT时间点的细胞为EMT组,取生长状态良好的细胞玻片,D-Hank′s缓冲液清洗2次,于固定液固定10min,1×PBS缓冲液(0.01mol/L,pH 7.2)洗涤细胞片5min×3次,3%H2O2室温孵育10min,再用1×PBS缓冲液洗涤5min×3次;滴加正常山羊血清封闭液,室温20min,甩去多余液体,滴加一抗50μL,4℃过夜;1×PBS缓冲液洗涤5min×3次,滴加复合二抗(辣根过氧化物酶标记的羊抗兔IgG),室温静置20 min,1×PBS洗涤5min×3次;二氨基联苯胺(Diaminobenzidine,DAB)显色约4min,浸入自来水终止显色,苏木精复染,乙醇分化1s,自来水冲洗15min,入乙醇脱水二甲苯透明;中性树胶封片,镜检。比较两组细胞阳性染色差异。
1.2.4 肿瘤细胞侵袭实验方法 用50mg/L Matrigel 1∶8稀释液包被Transwell小室底部膜的上室面,4℃风干;消化细胞,终止消化后离心弃去培养液,用PBS洗涤2遍,用含牛血清白蛋白的无血清培养基重悬。调整细胞密度至5×104/mL;Transwell小室6孔板下室加入1mL含胎牛血清(Fetal calf serum,FBS)的培养基,上室加入细胞悬液,每组设3个平行孔,培养细胞24h。用棉签擦去基质胶和上室内的细胞,用95%乙醇固定15min,苏木素染色10min,200倍光镜视野下计数5个视野,计算平均细胞穿孔数。
1.2.5 半定量RT-PCR检测Twist1表达方法 每组取107个细胞加入1mL Trizol试剂消化,室温静置5min后加入0.2 mL氯仿,震荡15s后在4℃下12 000r/min离心15min,将水样层转移至干净的试管,加入0.5mL异丙醇,混匀后-20℃下静置15min,在4℃下12 000r/min离心10min,移去上层悬液,将RNA沉淀用1mL 75%乙醇洗涤,在振荡器上混匀后4℃下7 500r/min离心5min,弃去上清液。适度干燥RNA沉淀后,加入适量0.1%焦磷酸二乙酯(diethyl pyrocarbonate,DEPC)水,使RNA完全溶解。2 000r/min离心20s。紫外吸收测定法测定RNA在分光光度计260nm和280nm处的吸收值,评估RNA纯度。逆转录体系如下:总RNA 1μL,Oligo(dT)20(0.01mol/L)1μL,无 RNase水10μL,5×RT Buffer 4μL,dNTP混合物(0.01mol/L)2μL,RNase抑制剂(10u/μL)1μL,逆转录酶1μL,在42℃反应20min,99℃反应5min,4℃反应5min,即完成cDNA第一链合成。PCR反应体系如下:cDNA模板1μL,引物(10μmol/L)1μL,PCR Master混合液(成分见材料)12.5μL,PCR缓冲液10.5μL,在95℃预变性5min,94℃变性30s,55℃退火30s,72℃延伸30s,40个循环;72℃延伸5min。取8μL PCR产物加入2μL上样缓冲液中于1.5%的琼脂糖凝胶上电泳(90v30min),用VDS凝胶成像仪摄影后进行灰度扫描,计算各扩增产物与GADPH的比值。重复3次。
1.3 统计学处理 利用SPSS13.0软件进行统计学分析,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 细胞形态 分别于24、48、72、96h在显微镜下比较两组细胞的形态,发现实验组细胞在72h发生EMT的形态改变:连接紧密的细胞变得扁平,更趋于梭形,且失去了大部分细胞连接(图1)。72h即为HCE1发生EMT的时间点。
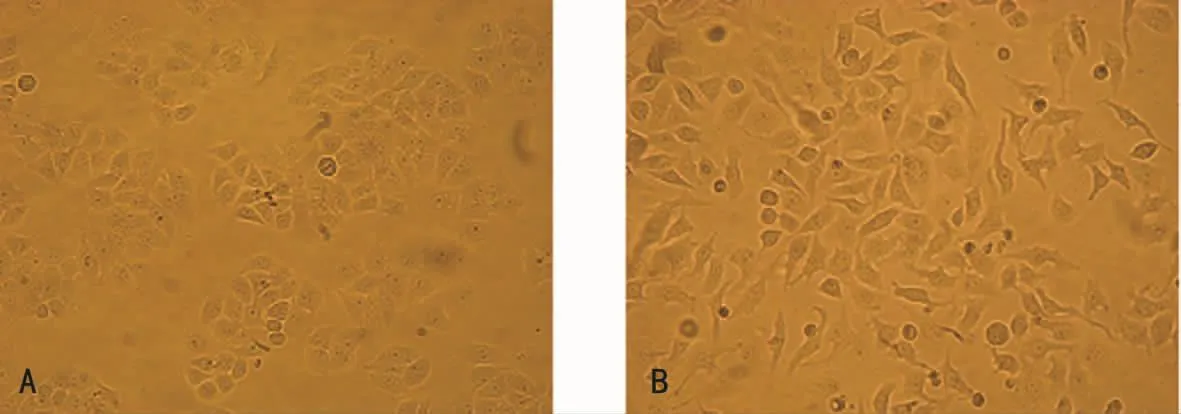
图1 两组72hHCE1细胞形态(倒置显微镜×100)
2.2 细胞生长曲线 实验组细胞生长趋势于72h前稍慢于对照组,72h后生长趋势逐渐与对照组接近,96h后两组细胞均进入平台期,生长趋势基本重合,见图2。
2.3 细胞免疫组织化学检测结果 细胞黏附分子(E-cadharin)定位于细胞膜和细胞间桥处,对照组高表达,EMT组表达减少;vimentin定位于细胞膜及细胞质处,对照组有表达,EMT组表达增加;P糖蛋白(P-gp)定位于细胞膜及细胞质处,对照组有表达,EMT组表达增加,见图3。
2.4 肿瘤细胞侵袭结果 对照组HCE1细胞的平均穿膜细胞数为(39.000 0±2.828 4)个,EMT组HCE1的平均穿膜细胞数为(100.166 7±3.868 7)个,EMT组较对照组细胞多,侵袭能力EMT组强于对照组,其差异有统计学意义(P<0.05),见图4。
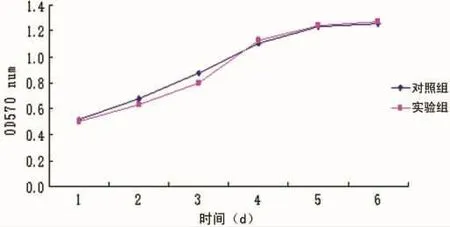
图2 宫颈癌细胞株HCE1MTT生长曲线
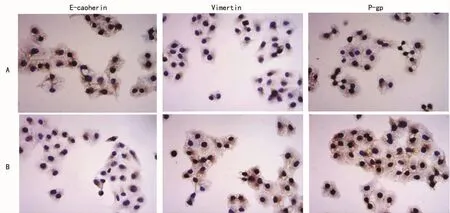
图3 两组HCE1细胞标志蛋白的免疫组织化学检测(SP法×200)
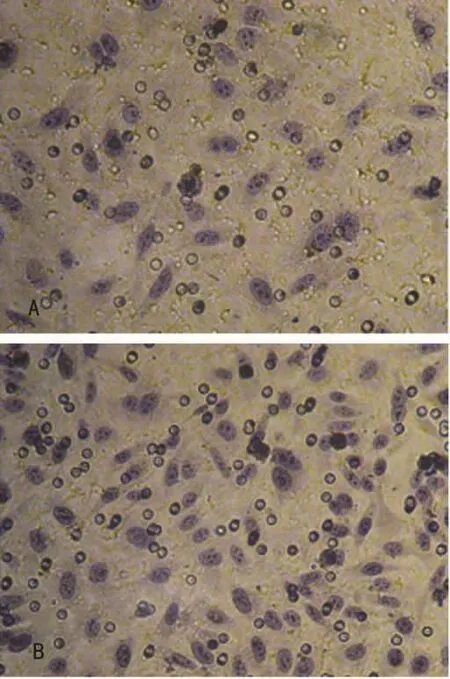
图4 两组HCE1细胞侵袭能力检测(倒置显微镜×200)
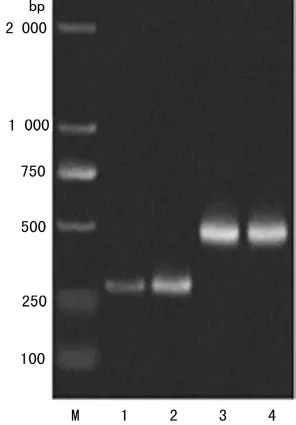
图5 PCR产物的电泳结果
2.5 半定量RT-PCR检测Twist1表达 对照组HCE1总RNA A260/A280为1.873 0,EMT组为1.904 0。对照组各条带OD值与内参OD比值为0.200 2±0.000 9,EMT组为0.615 6±0.005 1,EMT组Twist1表达比对照组增强,差异有统计学意义(P<0.05),见图5。
3 讨 论
EMT是胚胎发育中形态生发的一个关键过程,以上皮细胞极性的丧失及间质特性的获得为重要特征,具体包括:细胞黏附分子(E-cadherin)表达减少;角蛋白为主的细胞骨架转变为波形蛋白为主的细胞骨架,从而引起细胞形态的改变[2]。
本实验研究显示,宫颈癌HCE1细胞经过低剂量顺铂处理72h可发生EMT的形态变化,上皮细胞标志性蛋白E-cadherin表达减少、间质细胞标志蛋白Vimentin表达增强进一步证明EMT的发生。从生长曲线来看,生长曲线趋势72h前实验组慢于对照组,提示顺铂对肿瘤细胞有一定的杀伤作用,引起细胞的凋亡,72h后生长趋势逐渐接近并与对照组重合,说明顺铂诱导宫颈癌细胞发生EMT后,细胞生长速度会增快,因此,低剂量顺铂诱导宫颈癌细胞发生EMT是一个早期事件。
顺铂是宫颈癌化疗的一线药物,但宫颈癌细胞对化疗药物获得性耐药是化疗失败的主要原因,尤其用小剂量化疗药物诱导宫颈癌细胞,更易导致耐药的产生[3]。近年研究表明,多药耐药基因1(multi-drug resistance gene 1,MDR-1)编码的 P-gp的过表达与多药耐药(multi-drug resistance,MDR)发生有关[4],而P-gp蛋白表达升高的肿瘤细胞具有增强的侵袭转移能力,提示化疗药物诱导肿瘤细胞耐药性和侵袭性增强之间存在内在联系[5-6]。最近的研究证实肿瘤的侵袭转移、多药耐药还与EMT相关[7-8]。本实验显示EMT组HCE1细胞体外侵袭能力增强,P-gp蛋白表达增强,也从细胞生物学特性上证实低剂量顺铂诱导宫颈癌细胞HCE1发生了EMT。从上可知化疗药物在治疗早期诱导EMT是使宫颈癌化疗失败的关键性原因。因此,早期阻止EMT的发生,对防止形成耐药性、降低转移的风险有重要意义。
本实验中顺铂诱导宫颈癌细胞HCE1发生EMT后,Twist1表达明显高于EMT前,可以证实Twist1与宫颈癌细胞EMT的发生密切相关,是调节顺铂诱导HCE1发生EMT的关键转录因子。而碱性螺旋-环-螺旋家族的转录因子Twist,已 被 证 实 在 胃 癌[9-10]、乳 腺 癌[11-12]、前 列 腺 癌[13]、肝癌[14]这些实体肿瘤存在过表达,Twist表达的升高还与肿瘤的分期、预后有关[15]。本研究结果提示,针对Twist的基因抑制在宫颈癌化疗中可望产生协同作用,为提高临床肿瘤化疗效果提供一种新思路。
[1] Zhou C,Nitschke AM,Xiong W,et al.Proteomic analysis of tumor necrosis factor-alpha resistant human breast Cancer cells reveals a MEK5/Erk5-mediated epithelialmesenchymal transition phenotype[J].Breast Cancer Res,2008,10(6):R105.
[2] Yilmaz M,Christofori G.EMT the cytoskeleton and Cancer cell invasion[J].Cancer Metastasis Rev,2009,28(1/2):15-33.
[3] 赵晓利,李力,郭建新,等.顺铂诱导survivin表达改变与宫颈癌细胞化疗敏感性的关系[J].第三军医大学学报,2005,27(10):1023-1025.
[4] Gottesman MM,Pastan I.Biochemistry of multidrug resistance mediated by the multidrug transporter[J].Annu Rev Biochem,1993(62):385-427.
[5] Li QQ,Wang WJ,Xu JD,et al.Involvement of CD147in regulation of multidrug resistance to P-gp substrate drugs and in vitro invasion in breast Cancer cells[J].Cancer Sci,2007,98(7):1064-1069.
[6] Li QQ,Wang WJ,Xu JD,et al.Up-regulation of CD147 and matrix metalloproteinase-2,-9induced by P-glycoprotein substrates in multidrug resistant breast Cancer cells[J].Cancer Sci,2007,98(11):1767-1774.
[7] Chen WJ,Wang H,Tang Y,et al.Multidrug resistance in breast Cancer cells during epithelial-mesenchymal transition is modulated by breast Cancer resistant protein[J].Chin J Cancer,2010,29(2):151-157.
[8] Li QQ,Xu JD,Wang WJ,et al.Twist1-mediated adriamycin-induced epithelial-mesenchymal transition relates to multidrug resistance and invasive potential in breast Cancer cells[J].Clin Cancer Res,2009,15(8):2657-2665.
[9] Ru GQ,Wang HJ,Xu WJ,et al.Upregulation of twist in gastric carcinoma associated with tumor invasion and poor prognosis[J].Pathol Oncol Res,2011,17(2):341-347.
[10]Liu AN,Zhu ZH,Chang SJ,et al.Twist expression associated with the epithelial-mesenchymal transition in gastric Cancer[J].Mol Cell Biochem,2012,367(1/2):195-203.
[11]欧武陵,胡胜,余伟江,等.乳腺癌细胞Twist和Trkb的表达及其意义[J].武汉大学学报:医学版,2011,32(2):187-190.
[12]Fu J,Zhang L,He T,et al.TWIST represses estrogen receptor-alpha expression by recruiting the NuRD protein complex in breast Cancer cells[J].Int J Biol Sci,2012,8(4):522-532.
[13]Shiota M,Zardan A,Takeuchi A,et al.Clusterin mediates TGF-β-induced epithelial-mesenchymal transition and metastasis via Twist1in prostate Cancer cells[J].Cancer Res,2012,72(20):5261-5272.
[14]Ma JL,Han SX,Zhu Q,et al.Role of twist in vasculogenic mimicry formation in hypoxic hepatocellular carcinoma cells in vitro[J].Biochem Biophys Res Commun,2011,408(4):686-691.
[15]Entz-WerléN,Stoetzel C,Berard-Marec P,et al.Frequent genomic abnormalities at TWIST in human pediatric osteosarcomas[J].Int J Cancer,2005,117(3):349-355.

